蔬菜叶绿素不同提取方法的比较
2020-04-13王凤婷张鑫生潘洪玉刘金亮
王凤婷 张鑫生 潘洪玉 刘金亮


摘要 以小白菜、菠菜和生菜为实验材料,研究改良研磨法与浸提法在叶绿素提取定量测定中的应用,分析不同提取时间对叶绿素提取效果的影响。结果表明,改良研磨法操作简单、用时短、重复性好,且适用于不同植物材料,适合于大学生实验教学。浸提法操作非常简单、安全,只是实验时间较长,同时提取速度受较多因素的影响。
关键词 叶绿素,实验教学,提取方法,蔬菜
中图分类号 S-3文献标识码 A文章编号 0517-6611(2020)06-0001-03
Abstract Using Chinese cabbage, spinach and lettuce as experimental materials, this paper studied the application of the improved grinding method and the extraction method in chlorophyll extraction, and analyzed the effects of different extraction time on the chlorophyll extraction.The results showed that the improved grinding method was simple to operate,took a shorter time, and the repeatability was good. It was suitable for different plant materials and suitable for experimental teaching. The extraction method was very simple, but it took a long time, and its extraction speed was affected by many factors.
Key words Chlorophyll,Experimental teaching,Extraction method,Vegetables
叶绿素含量是植物生长发育的重要生理指标之一,其功能主要为吸收、传递光量子,进而影响 PSII、PSI之间能量的合成与转换,影响净光合速率,因此叶绿素含量与植物的光合作用、营养状况、生理状态等密切相关[1-2]。叶绿素含量无论是在品种选育还是植物抗性、生理状态方面都是重要的研究指标[3-4]。
叶绿素含量的测定是高等院校农学相关专业植物生理学课程的基础实验。目前关于不同植物叶绿素提取与含量测定的方法研究较多,常用的提取溶剂主要是乙醇、丙酮或二者的混合液,提取方法分为研磨和浸提2种。传统的研磨方法是植物材料经过研磨、过滤、定容后再进行比色测定,整个过程繁琐、时间长,操作中还易受光氧化的破坏,导致误差较大[5]。浸提法采用溶剂浸泡叶片的方法将叶绿素萃取出来,然后进行比色测定[6]。直接浸提法,虽然方法简單易行,免除了研磨提取中的繁琐手续,但不同植物叶绿体色素提取速度不同,最佳的提取时间和温度要求也不同[7]。
为了培养与提高大学生的科研创新技能,在本科实验教学中加大了设计性与综合性实验的比例,其中叶绿素的提取与测定是这类实验中常涉及到的一项内容。由于实验项目内容较多且学生操作技能不熟练,在有限的课堂时间内难以完成。为简化实验教学步骤、节省时间、提高效率,筛选一个快速、无耗损且提取率高的实验方法具有非常重要的意义。鉴于本科生实验受管制的药品较多(如丙酮、DMSO等),笔者选择安全性高的乙醇试剂为提取液,通过测定叶菜类蔬菜小白菜、菠菜、生菜的叶绿素含量,探索出适合实验教学的安全、高效、简单易操作的叶绿素提取方法。
1 材料与方法
1.1 材料、试剂与主要仪器
供试材料为小白菜、菠菜和生菜,均为人工气候室种植,新鲜度一致。试剂为分析纯乙醇(95%)。主要仪器包括紫外可见分光光度计(UV2100)、高速冷冻离心机(eppendorf-AG)、万分之一天平( 梅德勒)、电热恒温培养箱(DHP-9082)、海尔冰箱。
1.2 提取方法
1.2.1 浸提法。
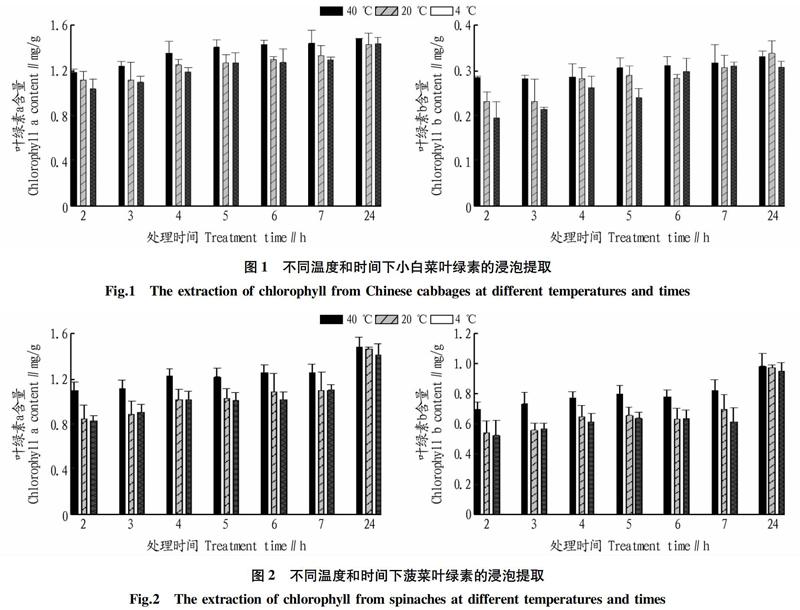
选取多片叶位一致的叶片,洗净,用吸水纸吸净叶片水分,避开主叶脉剪成2 mm 的细条,混匀后分别称取细条0.2 g放入具塞试管中,加入95%乙醇提取液中浸提,加塞遮光。浸提时间分别为2、3、4、5、6、7和24 h,提取温度分别为4、25和40 ℃。将提取液摇匀后分别于波长 665和 649 nm 下测定吸光度,重复3次。
由于叶绿素在不同溶剂中的吸收光谱有差异,因此,在使用不同溶剂提取色素时,计算公式也有不同。叶绿素a、b在95%乙醇中最大吸收峰的波长分别为665和649 nm,计算公式[8]:
组织中色素含量的计算(mg/g 鲜重):
1.2.2 改进的研磨法。
选取多片叶位一致的叶片,洗净,用吸水纸吸净叶片水分,并剪成 2 mm 的细条,混匀后分别称取细条0.2 g放入研钵中,加入少量 95%乙醇研磨提取,充分研磨后移入25 mL容量瓶中,用95%乙醇充分洗涤研钵和研棒,最后定容。提取液分别静置10、20、30、40、50、60 mim后转至离心管中离心5 min,转速6 000 r/min,取上清进行定量分析。测定计算方法同“1.2.1”。
改进的研磨法是通过离心代替了传统研磨法中的过滤步骤,缩短了时间,减少了叶绿素在提取过程中的降解[9]。
2 结果与分析
2.1 不同提取温度和时间下叶绿素的浸泡提取
小白菜叶绿素40 ℃下提取时,发现浸提6 h后提取量无显著差异,说明在40 ℃下提取6 h可达到较好的提取效果。在20 ℃和4 ℃下提取时,提取速度较慢,提取时间增加至24 h才能达到较好的效果。叶绿素b在40 ℃下提取浸提6 h后无显著差异,20 ℃和4 ℃下提取7 h与24 h无显著差异,这可能与叶绿素b的含量较少提取时间较短有关(图1)。
菠菜叶绿素提取时,提取时间在2~7 h提取温度高提取速度快,随着提取时间的延长提取量逐渐增大,当提取时间达到24 h,不同温度之间提取效果无显著差异,均能提取完全。这说明短时间浸泡提取中,适当高温可以增加叶绿素提取速度(图2)。
生菜叶绿素提取时,不同提取温度和时间下叶绿素提取量无显著差异,不同温度下提取7 h时均能达到较好的提取效果,但当提取时间长至24 h时,叶绿素含量有降低趋势。表明温度对生菜叶绿素提取速度影响不显著,这可能与生菜的叶片薄、叶绿素含量少比较容易提取有關。当提取时间长至24 h时,不同提取温度下的叶绿素含量均有下降,说明叶绿素有一定的降解(图3)。
2.2 改进的研磨法提取叶绿素
研磨法提取3种蔬菜的叶绿素时,提取时间小于20 min时,叶绿素未提取完全,随着提取时间的增加提取量逐渐增大,当提取时间在20~40 min时,叶绿素提取量无显著差异,而当提取时间长于40 min后,提取量有下降趋势,说明叶绿素有不同程度的降解。小白菜、菠菜和生菜的研磨提取中,由于叶片组织均被破碎,三者在提取时间上无差异(图4~6)。
2.3 叶绿素2种提取方法的比较
采用乙醇浸泡提取和乙醇研磨提取2种方法分别对叶菜类蔬菜小白菜、菠菜和生菜叶片叶绿素进行了提取、测定分析。结果表明,小白菜叶绿素40 ℃下提取6 h可以达到较好的提取效果,若提取温度较低,则需要延长提取时间,研磨法提取20 min则能充分提取,与40 ℃下浸泡提取6 h结果无显著差异,均能达到较好的效果。
菠菜叶绿素在较短的浸泡提取时间内不能充分提取,在4~40 ℃下提取时均需提取约24 h达到较好的效果,故提取时间较长,而研磨法提取仅需要研磨后静置20 min即可达到好的提取效果,与浸泡提取的最大值无显著差异。
生菜叶绿素浸泡提取时,温度对其提取速度的影响不明显,浸泡提取7 h测定值达到最大,研磨法提取同样需研磨后静置20 min,其测定值与浸泡提取最大值无差异。
综合上述结果表明,乙醇在对叶菜类的叶绿素提取中,浸提法与研磨法均可取得良好效果,不同的是浸泡提取需要时间较长,不同的提取材料需要的适宜温度与浸提时间不同,比较适宜于处理大量样品,而研磨法则提取时间短,操作相对浸提法复杂,适宜处理少量样品。
3 讨论
通过对3种蔬菜叶绿素提取方法和时间的比较发现,浸泡提取叶绿素时,小白菜40 ℃下提取6 h测定量较高,提取较充分,菠菜在不高于40 ℃的温度下提取时,提取时间增加至24 h才可以提取充分,生菜受温度的影响不显著,提取时间7 h提取量最高。因此,不同的植物材料采用浸提法提取叶绿素时,最佳的提取时间、提取温度不同,这与徐澜等[7]的研究结果一致,其发现小麦、冬青菠菜、油菜叶绿素的提取量最高时处理温度分别为 40、40、60、50 ℃,处理时间分别为 36、12、1.5、4.5 h。
浸泡提取时,生菜叶绿素提取值在提取7 h后有下降趋势,这可能与叶绿素的降解有关,而小白菜与菠菜提取时,由于提取速度较慢叶绿素的提取速率大于降解速率,故提取值无下降趋势。这说明叶绿素提取充分以后,要尽快进行含量测定,以防叶绿素降解导致测定值偏小。同时也表明叶绿素提取速度除受温度、时间影响外,还与样品的结构有关。浸泡提取叶绿素的速度一定程度上还受处理样品大小、提取液与样品比例的影响,适当地把样品粉碎或增加提取液的量有助于提高提取速度[10-13]。
该研究中,用改进的研磨法对3种叶菜类蔬菜的叶绿素进行了测定,均表现出一致的变化趋势,在研磨后静置20~40 min时,叶绿素测定值较高,此时间内叶绿素的降解较少,对测定值影响不显著。此方法避免了传统研磨法中的滤纸过滤速度慢、时间长、叶绿素受光氧化破坏使测定值偏低的缺点,具有快速、简单、重复性好,不受样品特性、温度、时间、提取液与样品比例等因素的影响,使用范围较广。
4 结论
2种叶绿素提取方法均采用乙醇为提取液,该试剂无毒、无腐蚀性,安全系数较高,比丙酮、甲醇、DMSO[14-15]等更适合用于本科生教学实验。改进的研磨法操作简单、用时短、重复性好,一个样品完成实验仅需0.5 h左右,而且适用于不同的植物材料,这大大节省了课堂时间。浸泡提取法操作十分简单,只是实验时间较长,同时提取速度受较多因素影响,在样品较少、工作量不大时不宜使用。
参考文献
[1] ZHOU X J,LIU Z G,XU S,et al.An automated comparative observation system for suninduced chlorophyll fluorescence of vegetation canopies[J].Sensors,2016,16(6):1-15.
[2] RATTAN K J.Comparative analyses of physiological assays and chlorophyll a variable fluorescence parameters:Investigating the importance of phosphorus availability in oligotrophic and eutrophic freshwater systems[J].Aquatic ecology,2017,51(3):359-375.
[3] PORRA R J.The chequered history of the development and use of simultaneous equations for the accurate determination of chlorophylls a and b[J].Photosynthesis research,2002,73(1/2/3):149-156.
[4] 弗里德GH,黑德莫诺斯GJ.生物学[M].田青涞,殷莹,马洌,等译.2版.北京:科学出版社,2002.
[5] 武卫华,刘忠荣,黄先敏,等.叶绿体色素的提取方法改进及其应用[J].北方园艺,2010(24):67-69.
[6] 徐新娟,李勇超,张尚攀,等.两种叶绿素提取方法的比较[J].湖北农业科学,2013,52(21):5303-5304,5321.
[7] 徐澜,许冰霞,张珺,等.不同材料叶绿素提取条件探究术[J].广州化工,2017,45(9):102-105.
[8] 李合生.植物生理生化实验原理和技术[M].北京:高等教育出版社,2000.
[9] QIU N W,WANG X S,ZHOU F.A new method for fast extraction and determination of chlorophylls in natural water[J].Z Naturforsch(C),2018,73(1/2):77-86.
[10] 吴兴壮,张华,张晓黎,等.西兰花叶叶绿素提取条件研究[J].农业科技与装备,2013(11):57-59.
[11] 昌梦雨,魏晓楠,王秋悦,等.植物叶绿素含量不同提取方法的比较研究[J].中国农学通报,2016,32(27):177-180.
[12] HISCOX J D,ISRAELSTAM G F.A method for the extraction of chlorophyll from leaf tissue without maceration[J].Canadian journal of botany,1979,57(12):1332-1334.
[13] 王琴,崔素萍,杨智明.盐地碱蓬中叶绿素的提取研究[J].当代畜牧,2017(36):57-59.
[14] ALPERT P.Analysis of chlorophyll content in mosses through extraction in DMSO[J].The bryologist,1984,87(4):363-365.
[15] 徐敏,劉君,阿衣古力·阿布都瓦依提.植物生理实验教学中叶绿素提取方法比较[J].实验科学与技术,2018,16(4):129-133.
