杨梅素通过PI3K/AKT/NF-κB信号通路对骨性关节炎发展的影响
2020-04-13杨鑫李源力蒋萍王冶
杨鑫,李源力,蒋萍,王冶
(川北医学院 附属医院 骨外科,四川 南充 637000)
骨性关节炎(osteoarthritis,OA)是一种多因素疾病,是导致全世界个体残疾的主要关节退行性疾病之一,特别是老年人[1].然而,目前可用于治疗OA的有效方法较少[2].因此,寻找新的治疗方法和药物对防治OA的发生发展至关重要.PI3K/AKT/NF-κB信号通路被证明在调节OA发病机制中的炎症介质具有重要作用[3].PI3K存在于各种细胞中,能够被细胞因子和理化因素激活[4].AKT处于PI3K的下游,在正常情况下,活化的PI3K能和磷酸肌醇依赖的激酶-1协同激活AKT[5].PI3K/AKT信号通路的下调会使NF-κB抑制性蛋白IKBα的表达下调,促进NF-κB磷酸化[6].NF-κB是一种多靶向细胞因子,参与细胞内的多种信号传递,调控多种基因的表达.然而,NF-κB信号通路的激活,会引起多种炎症因子的释放,如肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、白介素-6(interleukin-6,IL-6)等[7].杨梅素是一种天然存在的黄烷醇,具有抗炎、抗癌和抗糖尿病等多种功能[8],也能可以减少炎症酶和细胞因子脂多糖刺激的RAW264.7巨噬细胞的产生[9].最近的报道表明,杨梅素的抗癌作用与PI3K/AKT通路有关[10].然而,杨梅素在OA进展中的治疗作用仍然未知.本文通过对骨性关节炎与 PI3K/AKT/NF-κB信号通路相关性初步研究,探讨杨梅素在骨性关节炎进展中的治疗作用及其中潜在的分子机制.
1 材料与方法
1.1 试剂及仪器
IL-1β(批号:10734)购自北京凯瑞基生物科技有限公司.杨梅素(质量分数≥99.8%)(批号:B21458)购自上海源叶生物有限公司.10只1周龄SD大鼠和45只体质量180~220 g SD大鼠由川北医学院实验动物中心提供,许可证号:SCYK(川)2017-0005.Ⅱ型胶原蛋白酶(批号:BI-E2749),购自北京全式金公司.PBS(批号:PYG0021)、DMEM培养基(含青霉素和链霉素)(批号:DXT-12100046)购自武汉博士德公司.胎牛血清(批号:10099)、质量分数为0.25%的胰蛋白酶(批号:25300054)均购自美国Gibco公司.CCK-8试剂盒购自日本同仁研究所.ELISA试剂盒购于美国BOSTER公司.RIPA裂解液购自北京索莱宝公司.p-PI3K(批号:173665)、PI3K(批号:4249)、p-AKT(批号:4060)、AKT(批号:2920)、p-NF-κB P65(批号:8214)、NF-κB P65(批号:8242)、p-IKKαβ(批号:4927)、IKKβ(批号:4782)、IKBα(批号:4814)、p-IKBα(批号:2859)、GAPDH(批号:5174)抗体和山羊抗兔(鼠)IgG二抗(批号:3900;批号:7076)购自美国Cell Signaling Technology公司.PVDF膜(批号:IPVH00010)购自Millipore公司.
全自动酶标仪(型号:51119000)和石蜡切片机(HM 325)购自美国赛默飞世尔公司.电泳仪(批号:DYY-1C)购自北京六一仪器厂.流式细胞仪(型号:AMG0002051)购自美国BD公司.奥林巴斯IX83全自动荧光倒置显微镜(型号:IX83)购自日本奥林巴斯公司.
1.2 研究方法
1.2.1 软骨细胞分离与培养
为了软骨细胞的分离与原代培养,将10只1周龄SD大鼠膝关节上的软骨组织从股骨髁和胫骨剥离,用PBS和青霉素、链霉素分别冲洗3次,在培养皿(直径=60 mm)中用手术刀切成1 mm3的小块,接着用胰蛋白酶在37 ℃培养箱中先消化30 min,再用Ⅱ型胶原蛋白酶消化3 h.经过3 h消化后,用尼龙细胞过滤网(滤孔直径为100 μm)过滤组织以除去未消化的软骨组织,过滤后软骨细胞经离心(1 000 r/min,5 min)后弃去上清液,再次重悬于完全培养基(含质量分数为0.1 mg/mL青霉素、质量分数为0.1 mg/mL链霉素和体积分数为10%胎牛血清的DMEM)中,并接种于培养瓶中进行培养.所有细胞培养瓶置于37 ℃、体积分数为5%的CO2培养箱,每2~3 d更换一次完全培养基.
1.2.2 甲苯胺蓝染色法鉴定软骨细胞
(1)洁净的盖玻片在体积分数为70%的乙醇中浸泡5 min,灭菌的PBS清洗3 次,风干;(2)取处于对数期的细胞,按照细胞密度为1×106/mL接种至6孔细胞培养板中,将盖玻片均匀放入培养板中,加入完全培养基,置于37 ℃、体积分数为5% 的CO2培养箱中继续培养 48 h;(3)倾去培养液,PBS洗3次,每次10 min,加体积分数为4%多聚甲醛,室温下固定30 min;倾去多聚甲醛,PBS洗3次,每次10 min再加入体积分数为70%乙醇,室温下固定 30 min;(4)弃去上述乙醇固定液,PBS洗3次,每次10 min,晾干,加入含体积分数为30%乙醇的甲苯胺蓝溶液染色30 min;PBS洗3次,每次10 min,然后再用无水乙醇洗10 min;(5)取出细胞玻片,干燥后用中性树脂封片,显微镜下观察并摄片.软骨细胞经甲苯胺蓝染色会呈紫蓝色.
1.2.3 CCK-8筛选诱导损伤最适质量浓度的IL-1β
将软骨细胞按2×105/mL分别接种到96孔板上,每孔200 μL.置于37 ℃,体积分数为5%的CO2培养箱中孵育24 h,至细胞贴壁.弃去上清液,空白组加入PBS溶液,对照组加入完全培养基,其余各组分别加入含有不同质量浓度(1,5,10,50,100 ng/mL)IL-1β的完全培养基,每孔200 μL,每组设置6个复孔.置于37 ℃,体积分数为5% 的CO2培养箱中孵育24 h后加入CCK8,轻轻震荡均匀后放入37 ℃、体积分数为5% 的CO2培养箱中孵育30 min,于酶标仪450 nm处测定各孔光密度值D(450 nm).按照公式计算细胞存活率.取半数致死量的质量浓度为诱导损伤最适质量浓度.
细胞存活率=
1.2.4 CCK-8筛选最适作用浓度的杨梅素检测
将软骨细胞按2×105/mL分别接种到96孔板上,每孔200 μL.置于37 ℃,体积分数为5%的 CO2的培养箱中孵育24 h,至细胞贴壁.弃去上清液,空白组加入PBS溶液,对照组加入完全培养基,IL-1β模型组与用药组均加入含有诱导炎症最适质量浓度的IL-1β完全培养基,每孔200 μL,每组设置6个复孔.置于37 ℃,体积分数为5% 的CO2的培养箱中孵育24 h之后,弃去上清液,空白组加入PBS溶液,对照组和IL-1β模型组加入完全培养基,其余组各加入含有不同浓度(5,10,15,20 μmol/L) 杨梅素的完全培养基,每孔200 μL.置于37℃,体积分数为5% 的CO2的培养箱中孵育24 h或48 h后,加入20 μL CCK-8,轻轻震荡均匀后放入37℃、体积分数为5%的 CO2培养箱中孵育30 min,于酶标仪450 nm处测定各孔光密度值D(450 nm).按照公式计算细胞存活率.取存活率最高的杨梅素浓度为最适作用浓度.
1.2.5 克隆形成实验检测细胞的增殖能力
软骨细胞分为3组:对照组,IL-1β模型组和杨梅素组.对照组细胞一直用完全培养基培养48 h,IL-1β模型组细胞为经诱导损伤最适质量浓度的IL-1β完全培养基溶液干预培养48 h,杨梅素组细胞为经IL-1β诱导24 h后,再经最适作用浓度的杨梅素完全培养基溶液培养24 h.培养结束后的各组细胞以1×103/孔接种于60 mm细胞培养皿中.10 d后,用结晶紫染色溶液染色细胞,并计数含有≥30个细胞的集落,用奥林巴斯荧光倒置显微镜拍摄代表性集落并统计.实验独立重复3次.
1.2.6 细胞分组
细胞实验分为3组:对照组,IL-1β模型组和杨梅素组.对照组细胞一直用完全培养基培养48 h,IL-1β模型组细胞为经诱导损伤最适质量浓度的IL-1β完全培养基溶液干预培养48 h,杨梅素组细胞为经IL-1β诱导24 h后,再经最适作用浓度的杨梅素完全培养基溶液培养24 h.
1.2.7 细胞流式术检测细胞凋亡率
培养结束后的各组细胞用冷PBS清洗两次,然后在结合缓冲液中重悬并稀释为1×105/mL.严格按照Annexin V-FITC/PI凋亡检测试剂盒说明书进行操作,用流式细胞仪进行细胞凋亡率的检测.实验独立重复3次.
1.2.8 酶联免疫法检测细胞上清液中TNF-α、IL-6和IL-10的质量浓度
1.2.9 Western blot检测PI3K/AKT/NF-κB信号通路相关蛋白的表达情况
培养结束后的各组细胞用蛋白酶抑制剂裂解液裂解细胞后提取蛋白,用BCA法测定总蛋白含量.取等量蛋白质样品上样,SDS-PAGE凝胶电泳分离蛋白质后转膜,用质量分数为5%脱脂奶粉封闭1 h,之后加入稀释后的p-PI3K(Vp-PI3K∶V抗体稀释液=1∶2 000)、PI3K(VPI3K∶V抗体稀释液=1∶2 000)、p-AKT(Vp-AKT∶V抗体稀释液=1∶2 000)、AKT(VAKT∶V抗体稀释液=1∶1 000)、p-NF-κB P65(Vp-NF-κB P65∶V抗体稀释液=1∶2 000)、NF-κB P65(VNF-κB P65∶V抗体稀释液=1∶1 000)、p-IKKαβ(Vp-IKKαβ∶V抗体稀释液=1∶1 000)、IKKβ(VIKKβ∶V抗体稀释液=1∶2 000)、IKBα(VIKBα∶V抗体稀释液=1∶1 000)、p-IKBα(Vp-IKBα∶V抗体稀释液=1∶2 000)和GAPDH(VGAPDH∶V抗体稀释液=1∶2 000)一抗,4 ℃摇床上孵育过夜.用TBST洗膜3次,每次10 min,加入对应于一抗种属来源的HRP标记的二抗,在室温摇床上孵育1 h,用TBST洗膜3次,每次10 min.使用ECL化学发光液显色发光,凝胶成像系统拍照,Image Pro Plus图像分析系统对蛋白条带进行分析.
1.2.10 骨性关节炎动物模型构建与分组给药
分组:将45只SD大鼠适应性喂养1周后,随机分为3组,每组15只,分别为假手术组、OA模型组和杨梅素组.
造模:SD大鼠经腹腔注射水合氯醛(0.3 mL/100 g)进行麻醉.麻醉成功后,在超静工作台中切开大鼠右膝关节沿髌韧带内侧缘皮肤约0.5~1 cm,并分别切断内侧副韧带和前交叉韧带,同时摘除内侧半月板,逐层缝合.术后连续肌肉注射抗生素治疗3 d;SD大鼠随机分组回笼后正常饲养,同时观察各组大鼠的伤口愈合情况、患肢活动量、饮食等并记录.假手术组只分离不做切断与摘除.剔除实验过程中死亡的大鼠.
给药:造模后第2天,杨梅素组按每千克大鼠体质量每天给予含质量20 mg的杨梅素水溶液[11]连续灌胃给药8周,假手术组和OA模型组则同步给予等体积生理盐水.
1.2.11 Masson染色观察各组大鼠软骨组织的组织结构变化
同样,类似的手段也被上海陶艺家李游宇先生所应用。他将陶瓷作为一种材质处理后,用手、脚做出粗陶壁画,整体搬到室内装饰墙上。这种装饰方式带着明显的人工痕迹,又因未施釉,而显示出一种原始的古朴与粗犷,具有不事雕琢的质感,使得环境氛围没有丝毫压抑感,具有一种打动心灵的亲和力。他还将数量众多的陶瓷造型花瓶捏扁,喷上彩釉烧成后,镶嵌在墙面上,具有强烈的视觉冲击力。还有诸如欧洲古典风格的瓷雕,古罗马故事里的陶瓷等等。这些别具匠心的陶瓷设计与所处空间达到和谐统一,魅力十足。
末次灌胃2 h后,各组大鼠经腹腔注射水合氯醛(0.3 mL/100 g)进行麻醉,迅速采取膝关节组织.关节组织标本按常规方法进行石蜡切片.按照常规方法染色:①苏木精染核30 s,用自来水洗1次;②丽春红品红染色液染1 min,用自来水洗1次;③苯胺蓝染色液染2 min,用自来水洗1次;④ 0.2%冰醋酸水溶液浸洗片刻;95%乙醇、无水乙醇、二甲苯透明各5 min、中性树胶封片.荧光倒置显微镜下观察各组大鼠软骨组织的组织结构变化.
1.2.12 ELISA检测各组大鼠关节液中TNF-α、IL-6和IL-10表达水平
末次灌胃2 h后,各组大鼠取样时均留取关节液,并稀释50倍.按ELISA试剂盒操作说明进行后续的实验.之后用酶标仪测定每孔在450 nm处的OD值,计算每孔中TNF-α、IL-6和IL-10的质量浓度.
1.3 统计学方法

2 结果
2.1 软骨细胞鉴定
提取的原代细胞经过3次传代后,培养2~3 d,细胞贴壁、变形,呈三角形或多角形(图1A);培养第3代的软骨细胞生长均匀,细胞形态不一,扁平有突起,经甲苯胺蓝染色,细胞核呈蓝色,细胞质为浅蓝色,着色较细胞核浅,胞质中可见少许异染颗粒(图1B).符合软骨细胞特征,因此可用于后续实验.
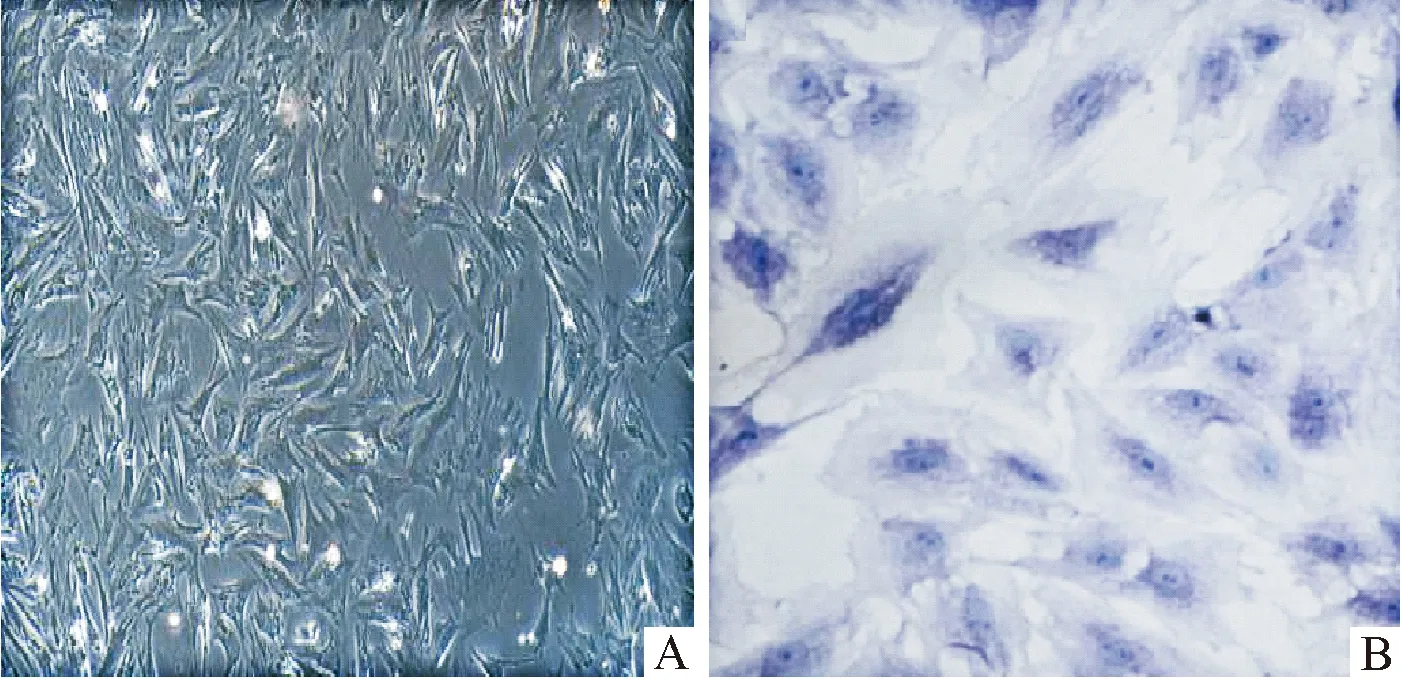
A:软骨细胞形态(×40);B:甲苯胺蓝染色鉴定软骨细胞(×100).
A:Morphology of chondrocytes (×40);B:identification of chondrocytes by toluidine blue staining(×100).
图1 软骨细胞的鉴定
Fig.1 Identification of chondrocytes
2.2 诱导损伤最适质量浓度的IL-1β
选定质量浓度梯度范围(1、5、10、50、100 ng/mL)的IL-1β均能明显抑制软骨细胞的增殖,且随着质量浓度的增加,抑制效果也逐渐增强.当IL-1β的质量浓度为10 ng/mL时,CCK-8检测24 h后细胞存活率为48.36%(P<0.01),接近半数致死量 .因此确定质量浓度10 ng/mL的IL-1β为诱导软骨细胞损伤的最适质量浓度(图2).

1) 与对照组比较,P<0.05;2) 与对照组比较,P<0.01;3) 与对照组比较,P<0.001
1) compared with the control group,P<0.05;2) compared with the control group,P<0.01;3) compared with the control group,P<0.001
图2 IL-1β对软骨细胞存活率的影响
Fig.2 Effect of IL-1β on chondrocyte survival
2.3 杨梅素对IL-1β诱导损伤的软骨细胞的治疗作用
IL-1β诱导软骨细胞后,IL-1β模型组相对于对照组的细胞存活率明显降低(P<0.001),而与IL-1β模型组比较,浓度为5、10 μmol/L的杨梅素能明显提高损伤后的软骨细胞的细胞存活率,具有明显的治疗作用,但浓度为15 μmol/L时,软骨细胞的增殖明显减少,说明杨梅素对细胞有毒性作用(图3).故对IL-1β损伤后的软骨细胞起治疗作用的杨梅素浓度应该控制在0~10 μmol/L.在后续实验中杨梅素最适作用浓度选择为10 μmol/L,作用时间为24 h.
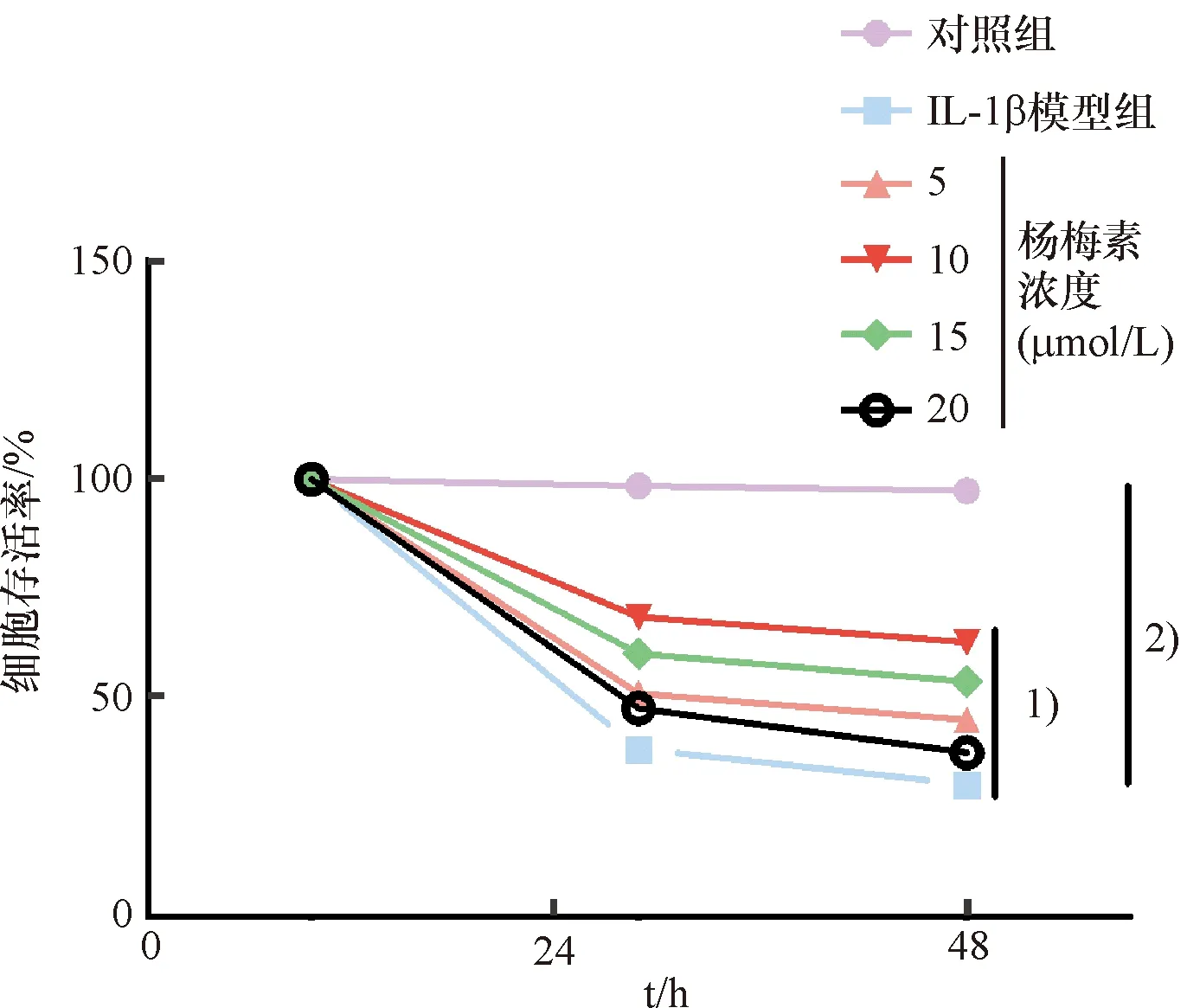
1) 与IL-1β模型组比较,P<0.05;2) 与IL-1β模型组比较,P<0.01.
1) Compared with the IL-1 β model group,P<0.05;2) Compared with the IL-1 β model group,P<0.01.
图3 杨梅素对IL-1β损伤软骨细胞的治疗作用
Fig.3 Protective effect of myricetin on IL-1β-damaged chondrocytes
2.4 杨梅素对IL-1β诱导损伤的软骨细胞增殖的影响
与对照组相比,IL-1β模型组中软骨细胞增殖能力显著下降(P<0.01);与IL-1β模型组比较,杨梅素组中软骨细胞增殖能力提高(P<0.05)(图4).
2.5 杨梅素对IL-1β诱导损伤的软骨细胞凋亡的影响
与对照组相比,IL-1β模型组中软骨细胞凋亡能力显著提高(P<0.001);与IL-1β模型组比较,杨梅素组中软骨细胞凋亡能力下降(P<0.01)(图5).

1)与IL-1β模型组比较,P<0.05;2) 与对照组比较,P<0.01.
1) Compared with IL-1β model group,P<0.05;2) Compared with control group,P<0.01.
图4 杨梅素对IL-1β诱导的软骨细胞增殖的影响
Fig.4 Effect of myricetin on IL-1β-induced chondrocyte proliferation
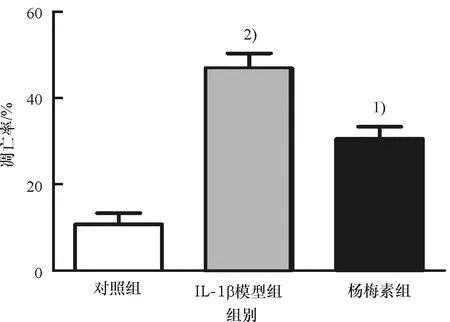
1) 与IL-1β模型组比较,P<0.01;2)与对照组比较,P<0.001.
1) Compared with the IL-1 β model group,P<0.01;2) Compared with the control group,P<0.001.
图5 杨梅素对IL-1β诱导的软骨细胞凋亡的影响
Fig.5 Effect of myricetin on apoptosis of IL-1β-induced chondrocytes
2.6 杨梅素对IL-1β诱导损伤的软骨细胞培养液中TNF-α、IL-6和IL-10质量浓度的影响
与对照组比较,IL-1β模型组软骨细胞培养液中TNF-α、IL-6质量浓度均增加(P<0.01),IL-10质量浓度减少(P<0.01);与IL-1β模型组比较,杨梅素组软骨细胞培养液中TNF-α、IL-6质量浓度均减少(P<0.05),IL-10质量浓度增加(P<0.05,表1).
2.7 杨梅素对IL-1β诱导损伤的软骨细胞中PI3K/AKT/NF-κB信号通路相关蛋白的表达影响
与对照组比较,IL-1β模型组软骨细胞中PI3K、AKT、NF-κB P65、IKKαβ、IKBα蛋白的磷酸化程度均上调(P<0.001),IKBα 蛋白表达下调(P<0.01);与IL-1β模型组比较,杨梅素组软骨细胞中PI3K、AKT、NF-κB P65、IKKαβ、IKBα蛋白的磷酸化程度均下调(P<0.05),IKBα蛋白表达上调(P<0.05) (图6).

表1 杨梅素对IL-1β诱导损伤的软骨细胞培养液中TNF-α、IL-6和IL-10的质量浓度的影响Table 1 Effect of myricetin on the concentration of TNF-α,IL-6 and IL-10 in culture medium of chondrocytes induced by IL-1β
1)与IL-1β模型组比较,P<0.05;2) 与IL-1β模型组比较,P<0.01;3) 与对照组比较,P<0.01;4) 与对照组比较,P<0.001.
1) Compared with the IL-1 β model group,P<0.05;2) Compared with the IL-1 β model group,P<0.01;3) Compared with the control group,P<0.01;4) Compared with the control group,P<0.001.
2.8 各组大鼠软骨组织病理变化
Masson结果显示:假手术组大鼠软骨细胞形态规则,染色呈蓝色,软骨组织的胶原纤维排列紧密;OA模型组大鼠软骨细胞含量较少,细胞紊乱分布,细胞呈多形性且细胞质少,软骨组织的胶原纤维排列紊乱,局部出现明显断裂和降解;杨梅素组软骨细胞形态较规则,软骨组织的胶原纤维排列比较紧密(图7).
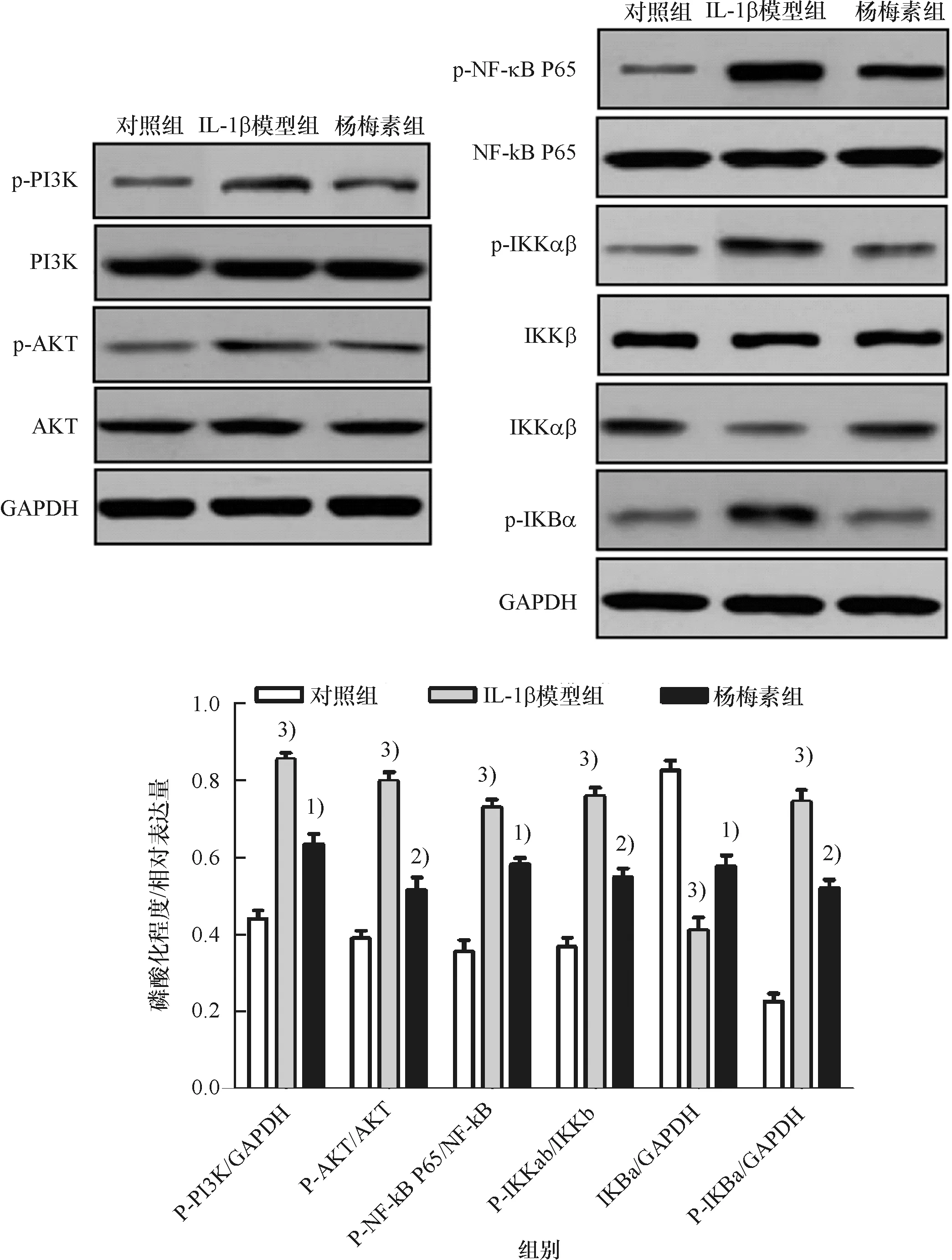
1) 与IL-1β模型组比较,P<0.05;2) 与IL-1β模型组比较,P<0.01;3)与对照组比较,P<0.001.
1) Compared with the IL-1 β model group,P<0.05;2) Compared with the IL-1 β model group,P<0.01;3) Compared with the control group,P<0.001.
图6 杨梅素对IL-1β诱导的软骨细胞中PI3K/AKT/NF-κB信号通路相关蛋白的表达情况
Fig.6 Effect of myricetin on the expression of PI3K/AKT/NF-κB signaling pathway-related proteins in IL-1β-induced chondrocytes
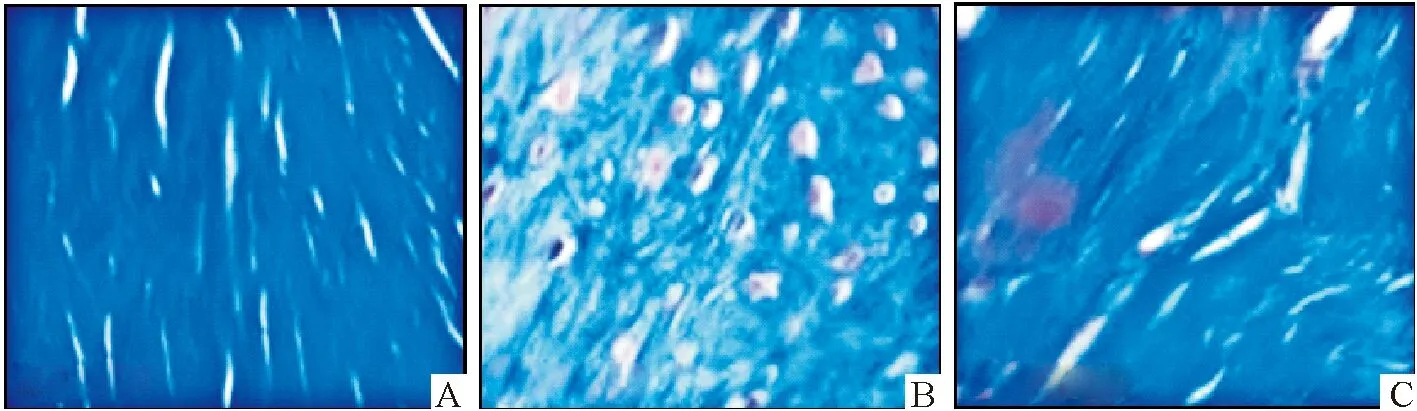
A:假手术组;B:OA模型组;C:杨梅素组.A:sham operation group;B:OA model group;C:myricetin group.图7 Masson染色观察各组大鼠软骨组织的结构 (×400)
Fig.7 The structure of rat cartilage tissue observe by Masson staining (×400)
2.9 各组大鼠关节液中TNF-α、IL-6和IL-10表达情况比较
与假手术组比较,OA模型组大鼠关节液中TNF-α、IL-6质量浓度均增加(P<0.001),IL-10质量浓度减少(P<0.01);与OA模型组比较,杨梅素组大鼠关节液中TNF-α、IL-6质量浓度均减少(P<0.05),IL-10质量浓度增加(P<0.05).(表2).

表2 各组大鼠关节液中TNF-α、IL-6和IL-10表达情况比较Table 2 Comparison of expression of TNF-α,IL-6 and IL-10 in synovial fluid of rats in each group
1) 与OA模型组比较,P<0.05;2) 与OA模型组比较,P<0.01;3) 与假手术组比较,P<0.01;4) 与假手术组比较,P<0.001.
1) Compared with osteoarthritis group,P<0.05;2) Compared with osteoarthritis group,P<0.01;3) Compared with sham operation group,P<0.01;4) Compared with sham operation group,P<0.001.
3 讨论
OA是一种常见的关节病,其特征在于软骨损失和破坏.OA会显著引起老年人的关节疼痛和身体残疾[12-13].随着世界人口的老龄化,OA的患病率正在上升.大约25%的55岁以上的人患有膝盖疼痛[14].
PI3K/AKT/NF-κB途径被证明在OA发病机制中的炎症介质具有重要作用.IL-1β能够激活PI3K/AKT/NF-κB信号级联,诱导分解代谢因子的表达.研究发现IL-1β刺激激活PI3K和AKT的磷酸化,从而使p-PI3K和p-AKT蛋白的磷酸化水平上调.此外,IL-1β触发IKKαβ和IKBα的磷酸化,进而释放p65并将其从细胞质转移至细胞核[15].Huang等[16]研究表明,IL-1β能诱导细胞中ERK,JNK,PI3k和AKT,IKKαβ和IKBα的磷酸化,并促进NF-κB的核转位.因此,IL-1β与PI3K/AKT/NF-κB信号通路关系密切.
杨梅素是广泛存在的黄酮类化合物,已有研究报道杨梅素及其衍生物具有抗菌、抗病毒、抗癌、抗炎、抗氧化应激和降糖等活性[17].舒雪莲等[18]研究发现,连续给杨梅素(1.5 mg/kg)2周可改善佐剂性关节炎小鼠原发性关节滑膜增生,减少炎症细胞浸润,并降低小鼠关节肿胀率及血清炎症因子水平.但是杨梅素在骨性关节炎的研究中甚少,其是否对骨性关节炎有缓解作用,需要进一步的研究.
本实验首先确定了IL-1β的最适质量浓度来建立体外骨性关节炎模型,当IL-1β的质量浓度为10 ng/mL时,细胞抑制率为48.36%,接近半数致死量,因此在后续实验中使用.之后,确定杨梅素的最佳浓度来提高细胞活性,当杨梅素浓度10 μmol/L时,能明显提高损伤后的软骨细胞的活性,因此后续实验杨梅素的浓度选择10 μmol/L.为了研究杨梅素是否对IL-1β诱导损伤的软骨细胞有治疗作用,进行了克隆形成实验和流式细胞仪实验,结果表明:克隆形成实验和流式细胞实验结果表明,杨梅素能提高软骨细胞的增殖能力,降低软骨细胞的凋亡能力;同时杨梅素使IL-1β诱导损伤的软骨细胞中TNF-α、IL-6质量浓度均减少,IL-10质量浓度增加;Western blot实验也表明杨梅素能使IL-1β诱导损伤的软骨细胞中PI3K、AKT、NF-κB P65、IKKαβ、IKBα蛋白的磷酸化程度均下调,IKBα蛋白表达上调.为了进一步证实杨梅素对骨性关节炎的治疗作用,本研究进行了体内实验,Masson结果显示:杨梅素使受损的软骨细胞形态变规则,软骨组织的胶原纤维排列变紧密;同时使大鼠关节液中TNF-α、IL-6质量浓度均减少,IL-10质量浓度增加.因此,杨梅素可促进软骨细胞增殖,抑制软骨细胞的凋亡,抑制骨性关节炎炎症反应,抑制PI3K/AKT/NF-κB信号通路的激活,明显缓解关节软骨的退变,降低骨性关节炎的进展水平,对骨性关节炎有一定的治疗作用.
综上所述,杨梅素能延缓骨性关节炎软骨的退变,改善关节软骨代谢.骨性关节炎的病理发展与PI3K/AKT/NF-κB信号通路存在紧密的联系,杨梅素可能通过抑制PI3K/AKT/NF-κB信号通路来促进软骨细胞增殖、抑制软骨细胞的凋亡、抑制骨性关节炎炎症反应,在骨性关节炎的治疗中有广泛的应用前景.但是,杨梅素是否通过其他通路对该病有缓解作用,需要进一步的研究.
