TIA抗原基因原核表达载体的构建及表达
2020-04-13吴世锴田和沈思卢浩刘霁月王昊
吴世锴,田和,沈思,卢浩,刘霁月,王昊
(暨南大学 附属第一医院 麻醉科,广东 广州 510632)
重组cDNA表达克隆血清学鉴定技术(serological identification of antigens by recombinant cDNA expression cloning,SEREX)是由德国血清学免疫学家Sahin教授等[1]提出并开发的利用自体血清筛选疾病抗原基因的方法.多用于识别肿瘤相关抗原,迄今为止,已有超过2 700余种肿瘤相关抗原被发现[2-7].近年来,SEREX技术在自身免疫性疾病中的应用也开始有所报道[8-9].SEREX方法用于与人类自身免疫性疾病相关的自身抗原已得到验证[10].短暂性脑缺血发作(transient ischemic attack,TIA)是急性脑梗死(acute cerebral infarction,aCI)的高危信号和特级预警事件,发现具有特异性与敏感性TIA生物标志物,可避免TIA后aCI的发生[11-12].本课题组在既往研究中筛选出70个重组cDNA克隆pBluescript质粒[13],应用Ligation和In-Fusion基因重组技术,将目的基因插入原核表达载体质粒pGEX-4T-1,2,3,并在大肠杆菌中表达重组融合目的蛋白,通过SDS-聚丙烯酰氨凝胶电泳(SDS-PAGE)分析表达产物,成功重组的pGEX-4T载体可作为进一步研究血清抗体的靶抗原.
1 材料和方法
1.1 材料
1.1.1 目的基因(SEREX抗原基因)
目的基因源自本课题组的既往研究[13]:用TIA患者血清对人主动脉内皮细胞cDNA文库(human aortic endothelial cell cDNA library)进行SEREX重组表达克隆筛选后,获得的含目的基因片段的噬菌体载体(Uni-ZAP XR).通过构建搭载目的基因的pBluescript质粒,并进行核苷酸序列的测定及NCBI-BLAST同源序列分析,确定对70个独立的cDNA克隆重组原核表达载体.
1.1.2 材料
空载质粒pGEX-4T、含SEREX抗原基因序列的重组pBluescriptSK(+)质粒、E.coliBL -21(DE3)感受态细胞由本实验室保存;限制性核酸内切酶Xho I、EcoRI、BamHⅠ和SmaⅠ、PrimeSTAR高保真酶购于TaKaRa公司;异丙基硫代半乳糖苷(IPTG)、小量质粒提取试剂购自Sigma-Aldrich公司;快速DNA连接反应试剂盒Ligation-Convenience Kit购自Nippon Gene公司、Ligation High ver.2购自TOYOBO公司、Blunting-Convenience Kit(包括:T4 DNA Polymerose 25 μL;10倍Blunting Buffer 50 μL;2倍Ligation Mix 250 μL)购自Nippon Gene公司;其余材料、试剂盒、实验耗材购自Kord-Valmark、Greiner bio-one、SANYO等公司.
1.2 方法
1.2.1 重组蛋白表达载体:Ligation策略
利用DNALigation基因重组技术,将搭载SEREX抗原基因的pBluescriptSK(+) 质粒载体转换为GST融合蛋白表达载体pGEX-4T-1,2,3.根据插入片段DNA测序结果的序列分析,选择合适的pGEX-4T载体.
(1)pGEX-4T载体质粒的中量提取 分别从-80 ℃保存的甘油菌中抽取pGEX-4T-1 10 μL、pGEX-4T-2 10 μL、pGEX-4T-3 5 μL×2,加入4个装有90 mL LB培养基的灭菌锥形瓶中,37 ℃振荡过夜;90 mL菌液分装2个50 mL尖底离心管后离心(8 000 r/min,3 min,25 ℃),弃上清,收集沉淀,用15 mL PBS缓冲液冲洗细胞后合并1个50 mL离心管中,再次离心(8 000 r/min,3 min,25 ℃),弃上清,保留沉淀;用4 mL 细胞重悬液重悬沉淀,加入4 mL 细胞裂解液并翻转6~8次直至混合液变得透明、黏稠后再加入4 mL冷藏中和液并翻转4~6次;加入3 mL 结合液至中和后的细胞裂解液中,手动翻转离心管1~2次,将GenElute HP Midiprep Binding Column插入多头抽真空装置,加入4 mL Column Preparation Solution洗涤Column并滤过;加入 2次4 mL Column Preparation Solution洗涤Column并滤过,将Binding Columns转移入新的收集管,加入1 mL Elution Solution至Column后25 ℃静止1 min后3 000 r/min离心5 min,收获质粒DNA在收集管中.取2 μL质粒 DNA用紫外光吸收法测定质粒 DNA的浓度.
(2)pGEX-4T载体的双酶切 限制性内切酶(EcoR Ⅰ /Xho Ⅰ、BamH Ⅰ /Xho Ⅰ 或Sma Ⅰ /Xho Ⅰ)反应体系每管40 μL,37 ℃酶切过夜后进行琼脂糖凝胶电泳:每管加入8 μL的6倍Gel Loading Dye充分混匀后,48 μL混合液均分加样于质量分数为1%琼脂糖凝胶的两个相邻泳道中(DNA标记物10 μL;电泳液为TBE缓冲液;电压100 V).准备Spin Columns:将Spin columns插入2 mL collection tubes,加入100 μL双蒸水离心(15 000 r/min,5~10 s,25 ℃)后转移入新的收集管;紫外透射仪下切取目的条带,置入准备好的Spin Columns,15 000 r/min 4 ℃离心10 min,收获pGEX-4T载体线性片段在收集管中.
(3)目的基因的分离纯化 根据插入片段cDNA的序列分析,选择合适的酶切组合进行分离回收以最大可能保持CDS的完整性.限制性内切酶(EcoRⅠ/XhoⅠ、BamHⅠ/XhoⅠ或SmaⅠ/XhoⅠ)反应体系20 μL/管.37 ℃酶切2 h后进行琼脂糖凝胶电泳:每管加入4 μL的6倍Gel Loading Dye混匀后加样于质量分数为1% 琼脂糖凝胶的泳道中,其余方法参照pGEX-4T载体片段回收.使用每5 μL Gene Ladder Wide 2 DNA量(ng)对应表,采用EtBr荧光强度法,通过测定嵌入DNA中EtBr分子的荧光强度定量插入片段的DNA.
(4)纯化的目的片段与pGEX-4T载体线性片段Ligation 对于EcoRⅠ/XhoⅠ酶切分离的cDNA片段,使用Ligation-Convenience Kit;对于BamHⅠ/XhoⅠ酶切分离的cDNA片段,使用Ligation High ver.2;对于SmaⅠ/XhoⅠ酶切分离的cDNA片段,使用Blunting-Convenience Kit.酶切产物的连接反应体系6 μL加0.2 mL PCR管(插入片段cDNA 2 μL,pGEX-4T载体1 μL,Ligation Kit 3 μL).混合液置于PCR仪,反应条件:16 ℃ Ligation-Convenience Kit>3 h;Ligation High ver.2反应30 min;Blunting-Convenience Kit 1 h.将感受态细胞大肠杆菌BL-21至冰上融化,取6 μL连接产物与26 μL BL-21充分混匀后,在冰上静置5~10 min.然后置于42 ℃恒温金属浴1 min,于热休克下转化感受态细胞,取转化产物涂布平板法均匀铺于LB琼脂平板上,37 ℃倒置培养过夜,筛选获得阳性克隆.
1.2.2 重组蛋白表达载体:In-Fusion策略
In-Fusion基因克隆技术重组pGEX-4T 载体适用于插入片段CDS含有EcoRⅠ/XhoⅠ、BamHⅠ/XhoⅠ和SmaⅠ/XhoⅠ的酶切位点及使用上述限制性内切酶无法获得完整CDS的目的基因.根据插入片段的测序结果与酶切分析和pGEX-4T 载体图谱,使用clontech公司提供的在线支持工具(http://bioinfo.clontech.com/infusion)设计引物:正向引物Forward primer 5′-GTGGATCCCC-GAATT… …AAAAGCTGGAGCTCC-3′;反向引物Reverse primer 5′-GATGCGGCCGCTCGA… …CGAA-TTGGGTACCGG-3′.使用EcoRⅠ/XhoⅠ酶切pGEX-4T载体后行琼脂糖凝胶电泳,EtBr荧光强度法推测载体片段的DNA量,切胶回收线性载体片段.以搭载SEREX抗原基因序列的pBluescript质粒为模板,加入正、反向引物,在热启动KOD-Plus作用下扩增插入的cDNA片段.PCR总反应体系30 μL/管,反应参数:94 ℃预变性2 min、94 ℃变性15 s、64 ℃退火30 s、68 ℃延伸3 min、扩增30个循环,总反应时间:2 h 13 min.每管PCR产物30 μL加入6 μL的6倍Gel Loading Dye混匀后加样于质量分数为1% Agarose large gel的泳道中进行琼脂糖凝胶电泳,纯化回收的方法参照pGEX-4T载体片段回收.取1 μL纯化的PCR产物,用Milli-Q water稀释至10 μL/管后,加入2 μL的XL-DNA Ladder 100 plus充分混匀后加样于质量分数为1% 琼脂糖凝胶进行琼脂糖凝胶电泳,根据每5 μL XL-DNA Ladder 100 plus DNA质量(ng)对应表,测定样本的DNA含量.按目的基因与载体摩尔比为2∶1的比例在6 μL反应体系内16 ℃连接3 h以上.取6 μL连接产物热休克下转化感受态细胞,取转化产物涂布平板法均匀铺于LB琼脂平板上,37 ℃倒置培养过夜,筛选获得阳性克隆.
1.2.3 蛋白电泳(SDS-聚丙烯酰氨凝胶电泳)鉴定重组质粒
重组质粒的扩增后,每个样本各取100 μL菌液分装入2个1.5 mL Reaction tubes (50 μL/管),再每管加入450 μL的 LB-Ampicillin Broth后,予37 ℃,260 rpm摇菌培养1 h.然后,每个样本其中一管菌液加入10 μL浓度为5 mmol/L IPTG(终浓度0.1 mmol/L)诱导GST蛋白表达,另一管菌液作为空白对照,继续培养2.5~3.0 h.4 ℃离心菌液8 000 r/min,3 min后弃上清,收集沉淀,用1 mL PBS Buffer洗涤细胞后,再次4 ℃离心8 000 r/min,3 min,完全去除上清,保留沉淀;充分重悬沉淀后,即刻置入105 ℃恒温金属浴热处理3 min,然后立即4 ℃低温快速离心1~2 s.SDS-聚丙烯酰氨凝胶电泳分析表达产物:体积分数为11%分离胶;Protein 标记物 8 μL;40 mA;每2条胶泳道110 min.每个样本取10 μL 上样于浓缩胶(Stacking gel)泳道.SDS-PAG放入考马斯亮蓝染色液(CBB staining solution)中慢摇着色1 h后,于脱色液中脱色过夜.次日观察是否有IPTG诱导GST融合蛋白(IPTG-induced GST-fusion proteins)的条带(Band)出现.
1.2.4 DNA测序鉴定成功表达的质粒
小量提取重组质粒,方法同小量提取pBluescript质粒,琼脂糖凝胶电泳,获得比pGEX-4T空载体(pGEX-4T empty vector:4 900 bp)分子量大的重组质粒行对应内切酶的酶切鉴定,以选送有相应大小片段酶切产物的质粒测序.重组质粒DNA序列检测:正向引物pGEX-F 22mer (浓度为100 μmol/L):CGACCATCCTCCAAAATCGGAT;反向引物pGEX-R 22mer (浓度为100 μmol/L):CAGATCGTCAGTCAGTCACGAT,反应体系14 μL 4 ℃保存,包括 Recombinant plasmid DNA 0.5 μg,6.4 mol/L Primer (4 μL浓度为1.6 μmol/L Primer),DDW适量.对cDNA序列同源性检索(Homology Search)、编码区和读码框进行分析,鉴定目的基因的插入方向及阅读框架是否正确,同时测序结果按照下列公式预测GST融合蛋白的分子量.
融合蛋白预测大小=目的蛋白+GST蛋白
目的蛋白=氨基酸数×110;
GST蛋白=25 000;
氨基酸数=碱基数/3;碱基数=插入蛋白长度
2 结果
2.1 IPTG诱导目的基因重组载体质粒GST蛋白的表达
利用DNA Ligation技术和In-Fusion技术,构建SEREX抗原基因即cDNA插入片段GST蛋白表达载体pGEX-4T-1,2,3.将重组克隆质粒转化表达菌株感受态细胞E.coliBL-21,在终浓度为0.1 mmol/L 的IPTG诱导下表达GST融合蛋白,直接取包含蛋白的菌体沉淀行SDS-PAGE,并通过考马斯亮蓝染色验证蛋白表达载体重组成功(图1).
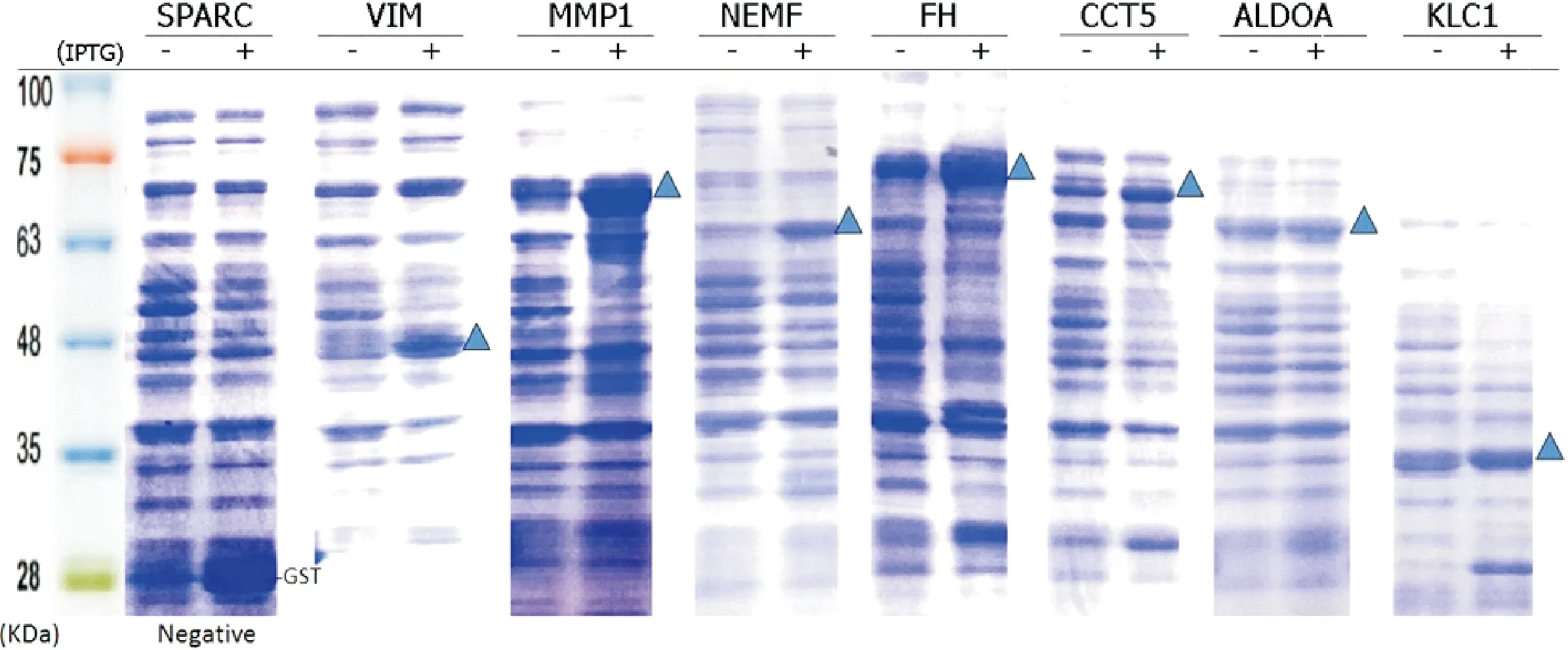
图1 部分重组蛋白的SDS-PAGE表达1 SOS-PAGE expression of some reoombinant proteins
结果显示,含pGEX-4T表达载体的大肠杆菌BL-21经IPTG处理3 h后,用SDS-PAGE分离细胞裂解物.SDS聚丙烯酰胺凝胶用考马斯亮蓝(CBB)染色.分子量显示在左边.带三角形表示IPTG诱导的GST融合蛋白,代表GST融合编码的cDNA产物.
2.2 GST融合蛋白成功表达的SEREX抗原基因
通过SDS-PAGE验证IPTG诱导重组GST融合蛋白的表达,共获得21条成功表达GST标签蛋白的SEREX抗原基因,其中pGEX-4T-1载体3条,pGEX-4T-2载体6条,pGEX-4T-3载体12条(表1).
2.3 SEREX抗原基因重组质粒DNA再测序鉴定
在E.coliBL-21中成功表达目的蛋白的SEREX抗原基因,测序结果显示目的基因与RefSeq Database中的相应序列完全相符,且阅读框架正确,重组GST融合蛋白分子量的预测大小与SDS-PAGE的结果基本一致(SDS-PAG上阳性诱导条带代表的蛋白相对分子质量与预测值相符),表明:能够表达重组GST融合蛋白的SEREX抗原基因,成功重建原核表达载体(表2).
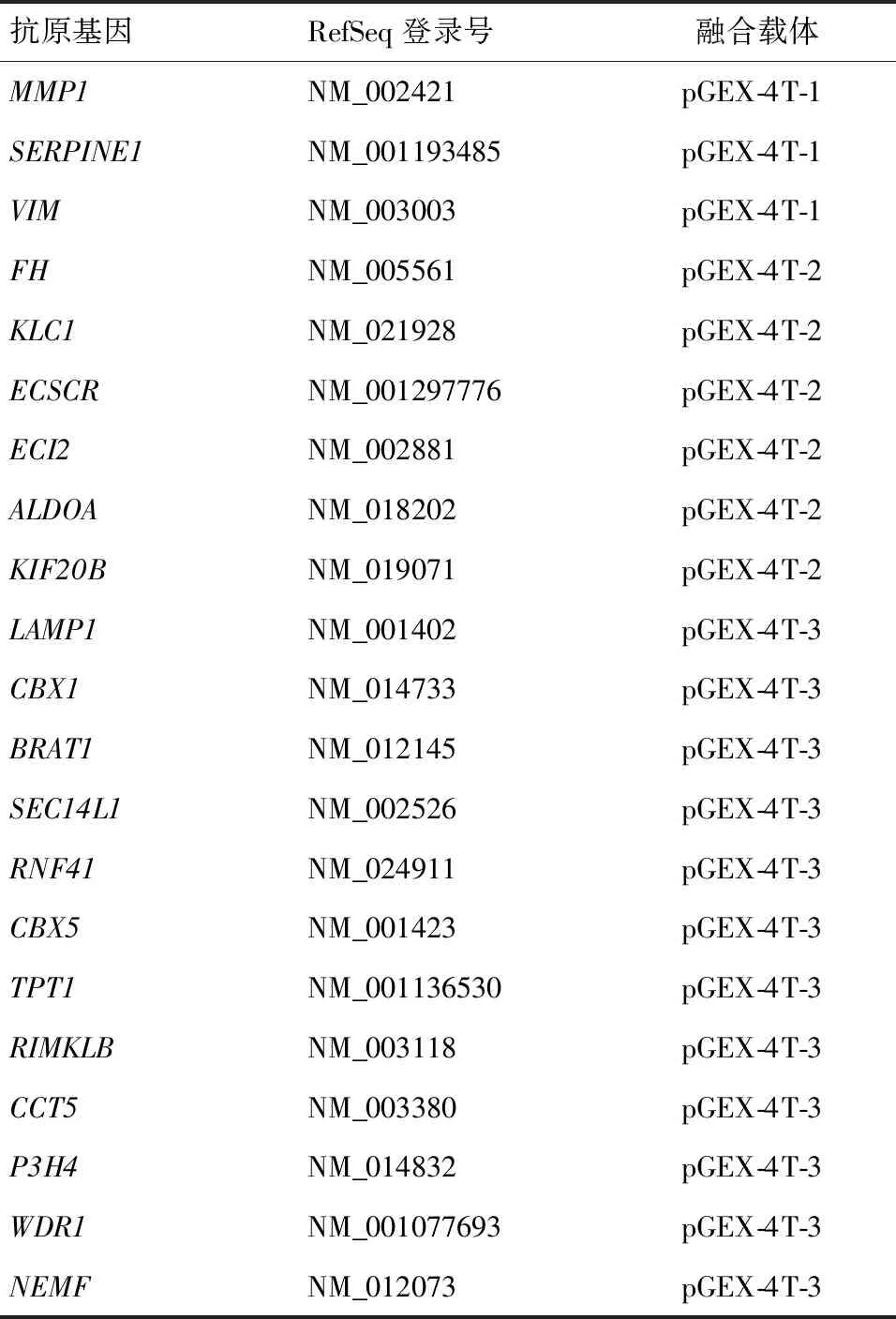
表1 成功表达GST标签蛋白的SEREX抗原基因Table 1 SEREX antigen genes successfully expressed by GST fusion protein

表2 待选重组pGEX-4T载体的抗原基因Table 2 Candidate pGEX-4T-fusion antigen gene
3 讨论
TIA是一种常见的神经血管性疾病,如果未进行及时有效的治疗,脑卒中48 h复发率为5%,3个月复发率为10%[14].TIA的早期发现和治疗可以有效降低中风的风险[15].此外,TIA患者的急性专业治疗可以显著降低高达80%中风和其他相关血管疾病的风险,如心肌梗死[16-17].然而,令人遗憾的是,目前还没有一种生物标记物能够有效可靠的诊断TIA[18].此外,TIA与动脉粥样硬化密切相关[19],动脉粥样硬化血管表面不稳定斑块破裂脱落,形成微栓子向远端流动,由于缺氧和缺血导致相应的血液供应区域的脑组织短暂性功能障碍[20].与此同时,动脉粥样硬化是动脉的炎症性疾病,血管平滑肌细胞与血管内皮细胞、硬化斑块中的免疫细胞和外膜中的常驻细胞共同免疫[21],TIA被认为是一种自身免疫性疾病,因此自体抗原的识别非常重要.
SEREX技术能够从分子水平分离及鉴定诱导IgG抗体产生的自身抗原,在既往的研究中,我们已经证明SEREX技术是筛选TIA相关性靶抗原的强有力手段.在既往研究的延续下,本研究筛选出70个重组cDNA克隆pBluescript质粒,构建克隆载体表达血清抗体标志物,作为TIA和CI早期免疫学诊断及精准医学个体化治疗的候选靶位.这显然与传统策略——直接以相关靶抗原作为生物标志物用于免疫学诊断不相同,主要基于对抗原、抗体标记物的血清学检测分析,抗体标记物更加敏感和精确[22-23].IgG球蛋白抗体的稳定性和免疫信号放大作用,使抗体的浓度远高于靶抗原,所以,自身抗体比相关抗原更容易检测,且能够对疾病更早的做出预判.有鉴于此,本研究的技术策略是通过TIA患者血清抗体筛选相关靶抗原,再反之以靶抗原鉴定自身抗体,旨在采用和借鉴免疫学、遗传学和分子生物学等学科的研究方法和技术手段,建立一种新的早期的TIA血清学筛查技术.在TIA患者的血清Serex筛查中,成功获得了21种重组pGEX-4T载体的靶抗原,对于后续抗原蛋白的诱导表达、纯化与血清学自身抗体检测至关重要.
本研究利用Ligation和In-Fusion基因重组技术,对70个SEREX抗原基因(目的基因插入片断)进行载体转换,重建GST蛋白表达载体质粒pGEX-4T.pGEX-4T质粒是一种高效蛋白表达载体,不仅设计有强启动子序列,而且该载体还搭载有谷胱甘肽-S-转移酶(GST)标签蛋白基因序列,GST作为一种表位标签,作为定位的标记或用于纯化或双杂交检测系统[24].其中,优先选择Ligation技术进行基因转换,是由于Ligation技术属于经典转基因策略,相关技术及应变方法均已比较成熟,而且不需要设计反应引物及应用聚合酶链反应技术扩增目的基因片断.pGEX-4T载体类型(pGEX-4T-1,2,3)的选择,则需要根据插入片段DNA测序结果的序列分析做出合理调配.但是,对于插入片段蛋白编码序列(CDS)含有限制性内切酶(EcoRⅠ/XhoⅠ、BamHⅠ/XhoⅠ和SmaⅠ/XhoⅠ)酶切位点的SEREX抗原基因.即使用上述3种组合酶切均无法获得完整CDS片段的目的基因则必须采用In-Fusion技术重组载体.与Ligation技术相比,In-Fusion系统的主要优势在于,方便且有效,不受酶切位点的限制.In-Fusion系统基于简单的同源重组原理,利用牛痘病毒DNA聚合酶与专利缓冲液的重组功能特性,只要载体和插入片段两端具有15 bp的同源碱基,In-Fusion技术就可以不受载体限制,将任意纯化PCR片段插入任意线性化载体中[25].In-Fusion系统的克隆反应仅需15 min,而且仅需一步即可构建复杂的结构[26-27].由于融合系统的高效性和一致性,可提高基因克隆的成功率.
基质金属蛋白酶(matrix metalloproteinases,MMPs)是降解细胞外基质(extracellular matrix,ECM)的一组含锌蛋白水解酶,MMPs的高表达会对基质产生广泛的降解作用,并早已证明MMPs在动脉粥样硬化的发生机制中起着重要的作用[28].其中,MMP1又被称为间质胶原酶,可降解人体内ECM的结构成分I型和III型胶原蛋白,因而与ECM代谢失衡及胞膜破裂机制有关[29],这两种蛋白也是血管内膜和粥样斑块纤维帽的主要结构蛋白,MMP1的能使纤维帽变薄,使稳定的粥样斑块转化为不稳定状态,是斑块脱落、游离的重要原因[30].在动脉粥样硬化的发生、发展中,同样存在ECM降解的病理过程,并和血管内皮炎性反应相关联[31].而Amin等[32]和Hao等[33]最近的研究中,也证实了MMP1与血管疾病和缺血性脑卒中相关.CBX1和CBX5是异染色质蛋白1(heterochromatin protein 1,HP1)家族中的成员,是高度保守的蛋白质:HP1非组蛋白染色体蛋白质参与建立和维护高阶染色质的结构,转录激活基因的表达,对衔接配合的着丝粒结合调控等[34-35].但是,最新研究表明:异染色质蛋白与动脉粥样硬化及高血压等疾病大血管损伤的发展进程关系密切,由于不同分化水平的血管平滑肌细胞获得修复功能的基因沉默,可能是与异染色质蛋白的封闭状态有关[36].因此,HP1家族可能在动脉粥样硬化的病理发展中起着调控作用.在本研究结果显示MMP1,CBX1和CBX5等蛋白表达的证据,与上述研究的结果是相一致的.
本研究的技术路线是SEREX抗原基因质粒经双酶切,分离回收插入片段后,通过Ligation和In-Fusion技术,将目的基因插入原核表达载体质粒pGEX-4T,转化表达菌E.coliBL-21感受态细胞,并在其中用IPTG诱导目的蛋白表达,最后用SDS-PAGE分析表达产物,再经酶切及DNA测序鉴定,成功重组pGEX-4T载体的插入片段可以作为候选靶抗原.本研究获得21个含SEREX抗原基因序列的重组pGEX-4T质粒,经SDS-PAGE对目的蛋白的表达检测,均能在E.coliBL-21中成功表达IPTG诱导GST融合蛋白,并且DNA测序显示目的基因与RefSeq Database中的相应序列完全相符,阅读框架正确,重组GST融合蛋白分子量的预测大小与SDS-PAGE的检测结果基本一致,表明上述21个SEREX抗原基因,成功重建原核表达载体—融合有GST标签蛋白的pGEX-4T载体,从而为后续抗原蛋白的提取、纯化与TIA抗体标记物的识别提供实验依据.
