海南省类鼻疽伯克霍尔德菌的分子流行病学特征分析
2020-04-13王立程吴多荣王旭明陈如寿刘志国
朱 雄,陈 海,李 沙,王立程,吴多荣,王旭明,陈如寿,郑 霄,刘志国,
类鼻疽病(Melioidosis)是由类鼻疽伯克霍尔德菌所致的人兽共患传染病[1]。类鼻疽伯克霍尔德菌是一种氧化酶和触酶阳性,不形成芽胞、无异染颗粒,有1-4根端鞭毛而运动的非发酵革兰阴性杆菌[2]。类鼻疽伯克霍尔德菌主要栖息于热带地区的土壤、水体和稻田中[3]。在东南亚和澳大利亚北部等地区广泛分布。破损的皮肤、消化道和呼吸道等途径均可感染。人和动物因接触污染的土壤或水而感染。类鼻疽无典型的临床表现,又称“类百病”。急性期常表现为肺部感染相关病症,慢性期则多为受累器官组织的化脓性表现。病情通常较重,若不及时诊治,病死率较高。目前,该病已成为热带和亚热带地区人群的主要公共卫生问题[4]。
我国自1991年首次在广东湛江报告4例病人以来,陆续在福建、广西、海南等地报道了相关病例[5-6]。同时,从广东、广西和海南等地的水样、患者血样中分离出类鼻疽病原菌[7]。当前,海南正值全力打造国际旅游岛和构建全球健康管理中心,商业往来和出入境旅游日益频繁。对海南地区传染病防控提出了新的要求,特别是类鼻疽的检测防控将面临极为严峻的形势。然而,全面的针对该地区类鼻疽的分子流行病学相关研究鲜有报道。MLVA_4实验方法是一种分辨力极好的类鼻疽分型方法,能较好的区分菌株间的分子流行病学相关性[8]。本研究采用该方法对海南地区近年分离的菌株进行分析,调查类鼻疽疫情的流行特征。不仅对海南类鼻疽的防控具有确切的流行病学意义,而且对我国南方地区的类鼻疽监测、诊疗和防控具有重要的指导意义。
1 材料与方法
1.1 材 料
1.1.1主要仪器 ClassⅡ A2型生物安全柜、BACTEC FX全自动血培养仪和BD Phoenix 100自动细菌鉴定仪(美国BD公司), GeneAmp梯度PCR仪(Applied Biosystems Inc,USA),DYY-6C-电泳仪(北京六一生物科技有限公司),Gel Doc XR自动凝胶成像系统(Bio-Rad,USA)。
1.1.2试剂 2×EasyTaq PCR Super mix、DNA Marker 2000 (TranS2K)由北京全式金生物技术有限公司提供。细菌DNA提取试剂盒购自德国凯杰[Qiagen]。MLVA_4引物名称、序列及扩增片段见文献[9]。引物由生工生物工程(上海)股份有限公司合成。
1.1.3病例资料及菌株来源 164名患者的性别、年龄、职业及症状、治疗结局等相关病案资料来自各医院的住院患者信息管理系统,该类信息被各医院科研中心批准使用并严格遵守了医院的相关规定,并用Excel 2016对相关病例资料进行整理和分析。164株类鼻疽伯克霍尔德菌全部来自患者的临床样本,其中2株来自尿液,10株来自临床分泌物,22株来自痰液,24株来自脓液,106株来自血液样本。病原的分离、鉴定作为患者的主要诊断依据。
1.2 方 法
1.2.1菌株的分离鉴定 在无菌条件下取患者的血液或体液(分泌物、脓液等)样本5~10 mL,在生物安全柜中接种于全自动细菌鉴定培养瓶中,做好标记进行培养。待出现阳性信号后,将1 mL可疑标本转种于血平板培养基进行纯化,并根据菌落形态等特征做出初步判定;并用革兰氏染色和全自动生化鉴定系统对可疑菌株进行鉴定。全部实验均在各医院检验科的生物安全二级实验室的生物安全柜中进行。此外,分离菌株的保存和使用严格遵守实验室的生物安全相关规定。
1.2.2菌株的DNA提取 菌株的DNA提取严格遵照凯杰[Qiagen]细菌DNA提取试剂盒的操作步骤进行,制备好的DNA -20 ℃保存、备用。
1.2.3MLV_4实验具体实验方案 参照文献[8]。采用20 μL扩增体系,上下游引物各0.4 μL(10 μmol /L),模板DNA 1.0 μL, MIX18.2 μL。扩增参数为:预变性 95 ℃ 5 min,变性94 ℃ 30 s, 退火68 ℃ 30 s,延伸72 ℃ 1 min,33个循环,终末延伸72 ℃, 5 min,5 μL扩增产物加入1.5%的琼脂糖凝胶孔中经110 V电泳40 min在凝胶成像下观察结果。将预期扩增送生物公司测序。
1.2.4MLV_4数据分析 根据 GeneScan5.0 LIZDNA Marker (美国 ABI公司)确定扩增产物长度,并将产物长度转换为各VNTR位点的重复数,从而获得每个菌株的MLVA_4特征值。同时,将菌株的背景资料(分离地点、时间和宿主)一同录入Excel,保存为制表符分隔用于聚类分析。将菌株的MLVA特征值导入Bionumerics7.6软件,采用非加权类平均法(UPGMA)进行聚类,构建实验菌株的亲缘关系树图和最小生成树(Minimum Spanning Tree)。
1.2.5类鼻疽病例的临床特征分析 用Excel 2016将2006-2012年收集的164例类鼻疽患者的性别、职业、临床诊断及治疗结果进行统计,并采用描述性统计的方法对上述病例的临床特征进行分析。
2 结 果
2.1菌株的分离鉴定 菌落在血平板生长良好,24 h~48 h可形成圆形中央微隆起的灰白色菌落,菌落呈粗糙轮盘状,有较强的金属质感和土霉味。革兰染色阴性,呈两端偏浓染的杆菌。见图1。
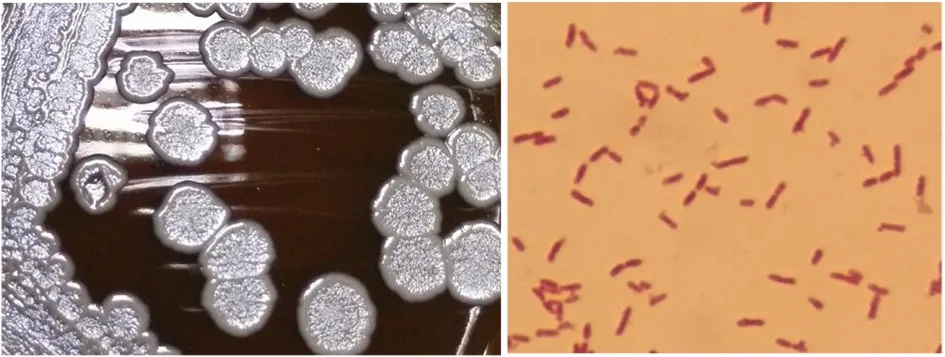
图1 类鼻疽伯克霍尔德菌的形态特征(左图)和革兰氏染色特征(右图)Fig.1 Morphological feature (left) and Gram stain (right) characteristics of B. pseudomallei isolates
2.2菌株的地区分布 164株类鼻疽伯克霍尔德菌分布于海南省的17个县(市/区),其中三亚市菌株最多(39株),其次为东方市(19)、儋州(15)、乐东(14)、万宁市(14)、文昌(10)。其他地区菌株较少,而屯昌县、临高县、琼中黎苗族自治县和五指山市无菌株。菌株主要分布在海南省西南部沿海市(县/区),东北部市(县/区)菌株分布较少。中部3个地区无菌株分布。见图2。

图2 海南省类鼻疽伯克霍尔德菌的地区分布Fig.2 Areas distribution of B. pseudomallei strains in Hainan Province
2.3遗传多态性分析 MLVA_4方法对菌株的分辨力指数为0.989 5。4个位点的多态性指数由高到低依次为0.901 1(VNTR3),0.842 1(VNTR1),0.819 8(VNTR2)和0.815 9(VNTR4)。4个多态性位点的等位基因型别依次为11,9,15和14。4个位点的HGDI指数均高于0.8,其中VNTR3有15个不同的等位基因型别。见表1。

表1 MVLA_4方法中4个位点的多态性指数及等位基因型特征Tab.1 Diversity index and allele characteristics of 4 loci in MVLA_4 approach
2.4菌株的聚类分析 164株类鼻疽聚为97个基因型(GT1~97),其中33个为共享基因型(图3),另外64个为单一基因型,每株菌代表一个基因型。33个共享基因型包括100株类鼻疽菌,菌株聚类率为61.0%(100/164),每个共享基因型分别由2-8株组成,其中13个共享基因型(GT2、3、4、5、6、28、30、43、53、58、67、82、93(阴影覆盖基因型))由来自相同地区分离的菌株构成;28个共享基因型(除GT3、5、30、43和53外其他所有共享基因型)分别由2~5个不同地区的菌株构成。此外,32个共享基因型(GT65除外)的菌株分别由相同ST型的菌株构成。见图3。
2.5菌株的最小生成树(MST)分析 164株类鼻疽伯克霍尔德菌可分为2个地理集群(Ⅰ和Ⅱ)。2012年在安定县分离的2株类鼻疽伯克霍尔德菌分别位于2个类群的基部节点,并与来自文昌、乐东、澄迈和万宁地区的菌株密切相关。内蒙古患者分离的菌株与三亚、海口、东方、万宁及乐东地区的菌株具有完全相同的MLVA_4基因型。福建患者分离的2株菌分别位于2个不同的集群,其中HNBP059与昌江地区的菌株有完全相同的MLVA_4基因型,HNBP004与东方和万宁的有完全相同的MLVA_4基因型。俄罗斯患者分离的菌株与定安县的菌株仅有单位点差异。湖南省患者分离的菌株与三亚和陵水地区的菌株存在位点差异。见图4。
2.6病例的年龄分布特征 在164名患者中,男性138例,占比84%,女性26例。男女比例为5.3∶1。164名患者的平均年龄为48.5岁。50岁年龄组分布最多,构成比为70%(42/60),其次为40岁(34),30岁(28)和60岁(25)年龄组,其余年龄组患者较少,见图5。
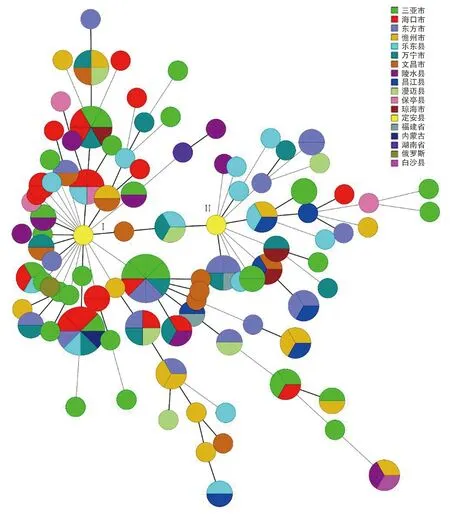
图4 164株类鼻疽伯克霍尔德菌的最小生成树Fig.4 MST of 164 B. pseudomallei strains in Hainan province
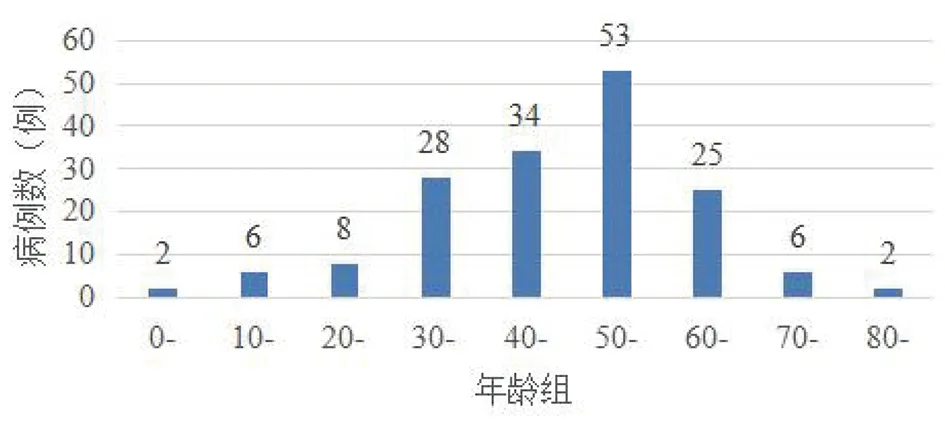
图5 164例类鼻疽患者的年龄分布Fig.5 Ages distribution in 164 cases of Melioidosis

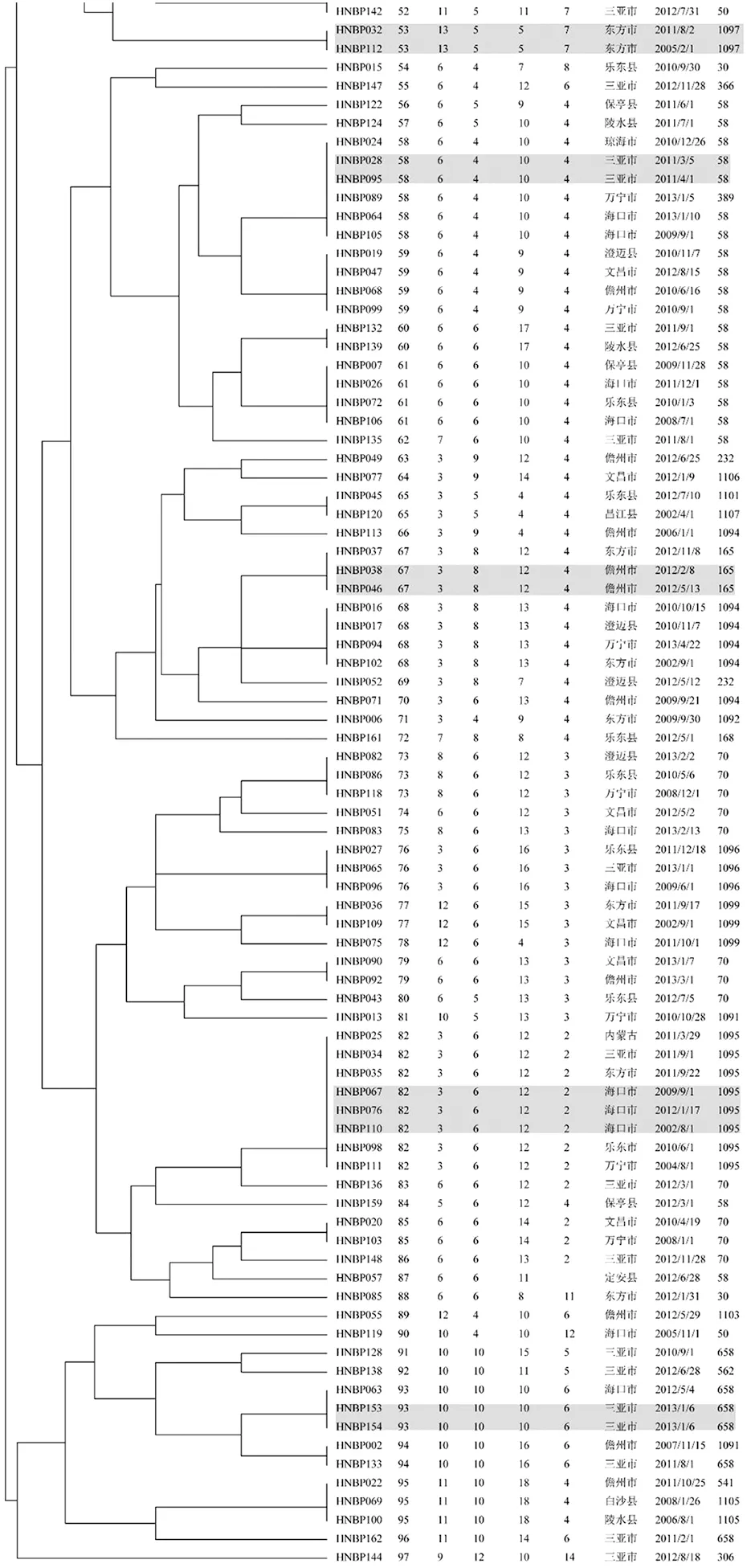
图3 164株类鼻疽伯克霍尔德菌的亲缘关系树图
Fig.3 Phylogenetic tree of 164B.pseudomalleistrains in Hainan province
2.7患者的职业分布 患者来自12种不同的职业,其中农民患者最多,占比81.7%(134/164);工人7名,占比4.3%(7/164)。另有保安、记者和公务员等。见表2。
2.8患者的临床感染特征分析 164个病例涉及16个不同的临床感染特征谱,其中肺部受侵病例最多(64),占比39%(64/164),其次为败血症(48),占比29.3%。另有脓毒血症、肾脏疾患、发热待查等10余种不同的病变特征。见图6。
2.9患者的治疗结果 在164例类鼻疽患者中有57例治愈,占比34.8%。65例好转,占比39.6%,15例未愈,占比9.1%。死亡18例,死亡率11%。未好转7例,未知2例。见表3。
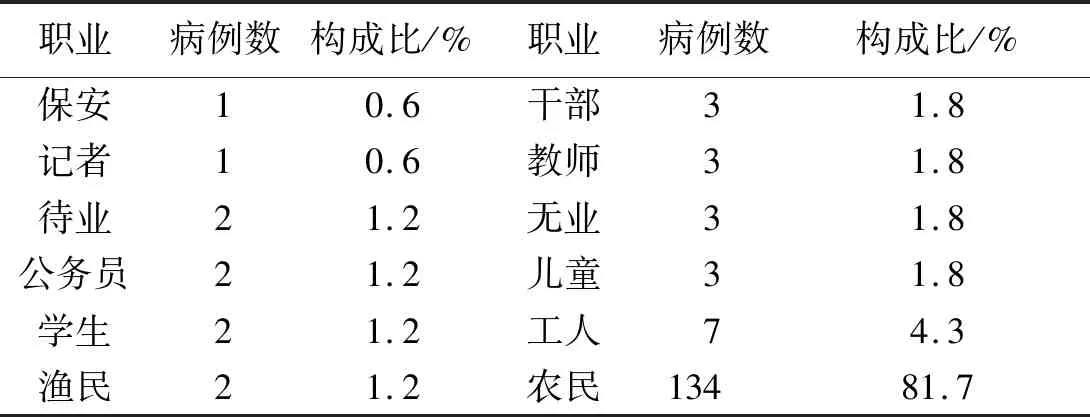
表2 164例类鼻疽患者的职业分布Tab.2 Occupational distribution of 164 Melioidosis patients

图6 164例类鼻疽患者的临床感染特征Fig.6 Clinical infection characteristic in 164 patients of Melioidosis
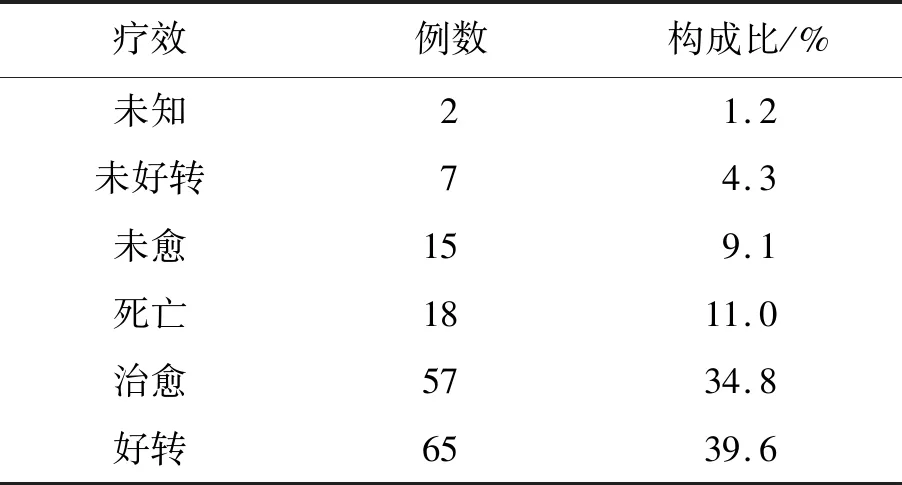
表3 164例类鼻疽患者的治疗结果Tab.3 Therapy outcome in 164 patients of Melioidosis
3 讨 论
对海南地区类鼻疽伯克霍尔德菌的分子流行病学关联及患者的临床特征进行调查分析,不仅对深入了解该地区类鼻疽的流行规律及指导临床诊疗具有一定意义,而且对指导我国南方地区开展类鼻疽防控检测具有流行病学意义[6]。类鼻疽无经典的临床表现,病原分离是类鼻疽确诊的金标准[10]。类鼻疽形态特征较为特殊,在血平板培养48 h可形成中央微隆起的灰白色粗糙样轮盘状菌落,并有较强的金属质感和土霉味,可作为临床实验室鉴别该菌的特征。本研究共计从海南省的17个县(市、区)患者分离获得164株类鼻疽伯克霍尔德菌,菌株分布范围较广。菌株主要分布于海南省西南部的沿海地区,而北部地区分布较少,特别是中部3个县(市、区)无菌株分布。菌株的分布特征不仅与类鼻疽的传染特点相符,类鼻疽通常多见于污水、土壤和稻田中,常因务农等接触而引发感染[11],而且与该地区稻田土壤中类鼻疽的分布情况一致。因本研究分离的菌株全部来自就诊患者的临床样本,并非对患者的主动监测所获。另外,类鼻疽患者的临床表现多样化、而且类鼻疽分离与采样时期、是否使用抗生素等因素密切相关。因此,感染患者样本中类鼻疽的确切分离率尚需研究证实。但先前的研究显示该地区土壤类鼻疽的分离率为10.2%(110/1 080),菌株分布于海南所有市县(区),但菌株的分布数量极不平衡。分离类鼻疽最多的地区为西南部沿海市县,南部地区土壤中的类鼻疽分离率最高,明显高于其他地区 (P<0.01)[12]。此外,广西的土壤和稻田样本类鼻疽分离率分别为8.4%和9.1%,在一定程度上对估算患者临床样本中类鼻疽的分离率提供了参考。海南岛南北地区分别为季风热带和亚热带气候,岛屿的东部和南部多为台风的着陆点,而且降雨量和风速较高。临床和气候相关研究表明台风或强降雨与类鼻疽之间有潜在的相关性[13]。此外,土壤类型、地理位置、土壤养分和盐含量与类鼻疽存在与否有明显的相关性[14]。因此,沿海地区多种气候因素构成的特异微环境可能更加适宜类鼻疽的存活和传播。因此,建议在海南省的南部沿海市县开展相应的病原监测以及对高危人群进行宣传教育,从而提升受威胁人群的防病意识,有效阻断该病的传播。
基于HGDI指数,MLVA_4对菌株的分辨力为0.989 5,4个分型位点分别有9个以上的等位基因型别,表明试验菌株有较高的遗传多态性。在4个位点中VNTR3位点有15个不同的等位基因型,是MLVA_4方法中分辨力最高的位点,提示样本来源地区的类鼻疽伯克霍尔德菌的该串联重复序列位点变异度最高,可能反映了样本来源地区类鼻疽伯克霍尔德菌的微进化特征[15-16]。为了阐述菌株间的分子关联,我们采用国际公认的MLVA_4分型方法对现场分离的164株类鼻疽伯克霍尔德菌的相关性进行了调查。研究表明该方法不仅对类鼻疽具有较高的分辨力,而且能够区分无流行病学相关但MLST和PFGE相同克隆群的菌株,当分离株来自确定的点源暴发流行,则菌株聚为相同或极为相似的类群[8]。本研究中164株类鼻疽聚为97个MLVA_4基因型(GT1~97),其中33个为共享基因型,表明该类基因型的菌株间可能有潜在的流行病学关联。另外64个为单一基因型且每株菌代表一个独特的基因型,表明该地区类鼻疽具有零星或散发的流行特征。13个共享基因型由来自相同地区分离的菌株构成,证实了该地区类鼻疽呈现由多个共同传染源引发的多点暴发流行的特征。另外,有28个共享基因型分别由2~5个不同地区分离的菌株构成,揭示了该地区类鼻疽存在由多个共同传染源引发的多地交叉感染的流行特征。33个共享基因型包括100株类鼻疽菌,菌株聚类率为61.0%(100/164),每个共享基因型分别由2-8株组成,而且32个共享基因型的菌株分别由相同ST型的菌株构成,表明该地区61%的类鼻疽病例系由相同克隆群菌株感染引起的多点暴发流行。此外,菌株的聚类率为61.0%,所有共享基因型的菌株多来自2~5个不同地区,提示该地区类鼻疽的流行并非仅限于某一市(县、区),而是在海南省多个地区传播流行。应定期开展相应的监测和干预措施,并纳入国家疾病检测系统,从而加强该病的防控效能。
基于MLVA_4数据的最小生成树(MST)分析结果表明164株类鼻疽伯克霍尔德菌可分为2个地理集群,安定县分离的2株类鼻疽伯克霍尔德菌分别位于2个类群的起源处。由此,我们推测该地区的类鼻疽伯克霍尔德菌可能起源于定安县或由定安县的菌株克隆群扩散传播引起。此外,定安县分离的2株菌呈现不同的MLVA_4基因型,并与文昌、乐东、澄迈和万宁等毗邻地区的菌株有较高的遗传相似性。由此,我们推测来自海南东北部市(县、区)的菌株是该地区类鼻疽伯克霍尔德菌的潜在祖先,该克隆群菌株由多种因素促成其由北向南扩散,从而导致南部多个沿海市区的流行。东南部沿海地区台风频发、气候独特,人流商运云集可能是沿海地区类鼻疽高发、频发的原因。建议将该地区的菌株进行全基因组测序,并与全球范围的菌株进行比较基因组分析从而更好的理解海南地区类鼻疽的起源进化特征,揭示该地区菌株的历史起源。内蒙古患者分离的菌株与三亚、海口、东方、万宁及乐东地区的菌株具有完全相同的MLVA_4基因型,该患者为内蒙古某报社的记者并在三亚地区进行采访报道活动时感染类鼻疽,提示传染源可能来自三亚。福建省患者分离的2株菌分别位于2个不同的集群,2个病例的传染源可能来自上述有相同基因型的地区。福建同属类鼻疽疫区,应关注类似的病例从而更好的了解该病的流行病学特征。湖南和俄罗斯患者分离的菌株与该地区的菌株存在单位点差异,应开展全基因组测序从而证实感染来源和揭示流行病学关联。
在164名患者中,男性138例,占比84%。男女比例为5.3∶1。患者的平均年龄为48.5岁。患者涉及12种不同的职业,其中农民患者最多,占比81.7%(134/164)。人群主要通过接触含有致病菌的污水和土壤,经破损的皮肤或消化道等感染。50~60岁的男性是该地区农村的主要劳动力,与水及土壤接触频繁。研究表明免疫力低下的患者易感性高于普通人群[17]。本研究中45.7%(75/164)的患者有糖尿病,表明免疫力低下是感染类鼻疽的潜在风险。在香港地区早期报道的病例中,所有患者均表现为免疫力低下,包括有糖尿病和自身免疫病史[18]。此外,伴有恶性肿瘤及长期中性粒细胞减少的患者有较高的感染风险[19]。建议患有糖尿病或免疫力低下的患者在疫区从事相关工作,应做好相应的防护措施。
164个病例涉及16个不同的临床感染特征谱,其中肺部受侵病例最多(64),占比39%(64/164),其次为败血症(48),占比29.3%,提示类鼻疽主要侵犯肺部和血液系统,导致呼吸道病症(咳嗽、胸痛、呼吸急促等)和败血症等。临床表现与国内外其他报道吻合,大多数患者表现为菌血症、肺部感染[20]。另有脓毒血症、肾脏疾患、发热待查、脓肿等10余种不同的病变特征。类鼻疽临床表现各异,提示在疫区遇有该类症状的患者应首先排除类鼻疽感染。因类鼻疽可致多个组织器官的病症,是一种极容易误诊的疾病[21]。及时准确的诊断需结合多方面的结果综合判定,避免误诊误治。应在疫区针对高危人群和医师开展相应的宣传教育,特别是提升临床医师的鉴别该病的能力和意识,更好地提升类鼻疽的防控诊疗水平。在164例类鼻疽患者中有65例好转,占比39.6%,57例治愈,占比34.8%,表明该病的治愈率相对较低。死亡18例,死亡率11%,明显低于先前的报道(20%~40%),可能与该地区的类鼻疽的诊疗水平相关。研究表明绝大多数的死亡与抗生素治疗不足有关,未治愈病例可能与误治及延迟治疗相关[22]。在临床治疗时应进行体外药物敏感性试验,选择合适的药物进行足量、足疗程的早期治疗。类鼻疽不仅有低治愈率和高致死率的特征,而且临床表现多变,治疗疗程较长。做好该病的检测防控存在较大的压力。因此,本研究在了解流行病学特征的基础上,明确了菌株的地理分布,阐明了该病的临床特征和诊断要点,不仅对提升和促进该病的临床诊疗具有积极作用,对南方地区的类鼻疽防控具有重要指导意义。
利益冲突:无
引用本文格式:朱雄,陈海,李沙,等.海南省类鼻疽伯克霍尔德菌的分子流行病学特征分析[J].中国人兽共患病学报,2020,36(2):110-117. DOI:10.3969/j.issn.1002-2694.2020.00.019
