不同时期干旱胁迫对甘薯生长和抗氧化能力的影响
2020-04-13张海燕解备涛汪宝卿董顺旭段文学张立明
张海燕,解备涛,汪宝卿,董顺旭,段文学,张立明
不同时期干旱胁迫对甘薯生长和抗氧化能力的影响
张海燕1,解备涛1,汪宝卿1,董顺旭1,段文学1,张立明2
(1山东省农业科学院作物研究所/农业农村部黄淮海薯类科学观测实验站/特色作物山东省工程实验室,济南 250100;2山东省农业科学院,济南 250100)
【目的】研究不同时期干旱胁迫导致甘薯减产的机理,为旱作地区甘薯生产提供理论依据和技术支撑。【方法】在人工控水条件下,以抗旱品种济薯21和不抗旱品种济紫薯1号为试验材料,每个品种设4个水分处理,分别为WW(全生育期正常灌水,对照)、DS1(发根分枝期干旱胁迫)、DS2(蔓薯并长期干旱胁迫)和DS3(快速膨大期干旱胁迫),研究不同时期干旱胁迫对甘薯生长和抗氧化能力的影响。【结果】干旱胁迫导致甘薯薯干产量显著下降,早期干旱胁迫薯干产量下降幅度最大,济薯21(抗旱品种)的DS1、DS2和DS3处理产量分别比对照减产32.24%、30.68%和13.76%,济紫薯1号(不抗旱品种)分别比对照减产44.02%、39.54%和17.87%。功能叶、纤维根和块根抗氧化酶活性均在干旱胁迫后升高,且干旱胁迫时间越早,抗氧化酶活性升高的幅度越大;各生育时期纤维根的酶活性均高于块根和功能叶,说明甘薯纤维根对干旱胁迫的敏感性最强。干旱胁迫可导致甘薯功能叶相对电导率升高,功能叶、纤维根和块根的MDA含量升高,且胁迫时间越早,升高的幅度越大。【结论】干旱胁迫时间越早,功能叶、纤维根和块根的抗氧化酶系统受破坏程度越大,从而抑制了甘薯叶片和根系的正常生长,限制了块根的形成和膨大,发根分枝期是甘薯块根产量对水分最敏感的时期。
甘薯;干旱胁迫;产量;抗氧化能力
0 引言
【研究意义】甘薯作为耐瘠薄作物,多数种植在丘陵旱薄地,干旱限制了块根的形成和膨大,导致产量难以提高。近年来,我国北方薯区干旱经常发生,尤其是在4月中下旬至7月上旬,正值甘薯田间栽插和根系发育的关键时期,干旱成为甘薯发根缓苗和块根形成的主要限制因素。通过研究干旱胁迫导致甘薯减产的生理机制,提出关键时期补充水分的技术措施,可为干旱年份甘薯生产提供理论依据和技术支撑。【前人研究进展】前人研究认为,干旱胁迫导致甘薯减产的原因在于限制了茎叶和根系的生长,不同时期表现的敏感程度不同[1-2],苗期敏感程度较高,干旱胁迫导致地上部失水萎蔫,不定根的形成、生长和分化受抑制,薯苗移栽成活率下降[3],中后期干旱胁迫,土壤机械阻力的增大限制了甘薯根系生长和块根膨大[4],因此不同时期干旱胁迫均导致甘薯产量下降[2]。干旱胁迫导致减产的机理较复杂,涉及到诸多生理、生化变化,在植物对逆境胁迫的响应机制研究中,抗氧化酶活性及膜脂过氧化作用被广泛应用,各种非生物胁迫对植物造成的损伤均与氧化损伤有关[5]。干旱胁迫作为非生物胁迫造成减产主要是氧化损伤引起的[6-8],增强抗氧化能力可以改善植物对胁迫的耐受性[9-10]。逆境胁迫诱导植物产生过多的氧自由基,而抗氧化酶则起着清除自由基的作用,维持着氧化还原的平衡,提高了植物忍耐或抵抗逆境胁迫的能力[11]。前人研究认为,干旱胁迫导致甘薯叶片过氧化氢(H2O2)、超氧阴离子自由基()等活性氧积累,脂氧合酶(LOX)活性增加,超氧化物歧化酶(SOD)、过氧化氢酶(CAT)和抗坏血酸过氧化物酶(ASP)活性下降,还原性抗坏血酸(ASA)含量上升,还原性谷胱甘肽(GSH)含量先降后升,丙二醛(MDA)含量增加,膜透性增大[12-13]。轻度水分胁迫,对甘薯叶片抗氧化酶活性有诱导作用,重度水分胁迫,抗氧化酶系统损伤,品种间差异较大,抗旱性强的高于抗旱性弱的[14-15]。干旱胁迫条件下,活性氧的累积导致叶绿体膜结构受损、质膜损伤、膜透性增加[16-17],随着胁迫的加剧,MDA含量呈逐渐升高的趋势,MDA含量的上升与膜透性增大呈显著的正相关,抗旱性强的品种抗膜脂过氧化能力较强,MDA含量也较低,细胞膜受伤害程度也较轻,其含量高低可反映植物受伤害的程度[18]。【本研究切入点】在植物对逆境胁迫的机理研究方面,抗氧化能力已被广泛用于评价植物的抗旱性,在甘薯抗旱性研究中,多集中在苗期叶片抗氧化能力对干旱胁迫的响应,针对不同生育时期干旱胁迫,研究甘薯功能叶、纤维根和块根抗氧化能力对干旱胁迫响应机制的报道尚未见报道。【拟解决的关键问题】本研究在人工控水条件下,以抗旱品种济薯21和不抗旱品种济紫薯1号为试验材料,通过研究不同时期干旱胁迫对甘薯生长和抗氧化能力的影响,探讨干旱胁迫条件下甘薯减产的机理,为干旱年份甘薯生产提供理论依据。
1 材料与方法
1.1 试验设计
以抗旱品种济薯21和不抗旱品种济紫薯1号为试验材料,每个品种设4个水分处理,分别为WW(全生育期正常灌水,对照);DS1(发根分枝期干旱胁迫);DS2(蔓薯并长期干旱胁迫);DS3(快速膨大期干旱胁迫)(表1),随机区组设计,每处理重复3次。采用测墒补灌的方法给抗旱池补充水分,每隔5—7 d灌水一次,灌水前用HH2土壤水分测定仪(Delta-T Devices LTD,Cambridge,UK)测定0—60 cm土层土壤绝对含水量,根据各处理池子设计含水量,用水表计量补充灌水。灌水量m=10ρbH(βi-βj),m为灌水量(mm),H为该时段土壤计划湿润层的深度(cm),ρb为计划湿润层土壤容重(g·cm-3),βi为设计含水量(田间持水量乘以设计相对含水量),βj为灌溉前土壤绝对含水量[19]。干旱胁迫处理的抗旱池在胁迫前7 d停止灌水。
试验在山东省农业科学院作物研究所抗旱棚内进行,每个池子四周由水泥砌成,底部开放,长×宽=6 m×4 m,深为2 m。2013—2015年栽插时间分别为6月10日、6月12日和6月11日,收获时间分别为10月9日、10月11日和10月10日,生育期均为122 d。
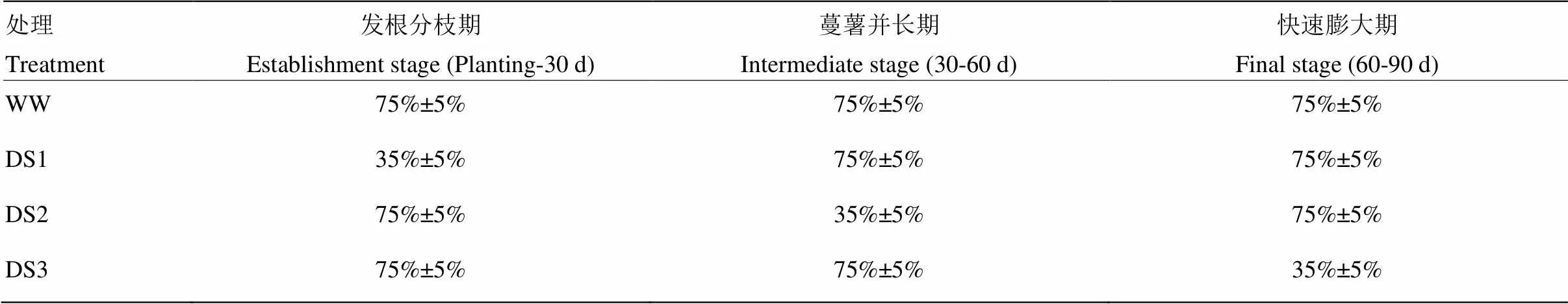
表1 不同处理的土壤相对含水量
WW:对照,全生育期正常灌水;DS1:发根分枝期干旱胁迫;DS2:蔓薯并长期干旱胁迫;DS3:快速膨大期干旱胁迫。下同
WW: control, well watered at whole stage; DS1: drought stress during the establishment stage; DS2: drought stress during the intermediate stage (storage root initiation); DS3: drought stress during the final stage (storage root bulking). The same as below
1.2 测定项目及方法
1.2.1 生物量、叶面积系数和薯干产量测算方法 栽后40 d开始,每隔20 d调查取样1次,每处理选取代表性植株5株,称量其地上部和地下部鲜重,烘干后称取干重,获得地上部和地下部生物量(g/plant)。
叶面积系数测算参考王留梅等的方法[20],测量出所有叶片的长(沿叶脉测量)和宽(最宽处测量),所有叶片长乘以宽之和得出单株虚叶面积,叶面积系数=单株虚叶面积×0.6×密度(株数/hm2)/10 000。
收获期进行小区测产,获得小区薯块鲜产,折算成单位面积薯块鲜产(kg·hm-2)。每处理选取代表性薯块5块,称取鲜重,待烘干后再称取干重,计算获得干物率。根据薯块鲜产和干物率计算获得薯干产量(kg·hm-2)。
1.2.2 取样方法 栽后40 d开始,每20 d取样1次。田间选取代表性植株5株,取主茎倒4叶,用于叶绿素、叶片相对电导率测定,锡箔纸包装,编号后放置液氮中。将整个根系小心挖出,用蒸馏水迅速将根系冲洗干净,用吸水纸吸干表面水分,取纤维根根尖处5 cm用于根系活力的测定,将纤维根和块根分类取样,锡箔纸包好,编号后放置液氮中。将液氮速冻样品放入-80℃超低温冰箱中保存,用于酶活力测定。
1.2.3 功能叶叶绿素含量、相对电导率和根系活力测定方法 参考李合生[21]的方法测定叶绿素含量,称取待测样品0.5 g左右,研磨后转入具塞刻度试管中,加95%乙醇15 ml,闭光保存48 h。以95%乙醇为空白,在波长665 nm、649 nm下测定光密度。Ca=13.95D665-6.88D649;Cb=24.96D649-7.32D665。式中,D649和D665为待测样品在波长665 nm和649 nm的吸光度,Ca、Cb分别为叶绿素a和b的浓度。色素含量(mg·g-1FW)=色素的浓度C(mg·L-1)×提取液体积(L)/样品鲜重(g)。
采用浸泡法测定相对电导率,将叶片剪成长条,置于10 ml去离子水的刻度试管中,室温下浸泡处理12 h,测定浸提液电导率(R1),沸水浴加热30 min后,再次测定浸提液电导率(R2),相对电导率=R1/R2×100%。
采用氯化三苯基四氮唑(TTC)法测定根系活力[22]。
1.2.4 功能叶、纤维根和块根抗氧化酶活性测定方法 称取0.5 g左右的样品放入研钵中,加5 mL磷酸缓冲液(pH 7.8),冰浴研磨,匀浆倒入离心管中,冷冻离心20 min(10 000 r/min),测定上清液体积,4°C保存备用。抗氧化酶活性测定参考陈建勋等[23]的方法,略有改进。超氧化物歧化酶(SOD)活性采用氮蓝四唑(NBT)光化还原法测定;过氧化物酶(POD)活性采用愈创木酚法测定;过氧化氢酶(CAT)活性采用紫外吸收法;抗坏血酸过氧化物酶(APX)活性和谷胱甘肽还原酶(GR)活性采用比色法测定。
1.3 数据处理与分析
数据处理分析及作图采用Microsoft Excel 2010进行,方差分析和差异显著性检验采用DPS v8.01版数据处理软件。本试验采用3年数据,方差分析结果表明,各指标及其与年份间的互作不显著(<0.05),试验结果趋势基本一致,因此,均采用3年的平均值进行分析。
2 结果
2.1 不同时期干旱胁迫对甘薯生长的影响
2.1.1 薯干产量 从表2可以看出,不同时期干旱胁迫均导致甘薯薯干产量下降,3个时期干旱胁迫比较,发根分枝期干旱胁迫薯干产量下降幅度最大。抗旱品种减产幅度小于不抗旱品种。抗旱品种济薯21的DS1、DS2和DS3处理薯干产量分别比对照减产32.24%、30.68%和13.76%,不抗旱品种济紫薯1号分别比对照减产44.02%、39.54%和17.87%。
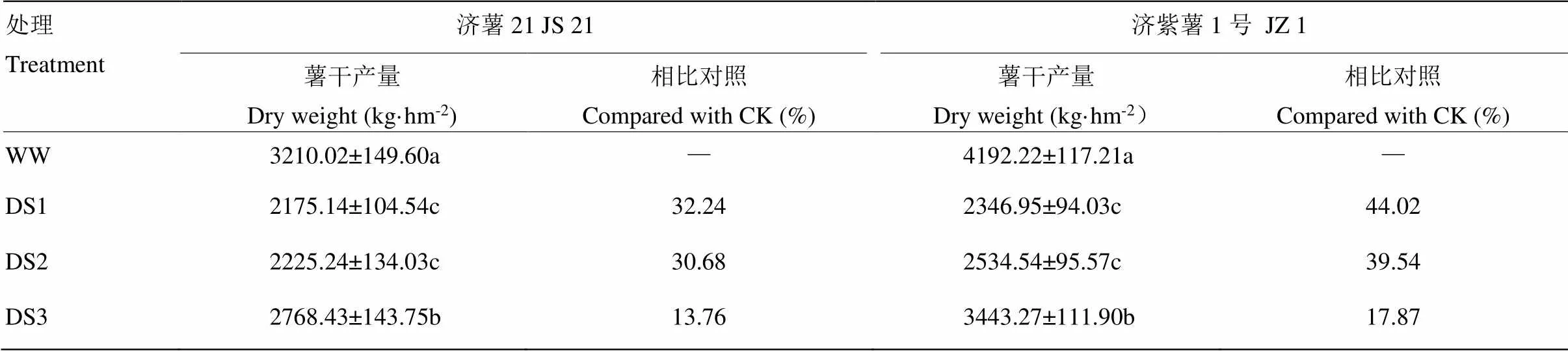
表2 不同时期干旱胁迫对甘薯块根产量的影响
数据为3次重复的平均值±标准差。同列数据不同字母表示差异显著(<0.05)。下同
Data are shown in mean ± standard deviation of three replicates. Different letter in the same column meant significantly different (<0.05). The same as below
2.1.2 地上部和地下部生物量 表3可见,不同时期干旱胁迫均导致甘薯地上部生物量下降,3个时期干旱胁迫比较,发根分枝期干旱胁迫的甘薯地上部生物量下降幅度最大,其次是蔓薯并长期和块根快速膨大期。2个品种比较,抗旱品种济薯21下降幅度小于不抗旱品种济紫薯1号,栽后100 d,DS1、DS2、DS3处理的地上部生物量与对照相比,济薯21分别降低29.17%、15.96%、8.61%,济紫薯1号分别降低37.43%、19.10%、9.22%。
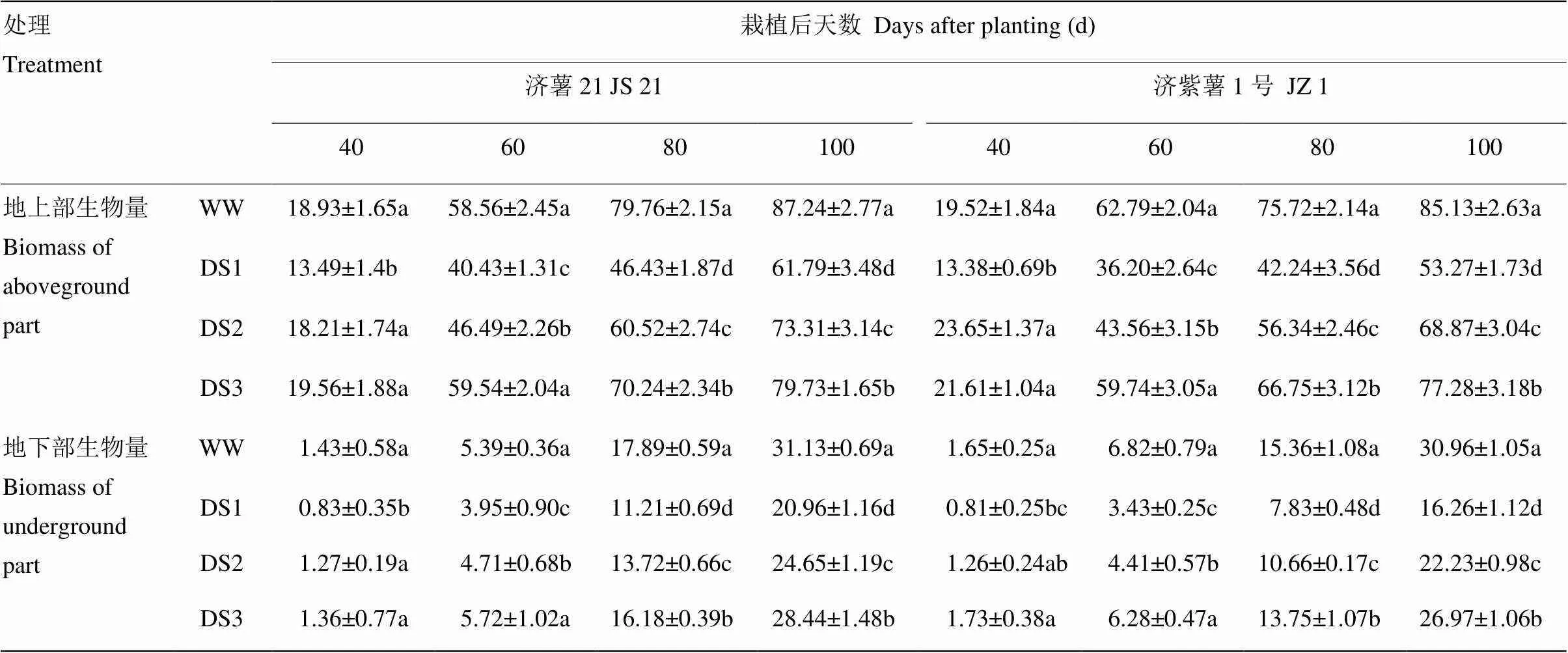
表3 不同时期干旱胁迫对甘薯地上部和地下部生物量的影响
干旱胁迫处理的地下部生物量均显著低于对照,与对照相比的降低幅度均表现为DS1>DS2>DS3。栽后100 d,DS1处理,济薯21和济紫薯1号分别降低32.67%和47.49%,DS2处理分别降低20.82%和28.22%,DS3处理分别降低8.62%和12.91%(表3)。说明干旱胁迫抑制了甘薯根系的生长以及块根的形成和膨大,以发根分枝期胁迫对甘薯地下部生物量影响最大。抗旱品种地下部生物量下降幅度小于不抗旱品种。
2.1.3 叶面积系数 从表4可以看出,各处理在干旱胁迫后叶面积系数均显著低于对照,3个时期干旱胁迫比较,发根分枝期干旱胁迫的叶面积系数下降幅度最大,其次是蔓薯并长期和块根快速膨大期。2个品种比较,抗旱品种济薯21下降幅度小于不抗旱品种济紫薯1号,栽后80 d,各处理的叶面积系数均达到峰值,DS1、DS2、DS3处理的叶面积系数与对照相比,济薯21分别降低50.62%、31.08%、11.72%,济紫薯1号分别降低56.92%、40.59%、20.37%。
2.1.4 功能叶叶绿素含量 从图1可以看出,甘薯功能叶叶绿素含量呈单峰曲线,栽后80 d达到峰值,随后开始下降。2个品种干旱胁迫处理的叶绿素含量各生育时期均显著低于对照,且以DS1处理的降幅最大,其次是DS2和DS3处理。栽后100 d,DS1、DS2、DS3处理的功能叶叶绿素含量与对照相比,济薯21分别降低23.36%、17.33%、6.36%,济紫薯1号分别降低35.71%、20.84%、16.89%。说明干旱胁迫可导致甘薯功能叶叶绿素含量下降,且胁迫时间越早,下降幅度越大,抗旱品种济薯21下降幅度小于不抗旱品种济紫薯1号。

表4 不同时期干旱胁迫对甘薯叶面积系数的影响
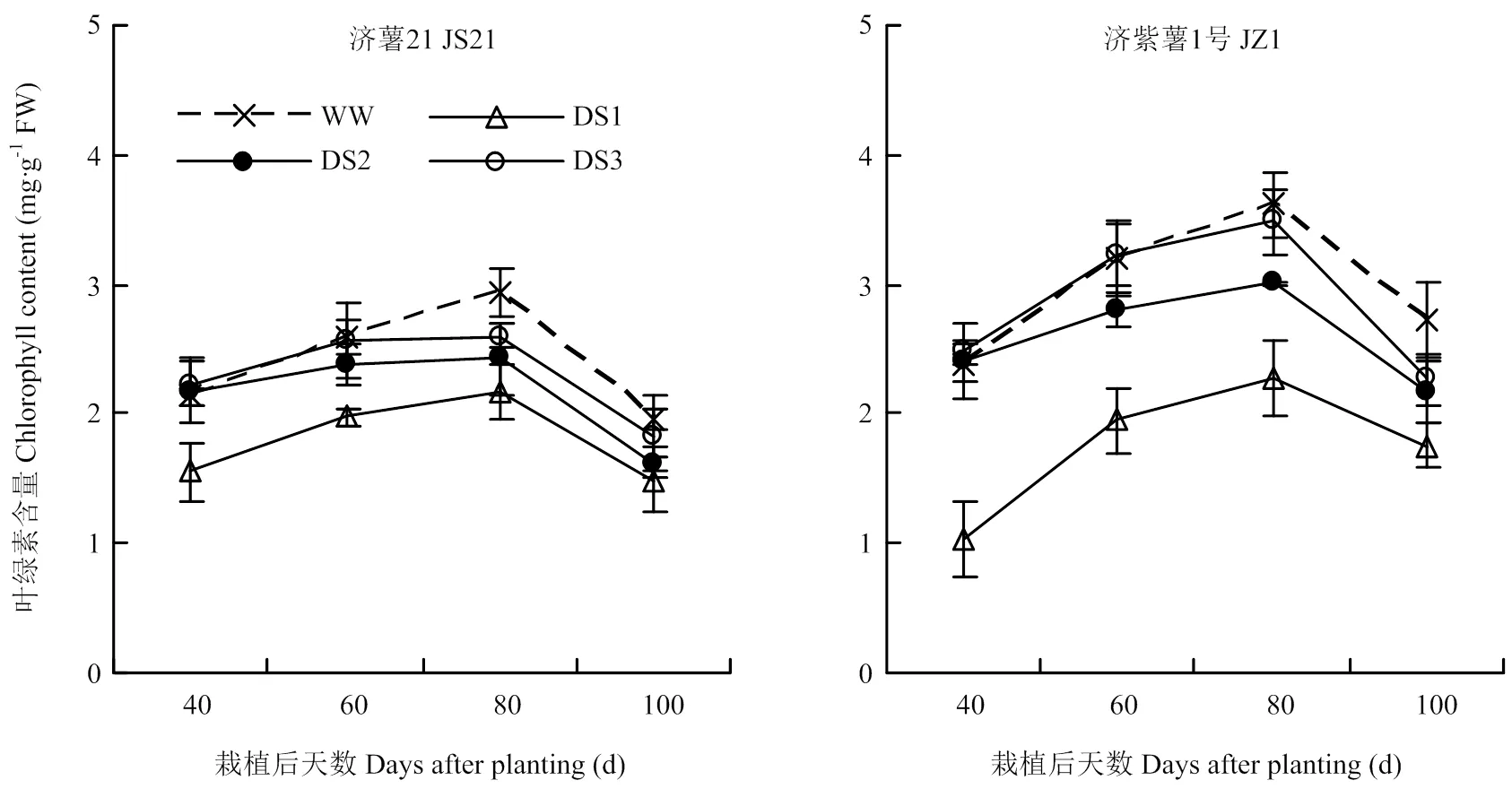
图1 不同时期干旱胁迫对甘薯功能叶叶绿素含量的影响
2.2 不同时期干旱胁迫对甘薯功能叶抗氧化能力的影响
2.2.1 相对电导率 干旱胁迫处理的功能叶相对电导率均在胁迫后呈逐渐升高的趋势,各生育时期均表现出DS1处理升高幅度最大,其次为DS2和DS3处理。抗旱品种济薯21功能叶相对电导率与对照相比的升高幅度均小于不抗旱品种济紫薯1号(图2)。说明干旱胁迫时间越早,甘薯功能叶相对电导率与对照
相比的升高幅度越大。
2.2.2 MDA含量 图3可见,所有处理功能叶MDA含量的变化趋势一致,随着甘薯生长发育,甘薯功能叶MDA含量均呈逐渐上升的趋势。各生育时期均表现出干旱胁迫处理的MDA含量高于对照,且DS1处理升高幅度最大,其次为DS2和DS3处理。干旱胁迫条件下,抗旱品种济薯21功能叶MDA含量与对照相比的升高幅度小于不抗旱品种济紫薯1号。
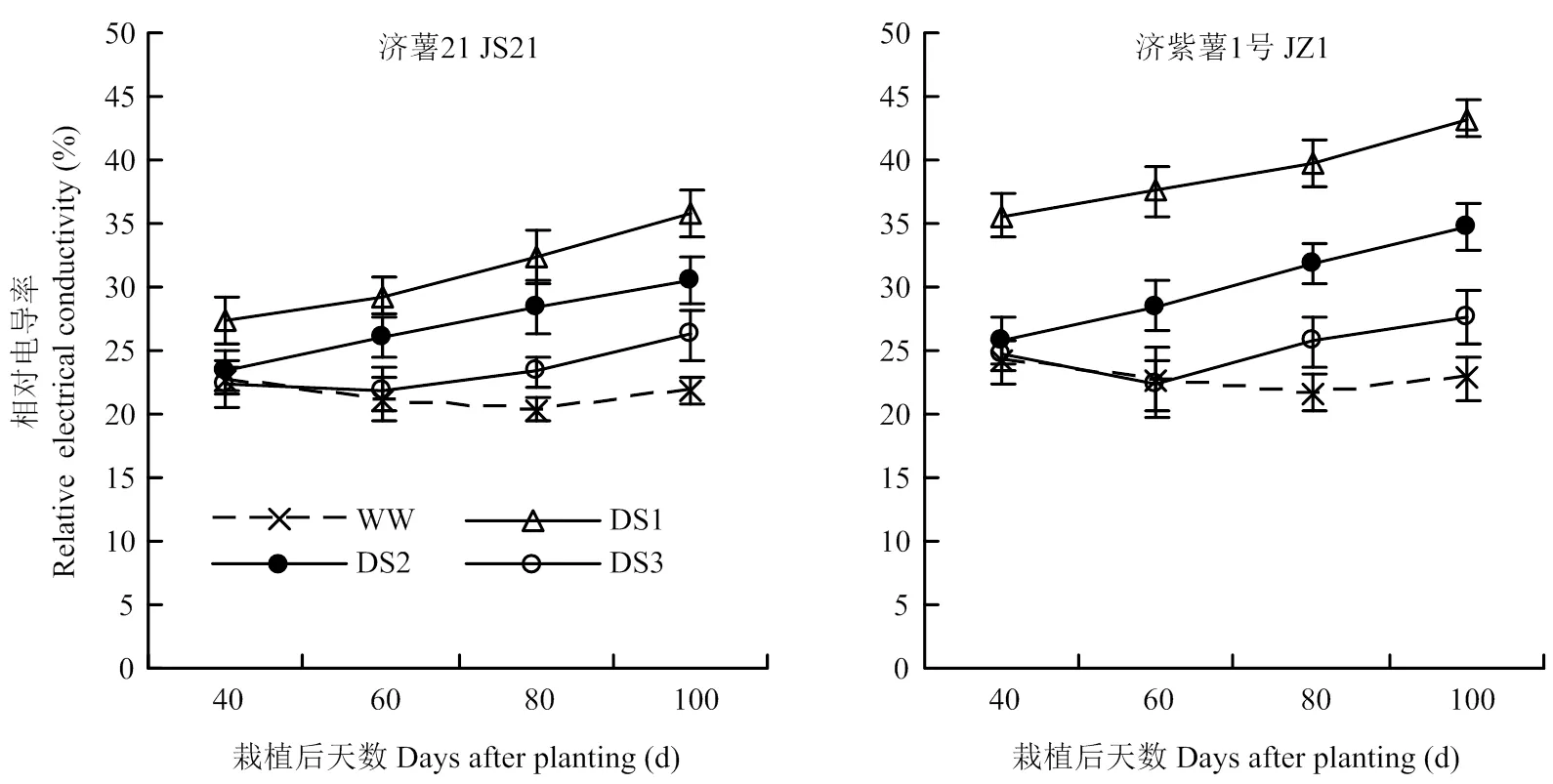
图2 不同时期干旱胁迫对甘薯功能叶相对电导率的影响
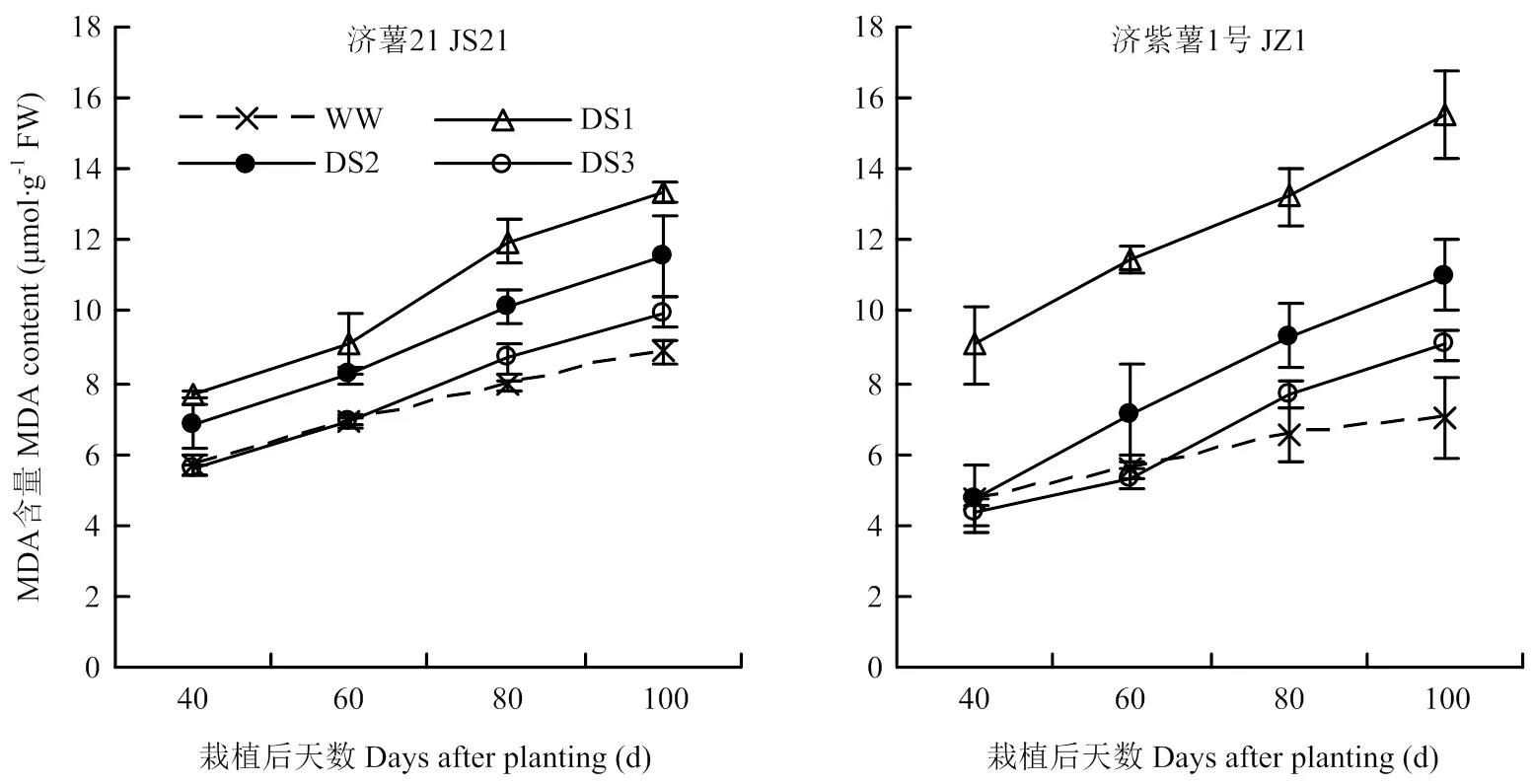
图3 不同时期干旱胁迫对甘薯功能叶MDA含量的影响
2.2.3 酶活性 从表5可以看出,2个品种功能叶抗氧化酶活性的变化趋势基本一致。干旱胁迫条件下,DS1处理的SOD、POD、CAT和APX活性在胁迫后40 d高于对照,60 d后低于对照,抗旱品种济薯21的上升幅度高于不抗旱品种济紫薯1号,下降幅度低于济紫薯1号。DS2和DS3处理均在胁迫后升高,栽后100 d,DS2和DS3处理的抗氧化酶活性均高于对照。
2.3 不同时期干旱胁迫对甘薯纤维根抗氧化能力的影响
2.3.1 根系活力 图4结果表明,不同时期干旱胁迫均导致纤维根根系活力下降,3个时期干旱胁迫比较,发根分枝期干旱胁迫的根系活力下降幅度最大,其次是蔓薯并长期和块根快速膨大期。2个品种比较,抗旱品种济薯21根系活力与对照相比下降幅度小于不抗旱品种济紫薯1号。
2.3.2 MDA含量 各生育时期均表现出干旱胁迫处理的纤维根MDA含量高于对照,且以DS1处理升高幅度最大,其次为DS2和DS3处理(图5)。抗旱品种济薯21在干旱胁迫条件下,纤维根MDA含量与对照相比的升高幅度小于不抗旱品种济紫薯1号。
2.3.3 酶活性 表6可见,干旱胁迫条件下,DS1处理的纤维根SOD、POD、CAT和APX活性均在胁迫后40 d高于对照,抗旱品种济薯21的升高幅度高于不抗旱品种济紫薯1号。DS2和DS3处理的纤维根酶活性在胁迫后升高的幅度低于DS1。说明干旱胁迫时间越早,对纤维根抗氧化酶活性的影响越大,中后期胁迫甘薯纤维根已具备较高的酶活性,干旱胁迫对其影响较小。
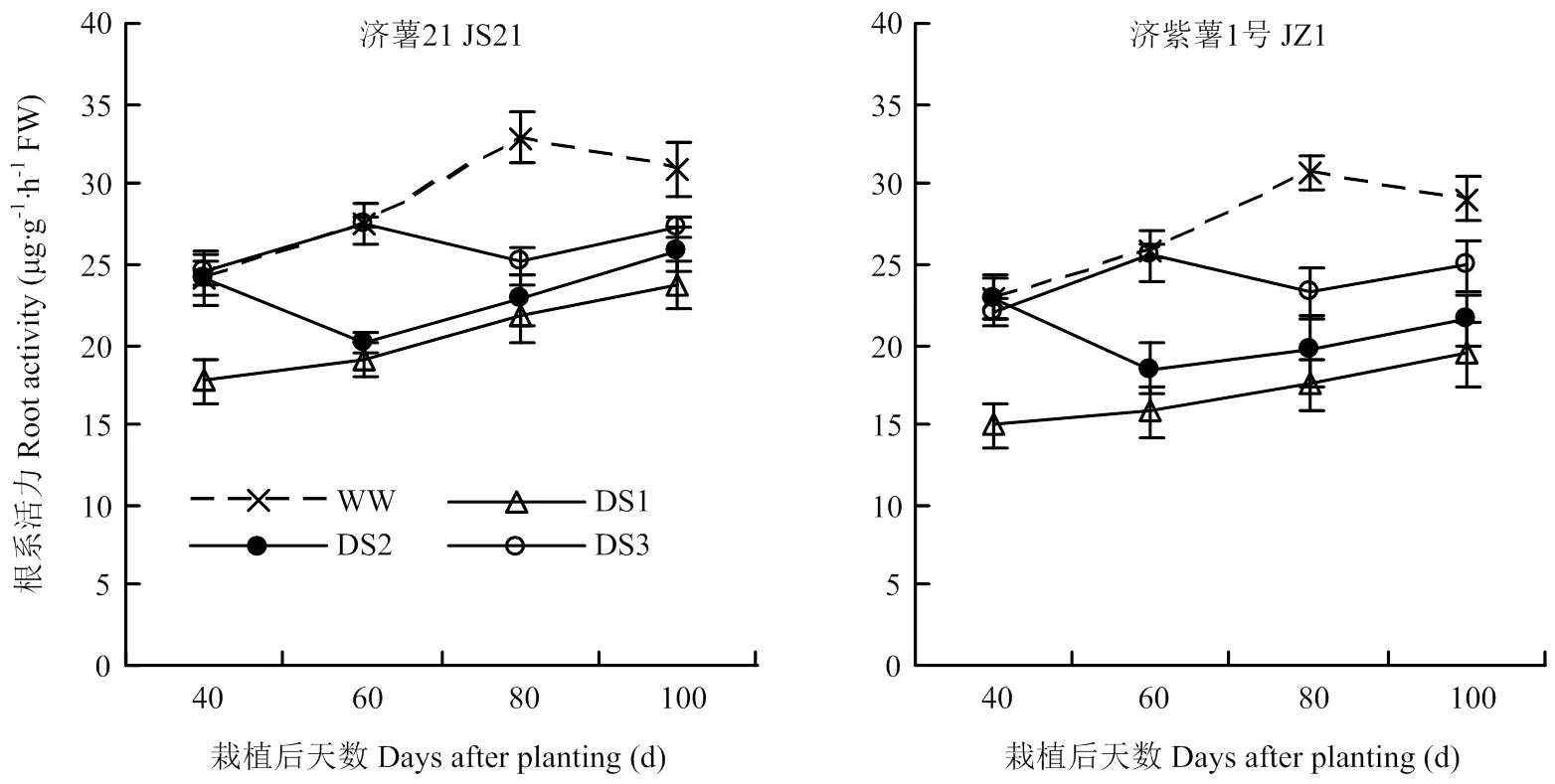
图4 不同时期干旱胁迫对甘薯根系活力的影响
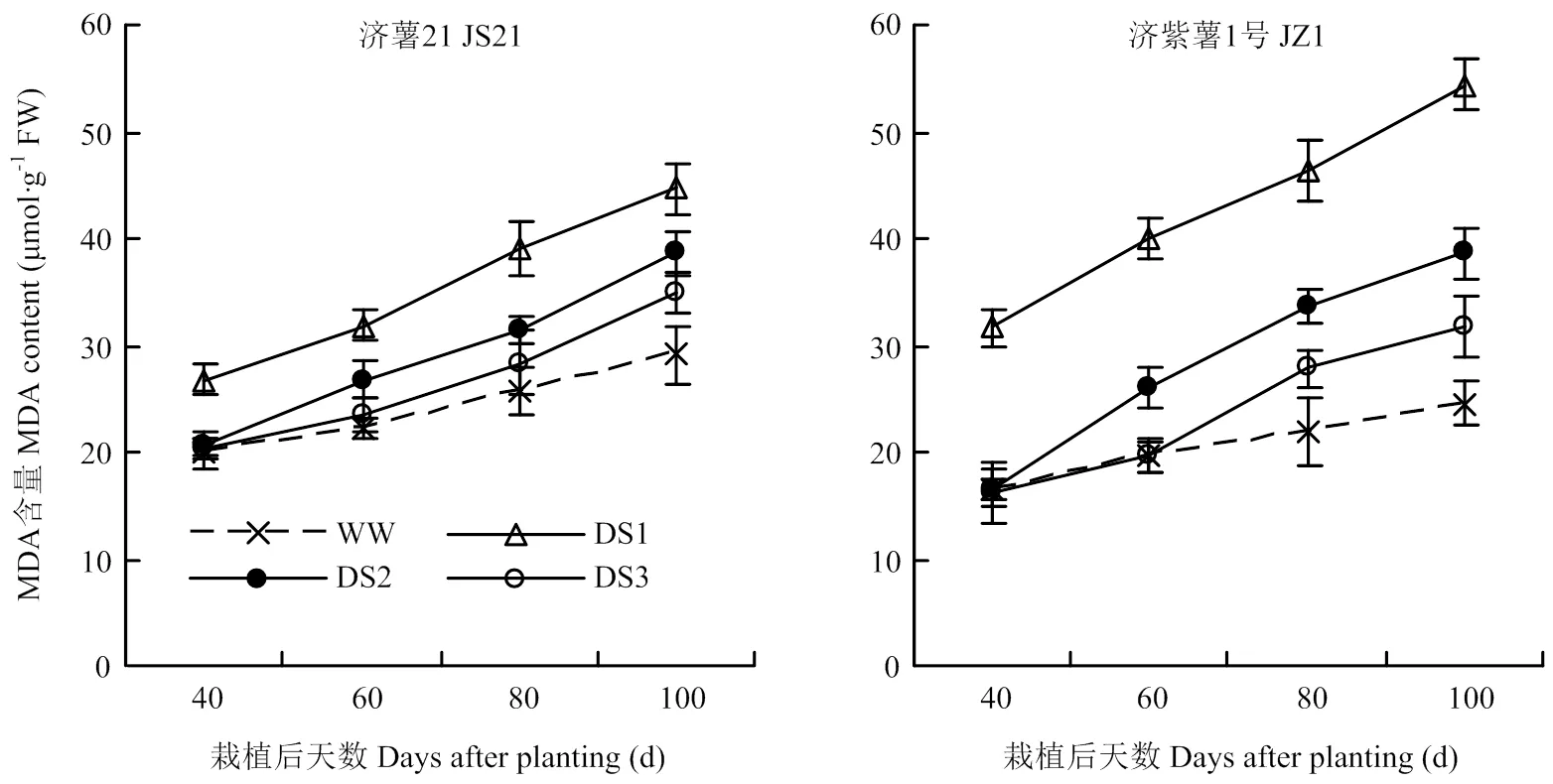
图5 不同时期干旱胁迫对甘薯纤维根MDA含量的影响
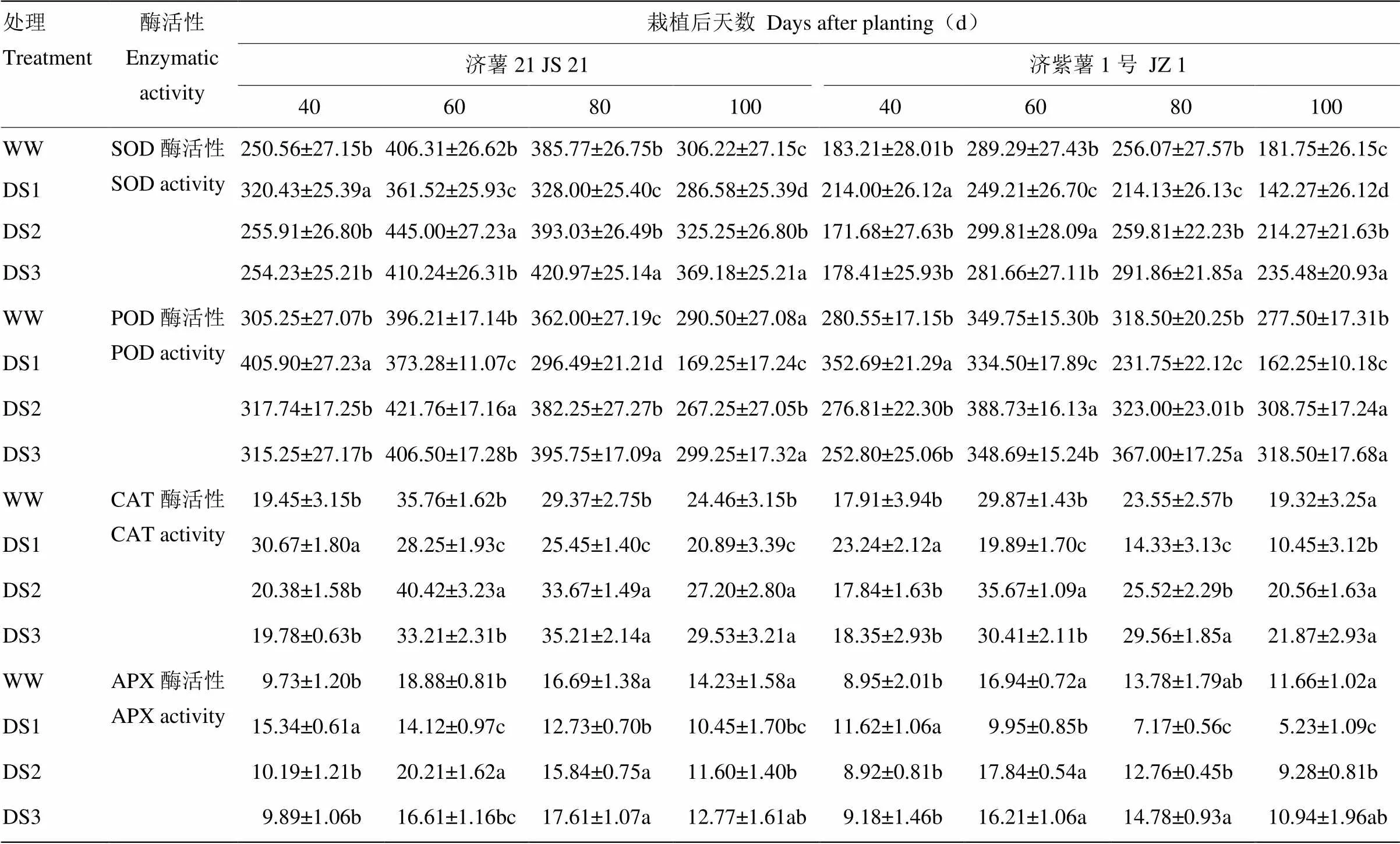
表5 不同时期干旱胁迫对甘薯功能叶SOD、POD、CAT和APX活性的影响
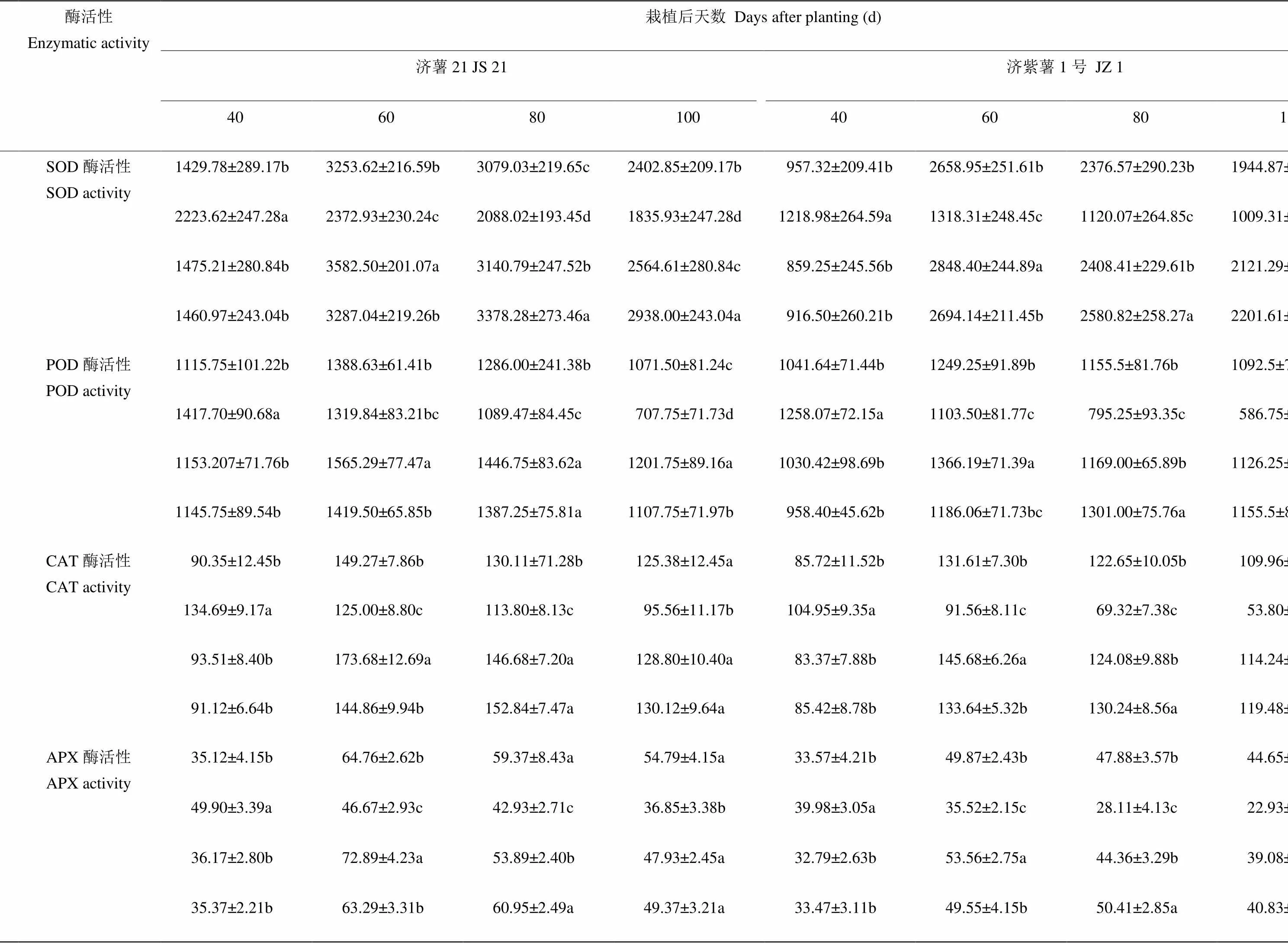
表6 不同时期干旱胁迫对甘薯纤维根SOD、POD、CAT和APX活性的影响
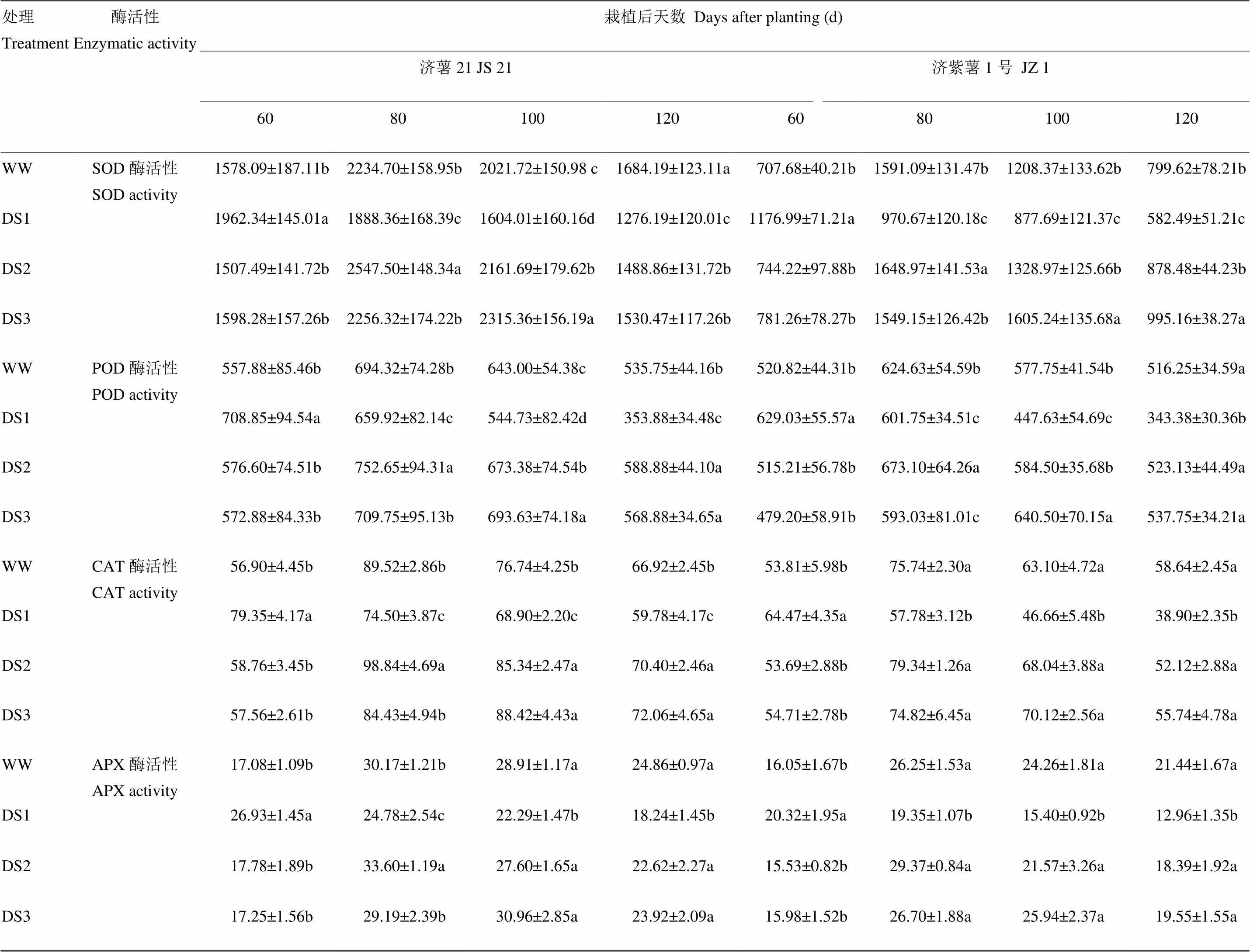
表7 不同时期干旱胁迫对甘薯块根SOD、POD、CAT和APX活性的影响
2.4 不同时期干旱胁迫对甘薯块根抗氧化能力的影响
2.4.1 MDA含量 从图6可以看出,干旱胁迫处理的纤维根MDA含量均高于对照,3个时期干旱胁迫比较,发根分枝期干旱胁迫的块根MDA含量升高幅度最大,其次为蔓薯并长期和块根快速膨大期。干旱胁迫处理的块根MDA含量与对照相比的升高幅度表现为抗旱品种济薯21小于不抗旱品种济紫薯1号。
2.4.2 酶活性 从表7可以看出,2个品种块根抗氧化酶活性的变化趋势基本一致。干旱胁迫导致甘薯块根SOD、POD、CAT和APX活性升高,DS1处理的块根SOD活性升高幅度和下降幅度均高于DS2和DS3处理。抗旱品种济薯21的升高幅度高于不抗旱品种济紫薯1号。说明发根分枝期干旱胁迫对甘薯块根抗氧化酶活性的影响最大。
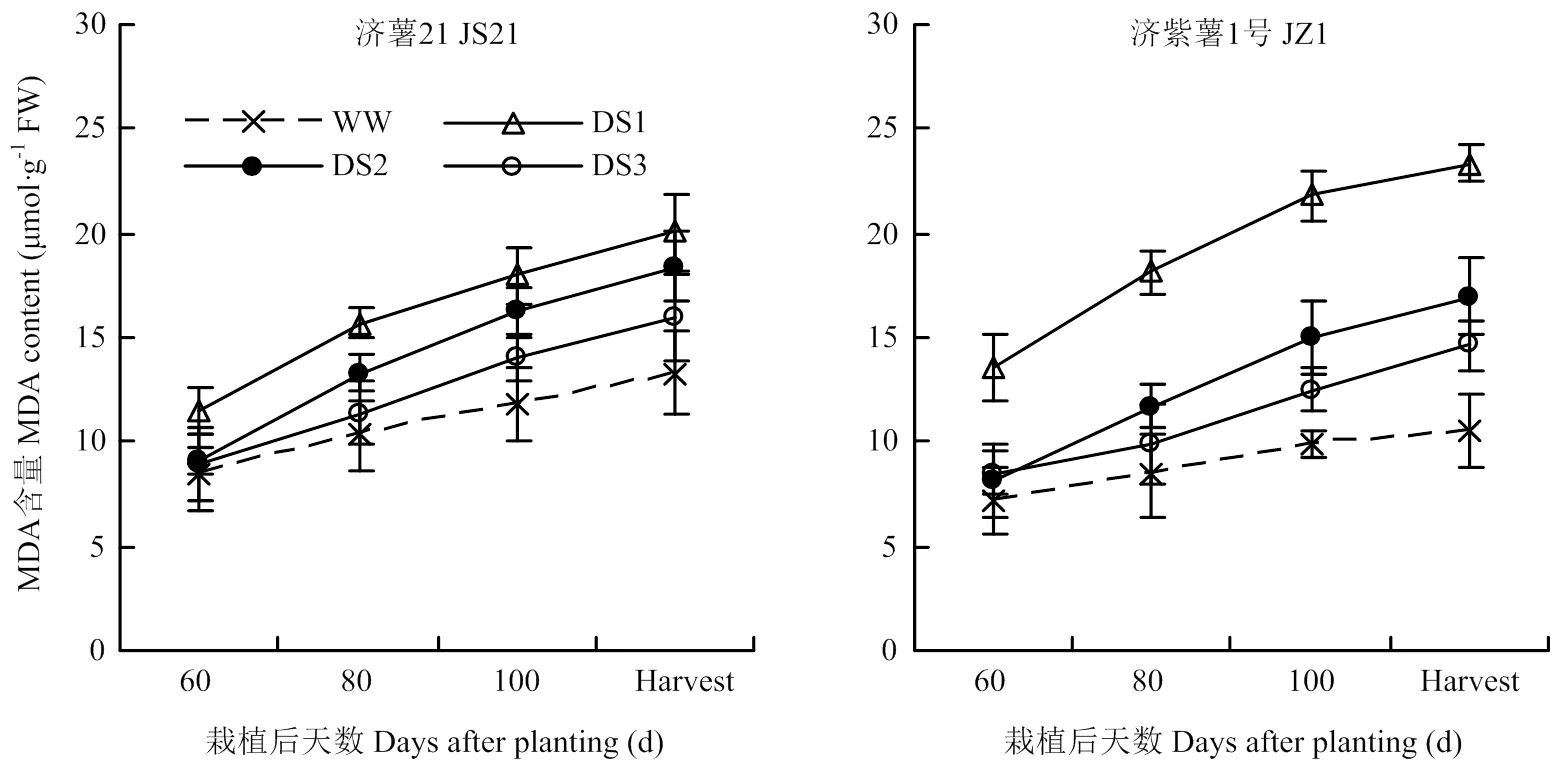
图6 不同时期干旱胁迫对甘薯块根MDA含量的影响
3 讨论
3.1 不同时期干旱胁迫对甘薯生长的影响
干旱胁迫可导致植物单株叶面积降低,生物量下降[24-26]。前人研究认为,不同甘薯品种的植株形态、生长势和产量性状等对干旱胁迫的适应能力不同,导致了品种间抗旱性的差异,叶面积系数、比叶面积、块根重量等与品种抗旱性呈显著的正相关关系[27],收获期的相对茎叶重能反映不同品种对逆境条件的适应性[28]。干旱胁迫导致的叶面积系数和生物量的下降幅度,品种间不同,可作为甘薯品种抗旱性鉴定的指标[29]。本试验中,抗旱品种济薯21的地上部生物量、地下部生物量、叶面积系数、叶绿素含量等在干旱胁迫条件下与对照相比的下降幅度均低于不抗旱品种济紫薯1号,认为甘薯植株的相对生物量、叶面积系数以及叶绿素含量等指标可以反映不同品种对干旱胁迫的适应性。
干旱胁迫降低了甘薯总叶数[30],使叶片大小、比叶面积和叶面积系数不同程度地降低,单株光合面积下降[1, 31],光合生产能力下降,生物产量和薯干产量随之下降[32],前期和中期胁迫对甘薯产量影响大于后期,前期干旱甘薯的总生物量降低50%,中期干旱地上和地下生物量分别降低38.4%和31.1%,后期干旱地上和地下生物量均减低10%[1]。不同时期干旱胁迫均抑制了甘薯地上部生长及块根形成和膨大,从而造成块根产量不同程度的降低,干旱胁迫时间越早,下降的幅度越大[2]。本研究认为,干旱胁迫条件下,甘薯叶面积系数的下降和功能叶叶绿素含量的下降导致光合生产能力下降,而根系活力的下降则影响了根系的生长和块根的膨大,进而导致地上部和地下部生物量的下降,干旱胁迫对地上部和地下部生长的抑制最终导致产量的降低,在本试验条件下,抗旱品种济薯21在发根分枝期干旱胁迫的减产幅度最大,其次是蔓薯并长期,块根快速膨大期干旱胁迫减产幅度最小,不抗旱品种济紫薯1号减产幅度大于抗旱品种济薯21,说明发根分枝期是甘薯产量对水分反应最敏感的时期,此时期应保证充足的水分供应,才能使甘薯在早期建立合理的群体结构,为获得高产奠定基础,而块根快速膨大期甘薯已具备较高的生物量,大部分块根已经形成,此时期干旱胁迫对薯干产量影响较小。
3.2 不同时期干旱胁迫对甘薯抗氧化能力的影响
逆境条件下,植物体内活性氧急剧增加,对植物生长造成严重的伤害,如抑制酶活性、破坏细胞膜稳定性、阻碍信号传导等。但是植物体同时也存在着发达的抗氧化酶防御系统,当植物遭受逆境胁迫时,该系统通过抗氧化剂和抗氧化酶协同作用清除植物体内过剩的活性氧,以维持活性氧的平衡。SOD、CAT和POD是抗氧化酶系统的关键酶,细胞中多余的超氧阴离子可被SOD清除,H2O2被CAT和POD歧化成水和氧分子,从而保护了SOD活性,在逆境胁迫中三者具有协同作用[33]。抗氧化酶活性高低与作物自身因素有关,逆境胁迫条件下,基因型不同[34-37]、器官不同[38-39]、发育阶段不同[40-41],抗氧化酶活性的变化也不同,而针对不同时期干旱胁迫对甘薯抗氧化能力的研究报道较少,汪宝卿等[42-43]研究了抗旱性不同的甘薯品种对干旱胁迫的适应性反应,认为抗旱品种块根通过抗氧化酶类协同作用抵御逆境,而耐旱性弱的甘薯品种块根木质化增强,仅能维持基础性代谢。本文研究了不同时期干旱胁迫对甘薯功能叶、纤维根和块根抗氧化酶活性的影响,结果表明,功能叶、纤维根和块根抗氧化酶活性均在胁迫后升高。干旱胁迫时间越早,抗氧化酶活性升高和下降的幅度越大。各生育时期纤维根的抗氧化酶活性均高于块根和叶片,KIM等[44]研究也认为纤维根抗氧化酶活性高于其他分化根,因此本研究结合前人的研究结果,认为甘薯根系是最先感受土壤干旱胁迫的敏感部位,在各种分化根中,纤维根对干旱胁迫的敏感性最强。逆境胁迫条件下活性氧累积,导致膜饱和度增加,流动性减小,细胞膜透性加大,电解质大量外渗。作为膜脂过氧化作用的主要产物,MDA含量随着胁迫的加剧呈逐渐升高的趋势[17-18]。本研究中,干旱胁迫导致甘薯功能叶、纤维根和块根的MDA含量升高,且胁迫时间越早,升高的幅度越大,对甘薯功能叶、纤维根和块根的伤害程度越大,MDA含量的高低,反映了细胞膜受伤害的程度,也决定了植物受伤害的程度。
4 结论
不同时期干旱胁迫导致甘薯薯干产量不同程度下降,3个时期干旱胁迫比较,发根分枝期干旱胁迫薯干产量的下降幅度大于蔓薯并长期和块根快速膨大期。干旱胁迫条件下,功能叶、纤维根和块根的抗氧化酶系统遭到破坏,细胞膜透性增大,渗透调节物质积累,生理代谢平衡被破坏,抑制了甘薯叶片和根系的正常生长,限制了块根的形成和膨大,导致块根产量的下降。早期干旱胁迫导致的抗氧化酶活性的变化无法在复水后得到有效修复;而甘薯进入块根快速膨大期,地上部和地下部均已具有较高的生物量、且抗氧化能力已具有较高的水平,该时期干旱胁迫对甘薯生长的影响较小。因此,认为干旱胁迫时间越早,对甘薯生长发育的影响越大,发根分枝期是甘薯块根产量对水分最敏感的时期。
[1] 李长志, 李欢, 刘庆, 史衍玺. 不同生长时期干旱胁迫甘薯根系生长及荧光生理的特性比较. 植物营养与肥料学报, 2016, 22(2): 511-517.
LI C Z, LI H, LIU Q, SHI Y X. Comparison of root development and fluorescent physiological characteristics of sweet potato exposure to drought stress in different growth stages., 2016, 22(2): 511-517. (in Chinese)
[2] 张海燕, 段文学, 解备涛, 董顺旭, 汪宝卿, 史春余, 张立明. 不同时期干旱胁迫对甘薯内源激素的影响及其与块根产量的关系. 作物学报, 2018, 44(1): 126-136.
ZHANG H Y, DUAN W X, XIE B T, DONG S X, WANG B Q, SHI C Y, ZHANG L M. Effects of drought stress at different growth stages on endogenous hormones and its relationship with storage root yield in sweetpotato., 2018, 44(1): 126-136. (in Chinese)
[3] VILLORDON A Q. Characterization of lateral root development at the onset of storage root initiation in ‘Beauregard’ sweetpotato adventitious roots.2012, 47(7): 961-968.
[4] CHOWDHORY S R, SINGH R, KUNDU D K, ANTONY E, THAKUR A K, VERMA H N. Growth, dry matter partitioning and yield of sweet potato (L.) as influence by soil mechanical impedance and mineral nutrition under different irrigation regimes., 2000, 16(1): 25-29.
[5] FANG Y J, XIONG L Z. General mechanisms of drought response and their application in drought resistance improvement in plants., 2015, 72(4): 673-689.
[6] REDDY A R, CHAITANYA K V, VIVEKANANDAN M. Drought- induced responses of photosynthesis and antioxidant metabolism in higher plants., 2004, 161(11): 1189-1202.
[7] KIM Y H, JEONG J C, LEE H S, KWAK S S. Comparative characterization of sweetpotato antioxidant genes from expressed sequence tags of dehydration-treated fibrous roots under different abiotic stress conditions., 2013, 40(4): 2887-2896.
[8] SRIVALLI B, SHARMA G, KHANNA CHOPRA R. Antioxidative defense system in an upland rice cultivar subjected to increasing intensity of water stress followed by recovery., 2003, 119(4): 503-512.
[9] GUO Z F, OU W, LU S L, ZHONG Q. Differential responses of antioxidative system to chilling and drought in four rice cultivars differing in sensitivity., 2006, 44(11/12): 828-836.
[10] LI Z, ZHOU H, PENG Y, ZHANG X, MA X, HUANG L, YAN Y. Exogenously applied spermidine improves drought tolerance in creeping bentgrass associated with changes in antioxidant defense, endogenous polyamines and phytohormones., 2015, 76(1): 71-82.
[11] 陈京. 抗旱性不同的甘薯品种对渗透胁迫的生理响应. 作物学报, 1999, 25(2): 232-236.
CHEN J. Physiological response for different drought resistance of sweet potato under osmotic stress., 1999, 25(2): 232-236. (in Chinese)
[12] GILL S S, TUTEJA N. Reactive oxygen species and antioxidant machinery in abiotic stress tolerance in crop plants., 2010, 48(12): 909-930.
[13] 李文卿, 潘廷国, 柯玉琴, 陈凤翔. 土壤水分胁迫对甘薯苗期活性氧代谢的影响. 福建农业学报, 2000, 15(4): 45-50.
LI W Q, PAN T G, KE Y Q, CHEN F X. Effects of soil water stress on metabolism of active oxygen in leaves of sweet potato seedling., 2000, 15(4): 45-50. (in Chinese)
[14] 何冰, 许鸿原, 陈京. 干旱胁迫对甘薯叶片质膜透性及抗氧化酶类的影响. 广西农业大学学报, 1997, 16(4): 287-290.
HE B, XU H Y, CHEN J. Effects of drought stress on the permeability of plasma membrane and antioxidation enzymes of the leaves of sweet potato,, 1997, 16(4): 287-290. (in Chinese)
[15] 张明生, 谈锋, 张启堂. 快速鉴定甘薯品种抗旱性的生理指标及方法的筛选. 中国农业科学, 2001, 34(3): 260-265.
ZHANG M S, TAN F, ZHANG Q T. Physiological indices for rapid identification of sweet potato drought resistance and selection of methods., 2001, 34(3): 260-265. (in Chinese)
[16] 陈京, 王支槐, 周启贵. PEG处理对甘薯叶肉细胞超微结构的影响. 西南师范大学学报(自然科学版), 1997, 22(4): 398-404.
CHEN J, WANG Z H, ZHOU Q G. Effects of PEG treatment on ultrastructure in mesophyll cells of sweet potato.(), 1997, 22(4): 398-404. (in Chinese)
[17] 李锦树, 王洪春, 王文英, 朱亚芳. 干旱对玉米叶片细胞透性及膜脂的影响. 植物生理学报, 1983, 9(3): 223-230.
LI J S, WANG H C, WANG W Y, ZHU Y F. Effect of drought on the permeability and membrane lipid composition from maize leaves., 1983, 9(3): 223-230. (in Chinese)
[18] DHINDSA R S, MATOWE W. Drought tolerance in two mosses: correlated with enzymatic defence against lipid peroxidation., 1981, 32(1): 79-91.
[19] 山仑, 康绍忠, 吴普特. 中国节水农业. 北京: 中国农业出版社, 2004: 229-230.
SHAN L, KANG S Z, WU P T.. Beijing: China Agriculture Press, 2004: 229-230. (in Chinese).
[20] 王留梅, 毛守民, 潘明华, 周利霞. 甘薯叶面积系数田间速测方法初探. 中国农学通报, 2001, 17(6): 82, 90.
WANG L M, MAO S M, PAN M H, ZHOU L X. Field measurement method of leaf area index of sweet potato., 2001,17 (6): 82, 90. ( in Chinese).
[21] 李合生. 植物生理生化实验原理和技术. 北京: 高等教育出版社, 2000: 184-185.
LI H S.. Beijing: Higher Education Press, 2000: 184-185. (in Chinese)
[22] 张丹, 刘国顺, 章建新, 徐敏. 打顶时期对烤烟根系活力及烟碱积累规律的影响. 中国烟草科学, 2006, 27(1): 38-41.
ZHANG D, LIU G S, ZHANG J X, XU M. Effect of different topping time on activity of root system and accumulation of nicotine in tobacco plants., 2006, 27(1): 38-41. (in Chinese)
[23] 陈建勋, 王晓峰. 植物生理学实验指导(第二版). 广州:华南理工大学出版社, 2006: 64-66.
CHEN J X, WANG X F.(). Guangzhou: South China University of Technology Publishers, 2006: 64-66. (in Chinese)
[24] 马富举, 李丹丹, 蔡剑, 姜东, 曹卫星, 戴廷波. 干旱胁迫对小麦幼苗根系生长和叶片光合作用的影响. 应用生态学报, 2012, 23(3): 724-730.
MA F J, LI D D, CAI J, JIANG D, CAO W X, DAI T B. Responses of wheat seedlings root growth and leaf photosynthesis to drought stress., 2012, 23(3): 724-730. (in Chinese)
[25] Pinheiro C, Chaves M M. Photosynthesis and drought: Can we make metabolic connections from available data., 2011, 62: 869-882.
[26] 井大炜, 邢尚军, 杜振宇, 刘方春. 干旱胁迫对杨树幼苗生长、光合特性及活性氧代谢的影响. 应用生态学报, 2013, 24(7) : 1809-1816.
JING D W, XING S J, DU Z Y, LIU F C. Effects of drought stress on the growth,photosynthetic characteristics,and active oxygen metabolism of poplar seedlings., 2013, 24 (7): 1809-1816. ( in Chinese)
[27] 张明生, 谢波, 戚金亮, 谈锋, 张启堂, 杨永华. 甘薯植株形态、生长势和产量与品种抗旱性的关系. 热带作物学报, 2006, 27(1): 39-43.
ZHANG M S, XIE B, QI J L, TAN F, ZHANG Q T, YANG Y H. Relationship of drought resistance of sweet potato with its plant type, growth vigour and yield under water stress., 2006, 27(1): 39-43. (in Chinese)
[28] 谈锋, 张启堂, 陈京, 李坤培. 甘薯品种抗旱适应性的数量分析. 作物学报, 1991, 17(5): 394-398.
TAN F, ZHANG Q T, CHEN J, LI K P. Quantitative analysis of adaptability of drought resistance in sweet potato cultivars., 1991, 17(5): 394-398. (in Chinese)
[29] 张海燕, 解备涛, 汪宝卿, 董顺旭, 段文学, 张立明. 不同甘薯品种抗旱性评价及耐旱指标筛选. 作物学报, 2019, 45(3): 419-430.
ZHANG H Y, XIE B T, WANG B Q, DONG S X, DUAN W X, ZHANG L M. Evaluation of drought tolerance and screening for drought-tolerant indicators in sweetpotato cultivars., 2019, 45(3): 419-430. (in Chinese)
[30] 许育彬, 程雯蔚, 陈越, 华千勇. 不同施肥条件下干旱对甘薯生长发育和光合作用的影响. 西北农业学报, 2007, 16(2): 59-64.
XU Y B, CHENG W W, Chen Y, HUANG Q Y. Effect of drought on growth and development and photosynthesis of sweet potato under different fertilization conditions., 2007, 16(2): 59-64. (in Chinese)
[31] 孙哲, 史春余, 刘桂玲, 高俊杰, 柳洪鹃, 郑建利, 张鹏. 干旱胁迫与正常供水钾肥影响甘薯光合特性及块根产量的差异. 植物营养与肥料学报, 2016, 22(4): 1071-1078.
SUN Z, SHI C Y, LIU G L, GAO J J, LIU H J, ZHENG J L, ZHANG P. Effect difference of potassium fertilizer on leaf photosynthetic characteristics and storage root yield of sweet potato under drought stress and normal water condition., 2016, 22(4): 1071-1078. (in Chinese)
[32] 张海燕, 解备涛, 段文学, 董顺旭, 汪宝卿, 张立明, 史春余. 不同时期干旱胁迫对甘薯光合效率和耗水特性的影响. 应用生态学报, 2018, 29(6): 1943-1950.
ZHANG H Y, XIE B T, DUAN W X, DONG S X, WANG B Q, ZHANG L M, SHI C Y. Effects of drought stress at different growth stages on photosynthetic efficiency and water consumption characteristics in sweet potato., 2018, 29(6): 1943-1950. (in Chinese)
[33] 李璇, 岳红, 王升, 黄璐琦, 马炯, 郭兰萍. 影响植物抗氧化酶活性的因素及其研究热点和现状. 中国中药杂志, 2013, 38(7): 973-978.
LI X, YUE H, WANG S, HUANG L Q, MA J, GUO L P. Research of different effects on activity of plant antioxidant enzymes., 2013, 38(7): 973-978. (in Chinese)
[34] NELSON D M, HU F S, TIAN J, STEFANOVA I, BROWN T A. Response of C3and C4plants to middle-holocene climatic variation near the prairie-forest ecotone of Minnesota., 2004, 101(2): 562-567.
[35] UZILDAY B, TURKAN I, SEKMEN A H, OZGUR R, KARAKAYA H C. Comparison of ROS formation and antioxidant enzymes in Cleome gynandra (C4) and Cleome spinosa (C3) under drought stress., 2012, 182: 59-70.
[36] NAYYAR H, GUPTA D. Differential sensitivity of C3and C4plants to water deficit stress: association with oxidative stressand antioxidants., 2006, 58(1): 106-113.
[37] HU L X, LI H Y, PANG H C, FU J. Responses of antioxidant gene,protein and enzymes to salinity stress in two genotypes of perennial ryegrass () differing in salt tolerance., 2012, 169(2): 146-156.
[38] MISRA N, GUPTA A K. Effect of salinity and different nitrogen sources on the activity of antioxidant enzymes and indole alkaloid content inseedlings., 2006, 163(1): 11-18.
[39] JIANG L, YANG H. Prometryne-induced oxidative stress and impact on antioxidant enzymes in wheat., 2009, 72(6): 1687-1693.
[40] ALMESELMANI M, DESHMUKH P S, SAIRAM R K, KUSHWAHA S R, SINGH T P. Protective role of antioxidant enzymes under high temperature stress., 2006, 171(3): 382-388.
[41] OHE M, RAPOLU M, MIEDA T, MIYAGAWA Y. Decline in leaf photooxidative-stress tolerance with age in tobacco., 2005, 168(6): 1487-1493.
[42] 汪宝卿, 姜瑶, 解备涛, 董顺旭, 张海燕, 王庆美, 张立明. 2个不同耐旱性甘薯品种的苗期根系蛋白组差异分析. 核农学报, 2017, 31(2): 232-240.
WANG B Q, JIANG Y, XIE B T, DONG S X, ZHANG H Y, WANG Q M, ZHANG L M. Proteomic analysis of roots in seedling stage of two sweetpotato varieties with different drought tolerance., 2017, 31(2): 232-240. (in Chinese)
[43] 汪宝卿, 解备涛, 张海燕, 董顺旭, 段文学, 王庆美, 张立明. 基于iTRAQ技术的不同耐旱性甘薯苗期根系差异蛋白分析. 核农学报, 2017, 31(10): 1904-1912.
WANG B Q, XIE B T, ZHANG H Y, DONG S X, DUAN W X, WANG Q M, ZHANG L M. Analysis of differential proteome in roots during seedling stage of sweetpotato with different drought tolerance based on iTRAQ method., 2017, 31(10): 1904-1912. (in Chinese)
[44] KIM Y H, PARK S C, JI C Y, LEE J J, JEONG J C, LEE H S, KWAK S S. Diverse antioxidant enzyme levels in different sweetpotato root types during storage root formation., 2015, 75(1): 155-164.
Effects of Drought Treatments at Different Growth Stages on Growth and the Activity of Antioxidant Enzymes in Sweetpotato
ZHANG HaiYan1, XIE BeiTao1, WANG BaoQing1, DONG ShunXu1, DUAN WenXue1, ZHANG LiMing2
(1Crop Research Institute, Shandong Academy of Agricultural Sciences/Scientific Observation and Experimental Station of Tubers and Root Crops in Huang-Huai-Hai Region, Ministry of Agriculture and Rural Affairs/Shandong Engineering Laboratory of Featured Crops, Jinan 250100;2Shandong Academy of Agricultural Sciences, Jinan 250100)
【Objective】The aim of this study was to investigate the mechanism of yield reduction of sweetpotato ((L.) Lam) caused by drought stress at different growth stages, so as to provide theoretical basis and technical support for production of sweetpotato in dryland areas. 【Method】Field experiments were conducted under a rain exclusion shelter to investigate the effects of drought treatments at different growth stages on growth and the activity of antioxidant enzymes in sweetpotato. Two sweetpotato cultivars (JS 21, a drought-tolerant cultivar, and JZ 1, a drought-sensitive cultivar) were subjected to four drought stress treatments respectively, including WW (well watered during the whole growth period, constructed as a control), DS1 (drought stress during the establishment stage), DS2 (drought stress during the intermediate stage), and DS3 (drought stress during the final stage). 【Result】 Drought stress resulted in significant decrease of dry weight in sweetpotato, and which declined most under the earliest drought stress. Compared with the control, the dry weight of storage roots of DS1, DS2 and DS3 in drought-tolerant cultivar (JS 21) were 32.24%, 30.68% and 13.76%, respectively, while 44.02%, 39.54% and 17.87% in drought-sensitive cultivar (JZ 1), respectively. The activity of antioxidant enzymes of functional leaves, fibrous roots and storage roots increased after drought stress. Similarly, the earlier of the drought stress, the greater influence on the activity of antioxidant enzymes was observed in sweetpotato. The enzyme activity in the fibrous roots in each stage was higher than that in the storage roots and the functional leaves. Our results indicated that the fibrous roots were the most sensitive to drought stress. Drought stress could lead to the increase of the relative electrical conductivity of functional leaves, and the MDA content in functional leaves, fibrous roots and storage roots of sweetpotato. The earlier the application of the drought stress in sweetpotato, the greater the increase of the MDA content was observed. 【Conclusion】The earlier of the drought stress, the greater influence on the activity of antioxidant enzymes was observed in sweetpotato, and could not be renovated. Therefore, the normal growth of leaves and roots were inhibited, and the formation and bulking of storage roots were limited. Establishment stage of sweetpotato was the most sensitive to drought stress.
sweetpotato; drought stress; yield; activity of antioxidant enzymes
2019-08-19;
2019-09-19
国家现代农业产业技术体系建设专项(CARS-10-B08)、山东省薯类产业创新团队项目(SDAIT-16-09)、山东省农业科学院农业科技创新工程项目(CXGC2016A05)、山东省农业重大应用技术创新项目(SD2019zz022)
张海燕,E-mail:zhang_haiyan02@163.com。解备涛,E-mail:279151695@qq.com。张海燕和解备涛为同等贡献作者。通信作者段文学,E-mail:duanwenxue2010@163.com。通信作者张立明,E-mail:zhanglm11@sina.com
(责任编辑 杨鑫浩)
