3D 打印细胞容器样支架在多细胞组织工程中的应用研究
2020-04-12王晓亚张猛马景阁徐梦驰常江MihaelGelinsky吴成铁
王晓亚 ,张猛 ,马景阁 ,徐梦驰 ,常江 ,Mihael Gelinsky ,吴成铁 ,*
a State Key Laboratory of High Performance Ceramics and Superfine Microstructure, Shanghai Institute of Ceramics, Chinese Academy of Sciences, Shanghai 200050, China
b Center of Materials Science and Optoelectronics Engineering, University of Chinese Academy of Sciences, Beijing 100049, China
c Center for Translational Bone, Joint and Soft Tissue Research, University Hospital Carl Gustav Carus & Faculty of Medicine, Technische Universität Dresden, Dresden 01307, Germany
组织工程的最终目标是获得与天然组织结构及功能无异的组织或器官[1-3]。然而,组织工程技术在精确模拟生物组织复杂结构与功能方面仍旧面临挑战[4,5]。人体组织包含200多种细胞,且大部分组织都由多种细胞构成,以维持正常的组织功能,这也是目前无法在体外成功构建复杂的3D组织与器官的原因所在[6]。对细胞相互作用的行为的深入研究对于模仿天然组织和器官起到十分关键的作用,因此,构建与体内细胞微环境相近的细胞共培养模型,以便研究细胞的增殖、分化以及细胞间的相互作用,对于人工设计和制造3D组织是十分重要的。然而,传统的2D细胞培养模型,如细胞培养板,并不能为细胞提供一个可以维持体内自然形态或细胞间有效交流的微环境[7,8]。尽管通常认为在2D材料表面上培养的细胞表现出更高的细胞增殖率,但细胞的分化作用受到了抑制[9]。此外,天然组织通常包含两种或两种以上细胞,不同种细胞之间可以通过生命活动进行细胞通讯[10]。尽管在细胞培养板上建立的共培养体系可以增强细胞间的相互作用与细胞通讯,但在2D材料表面共培养的细胞,其空间构建无法像在体内环境一样[7,11,12]。因而,我们需要一个更为合适的细胞培养模型模拟细胞的真实生长环境,从而解决上述难题。
在此之前,人们通过无支架或基于支架的培养体系已经开发出了3D细胞培养模型,该模型能够提供相对天然的细胞生长微环境以维持细胞的自然形态与功能。骨组织是十分复杂的体系,在细胞外基质的有序组织下排列着很多不同种类的细胞,由此对机械与生理刺激做出响应[13]。基于支架的细胞培养体系的优点在于它可以提供机械支撑以及保证组织的连续性。因此,建立基于支架的细胞共培养体系可以用于研究骨组织再生中的细胞间相互作用,以及研究细胞的单独效应或协同效应。例如,相比于单独培养HBMSC,在β-磷酸三钙(β-TCP)支架上共培养人骨髓间质干细胞(HBMSC)与人脐静脉内皮细胞(HUVEC),细胞可以展现出更高的碱性磷酸酶活性[14]。然而,在多数情况下,基于支架的共培养体系所培养的多种细胞是混合存在的,并不能分辨整个共培养体系的生物学效应是源于细胞间的直接接触还是旁分泌相互作用效应[15]。此外,人体组织中的各种细胞通常按照特殊的、非接触的空间排布存在,因此简单地把不同种细胞混合起来并不能准确地模拟细胞在体内的真实状态[7]。借助各种剪接技术,静电纺丝支架[16]和多层水凝胶支架[17]都被应用于细胞的间接接触式共培养体系。然而,据我们所知,人们尚未能建立由三种或四种不同种类的细胞所组成的非接触式共培养模型。目前也很难在一个完整的支架中建立一个非接触式多细胞共培养体系,并且允许该体系中的细胞在3D空间中与其周围环境相互作用。
3D打印技术为制造复杂结构的支架提供了一个有效的途径[18]。在本研究中,我们制备出一种β-TCP/HA双相生物陶瓷细胞共培养容器,其中包含四种不同形状的微孔结构:三角形、正方形、平行四边形以及长方形,通过3D打印技术将不同的微孔整合在一起。然后,我们将四种不同的骨相关细胞,包括HBMSC、HUVEC、人脐静脉平滑肌细胞(HUVSMC)、人真皮成纤维细胞(HDF),注射到细胞共培养容器的不同形状的微孔中,以便研究这些细胞在骨生成和血管生成过程中细胞的单独效应与协同效应。同时,将2D平板培养的这四种细胞设为对照组。
据我们所知,本研究首次报道了在一个完整的细胞培养容器中,建立含有四种细胞的非接触式共培养体系,用以模仿骨组织的细胞生态环境,该项工作也为研究多细胞间相互作用机理提供了一种研究模型,并且为基于支架的多细胞共培养体系提供了研究方向,其最终目标是实现组织再生。
2. 材料与研究方法
2.1. 材料
β-TCP/HA粉末购置于昆山华侨科技新材料有限公司(中国),并用200目筛网过筛。将Pluronic F-127(Sigma-Aldrich, USA)溶于水形成20%(质量分数)的水溶液,作为黏合剂。接下来,将4 g β-TCP/HA与2 g Pluronic F-127溶液混合,得到均匀的可供打印的墨水。
2.2. 3D 细胞容器的设计与制造
使用计算机辅助设计(CAD),可将细胞容器的整体框架设计成四个含有不同微孔结构的部分,包括三角形、正方形、平行四边形和长方形。为了确保细胞容器中上述各部分能够分别承载四种不同的细胞,细胞容器的所有内壁、底部和边界均为无缝衔接。利用尺寸为12 mm × 12 mm × 4.8 mm的细胞容器研究细胞增殖,利用另一种与其几何结构相似的24 mm × 24 mm × 4 mm的细胞容器研究细胞分化。细胞容器由基于挤出成型技术的BioScaffolder(GeSiM, Germany)制得。为了使挤出线材连贯一致,将室温下打印头的移动速度设置为4~6 mm·s-1,挤出压力设置为2~4 bar(1 bar = 105Pa)。打印后,坯料在室温下干燥24 h,之后在加热速率为2 ℃·min-1的条件下,在1100 ℃下烧结3 h,获得纯陶瓷细胞容器。
2.3. 3D 细胞容器的表征方法
利用X射线衍射仪(XRD; D8 ADVANCE, Bruker, Germany)检测β-TCP/HA细胞容器中的相组成,利用数码相机(Nikon, Japan)观测细胞容器的三视图,利用光学显微镜(S6D, Leica, Germany)观测细胞容器中的四种微孔结构。
2.4. 细胞的培养与多细胞共培养体系的建立
HBMSC与HBMSC细胞培养基购置于赛业生物科技有限公司(中国)。HUVEC通过以往文献[19]中提到的方法进行分离,并在内皮细胞培养基(Sciencell, USA)中进行培养。HUVSMC与平滑肌细胞培养基购置于STEMCELL technologies Inc.(Canada)。根据前述方法[20]获取HDF,使其在DMEM培养基(Dulbecco’s modification of Eagle’s medium, DMEM;高葡萄糖浓度,以及10%牛胎血清和1%青霉素)中生长。细胞增殖实验的细胞接种密度为每个支架接种50 000个细胞,而实时荧光定量聚合酶链反应(qRT-PCR)实验的细胞接种密度为每个支架接种800 000个细胞,并且无论是单种细胞培养或多种细胞共培养,细胞接种密度均保持恒定。对于两种细胞共培养体系,将HBMSC接种于支架的长方形与正方形部分,将HUVEC接种于支架的三角形与平行四边形部分。HBMSC、HUVEC、HUVSMC和HDF的细胞接种率为1∶1∶1∶1。对于2D培养模型,无论细胞在细胞培养板上进行单独培养或是共培养,其细胞接种密度和接种率与3D培养模型保持一致。所有上述共培养细胞都根据共培养细胞的种类和比例,在混合细胞培养基中进行培养。
2.5. 细胞增殖与黏附性测试
利用CCK-8试剂盒(CCK-8, Beyotime, China)分析细胞增殖情况。将单独培养与共培养的细胞分别接种在支架上1 d、3 d和7 d。利用酶标分析仪(Epoch microplate spectrophotometer, BioTek, USA),检测波长在450 nm处的细胞的吸光度。在1 d后和7 d后,分别观察四种细胞共培养模型中细胞的形态和细胞黏附情况。接种了细胞的支架经过一次磷酸盐缓冲生理盐水(PBS, Sangon Biotech, China)的冲洗后,用2.5%戊二醛固定,随后进行乙醇(体积分数为30%、40%、50%、60%、70%、80%、90%、95%、100%)梯度脱水。
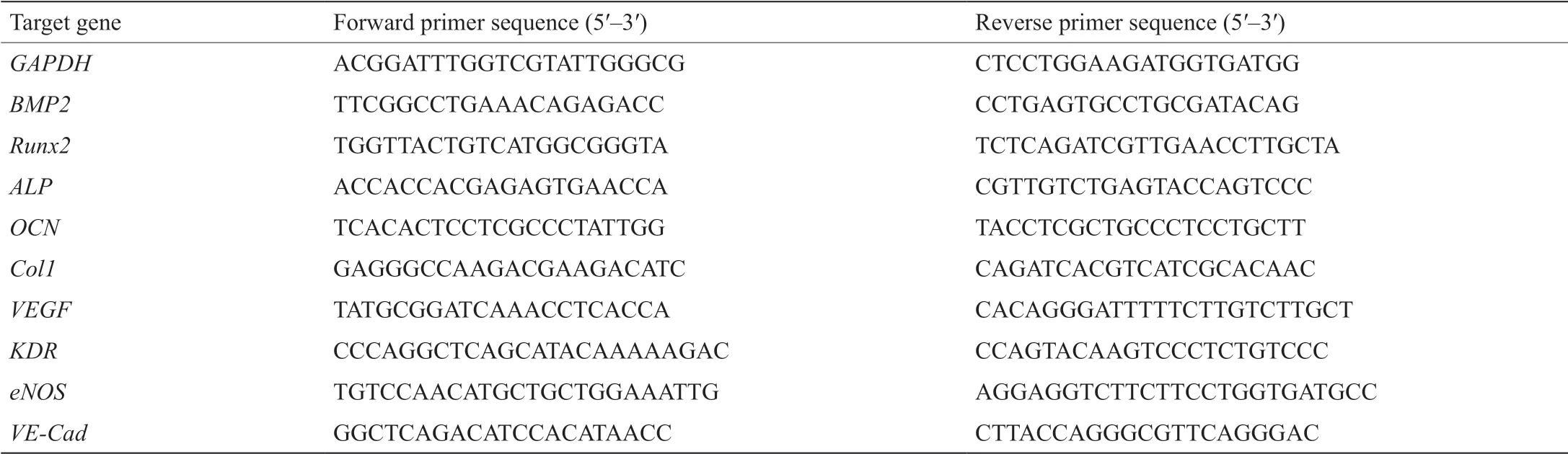
表1 实时荧光定量PCR实验中所用的引物
2.6. 利用磁珠分离HBMSC 和HUVEC
在两种细胞共培养模型中,为了测定每种细胞在另一种细胞激励下的基因表达,利用磁珠分离共培养的细胞。在HBMSC-HUVEC共培养模型中,所有细胞都经过胰蛋白酶消化和离心分离。随后,细胞在PBS和0.1%牛血清蛋白(BSA, Sangon Biotech, China)的缓冲溶液中,利用与CD31抗体分化群抗原结合的磁珠(Invitrogen, USA)进行再悬浮。在4 ℃下经过20 min的培育后,将细胞悬浮液放置在磁铁中2 min,随后将上清液转移到新试管。重复三遍上述的分离过程,以获得高纯度的分离细胞。在此共培养体系中,将分离后的HBMSC和HUVEC分别称为Co-HBMSC和Co-HUVEC。
2.7. 实时荧光定量PCR
利用TRIzol试剂(Invitrogen, USA),经过3 d,提取单独培养的细胞、经过分离后的共培养细胞、未经过分离的共培养细胞中所有的RNA,用以评定上述所有细胞中特定的成骨基因(BMP2、Runx2、ALP、OCN、Col1)和特定的血管生成基因(VEGF、KDR、eNOS、VE-Cad)的mRNA表达水平。利用微量紫外分光光度计(NanoDrop Technologies, Thermo, USA)检测RNA浓度。在生产商的指导下,用PrimeScript RT Master Mix kit(TaKaRa, Japan)制备cDNA。利用SYBR Green qPCR Master Mix(TaKaRa, Japan)进行实时荧光定量PCR实验。利用循环阈值(Ct)进行值比较(2-ΔΔCt), 2-ΔΔCt用于计算细胞的相对基因表达水平。将GAPDH用作管家基因。引物序列如表1所示。
2.8. 统计分析
所有实验数据均利用t检验分析软件进行统计学分析。分析结果以平均值±标准偏差(standard deviation, SD)表示。利用t检验检测组间差异,且认为p< 0.05时组间的差异具有显著性。

图1. 3D打印细胞容器的形态。(a)具有不同微观结构的3D打印β-TCP/HA细胞容器的数码照片;(b)有细胞系的3D细胞容器示意图;(c)没有细胞系的细胞容器示意图;(d)~(f)3D打印细胞容器的正视图、侧视图和后视图;(g)~(j)微孔结构分别为三角形、正方形、平行四边形、长方形的3D打印细胞容器的显微照片(比例尺为1 mm)。图(g)~(j)是图(d)的高倍放大图像。
3. 结果
3.1. 3D 打印细胞容器样支架的特性
图1(a)显示出3D打印技术可以打印具有不同微观结构的细胞容器。图1(b)和(c)展示了一个结合四种不同微孔结构(三角形、正方形、平行四边形和长方形)的集成3D细胞容器的示意图,其中图1(b)有种子细胞,图1(c)没有种子细胞。分别在支架的四个部分中接种不同的细胞,建立一个含四种细胞的非接触式共培养模型。利用基于挤压成型技术的3D打印机打印出几何结构界限清晰的微观结构支架,如图1(d)、(g)~(j)所示。扫描电子显微镜(SEM)的显微照片清楚地显示出,不同微观结构部件的所有的内壁、底部和边界都无缝连接,从而形成密封的细胞容器,如图1(d)~(f)所示。图2展示了细胞容器的XRD分析图,表明容器进行烧结后形成了β-TCP/HA双相支架。
3.2. 单独培养和共培养模型的细胞活性和形态
图3的SEM图像显示了在支架设定部位上共培养的HBMSC、HUVEC、HUVSMC和HDF细胞在第1天和第7天的细胞形态。所有的共培养细胞增殖良好,其中,第1天细胞伸出大量伪足,第7天细胞布满整个支架。图4显示了不同时间段内单独培养和共培养细胞在支架内的细胞增殖情况。结果表明,3D打印支架中非接触式共培养细胞模型在提高细胞活性方面具有显著优势。HBMSC/HUVEC/HUVSMC共培养组和HBMSC/HUVEC/HUVSMC/HDF共培养组在第3天和第7天的增殖率均高于单独培养组。HBMSC/HUVEC/HUVSMC/HDF共培养组的增殖效率最高。
3.3. 3D 共培养模型中HBMSC 和HUVEC 的骨生成和血管生成作用以及细胞间相互作用
为了研究非接触式3D共培养模型对细胞间相互作用的影响,实验应用了HBMSC与HUVEC体外共培养的3D细胞容器模型。共培养3 d后,将两种细胞从细胞容器中分离出来,并检测分离细胞中成骨基因(BMP2、Runx2、ALP、OCN和Col1)和血管生成基因(VEGF、KDR、eNOS、VE-Cad)的表达情况(图5和图6)。总的来说,与2D细胞培养相比,非接触式3D细胞培养系统不管是在单独培养模型还是在非接触式共培养模型中,细胞的成骨基因和血管生成基因的表达均显著上调。更有趣的是,在HBMSC/HUVEC共培养体系中,骨相关基因BMP2主要由Co-HUVEC表达,且3D共培养模型中由Co-HUVEC表达的BMP2明显高于2D共培养模型中Co-HUVEC表达的BMP2。此外,促进血管生成的血管内皮生长因子(VEGF)主要由Co-HBMSC表达,且3D共培养模型中VEGF在Co-HBMSC中的表达量明显高于2D共培养模型。而且,在3D支架中,Co-HBMSC的Runx2、ALP、OCN、Col1因子的含量水平显著提高,而KDR、eNOS、VE-Cad主要由Co-HUVEC表达。
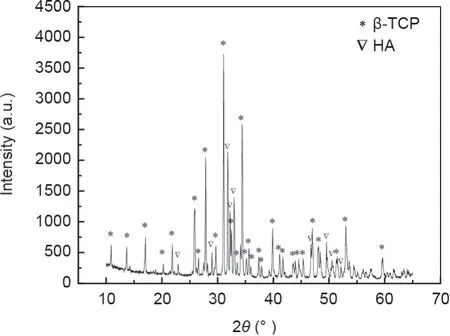
图2. 3D打印的β-TCP/HA双相生物陶瓷支架的XRD分析图。a.u.:任意单位;2θ:散射角。
3.4. 在3D 共培养模型中多细胞共培养的骨生成和血管生成作用
在3D细胞容器中单独培养(HBMSC、HUVEC)和共培养(HBMSC/HUVEC、HBMSC/HUVEC/HUVSMC和HBMSC/HUVEC/HUVSMC/HDF)细胞的骨生成和血管生成标记基因的表达明显高于2D细胞培养板(图7和图8)。与单独培养模式相比,在3D多细胞共培养系统中,共培养模式(包括两种细胞共培养、三种细胞共培养和四种细胞共培养)在增强骨生成和血管生成分化方面均显示出明显的优势。通过在共培养系统中添加HUVSMC和HDF,可显著改善成骨基因Runx2、ALP、OCN和Col1以及血管生成基因VEGF、KDR、eNOS和VE-Cad的表达。3D细胞容器中的非接触式共培养模式(HBMSC/HUVEC/HUVSMC/HDF)表现出最佳的骨生成和血管生成活性。

图3. 在3D打印的β-TCP/HA细胞容器中培养1 d和7 d后,不同孔隙结构中细胞形态的SEM分析。(a)正方形孔隙结构中HBMSC的细胞形态;(b)平行四边形孔隙结构中HUVEC的细胞形态;(c)三角形孔隙结构中HUVSMC的细胞形态;(d)长方形孔隙结构中HDF细胞形态。
当前,还不能成功构建具有复杂结构和功能的组织与器官的原因之一可能是,没有合适的工程化的细胞培养模型可以模拟人体组织的多细胞成分。在3D水平上建立特定组织的多细胞共培养系统对于研究细胞间相互作用以及进一步制备体外工程化的组织至关重要。在过去的几年中,3D共培养系统已被广泛设计并用于模拟细胞的体内生理环境,少数工作集中于将共培养细胞的混合悬浮液接种到均质的多孔支架、胶原蛋白、纤维蛋白或丝凝胶中[21-25]。尽管以前的研究表明,与传统的2D共培养模型相比,在3D微环境中简单地将多种细胞混合在一起可以有效地增强细胞的增殖和分化效应[26],但大多数细胞在体内都以非接触的方式相互交流。因此,组织工程学的一个新策略是开发3D非接触式多细胞共培养容器以实现细胞间的充分交流。
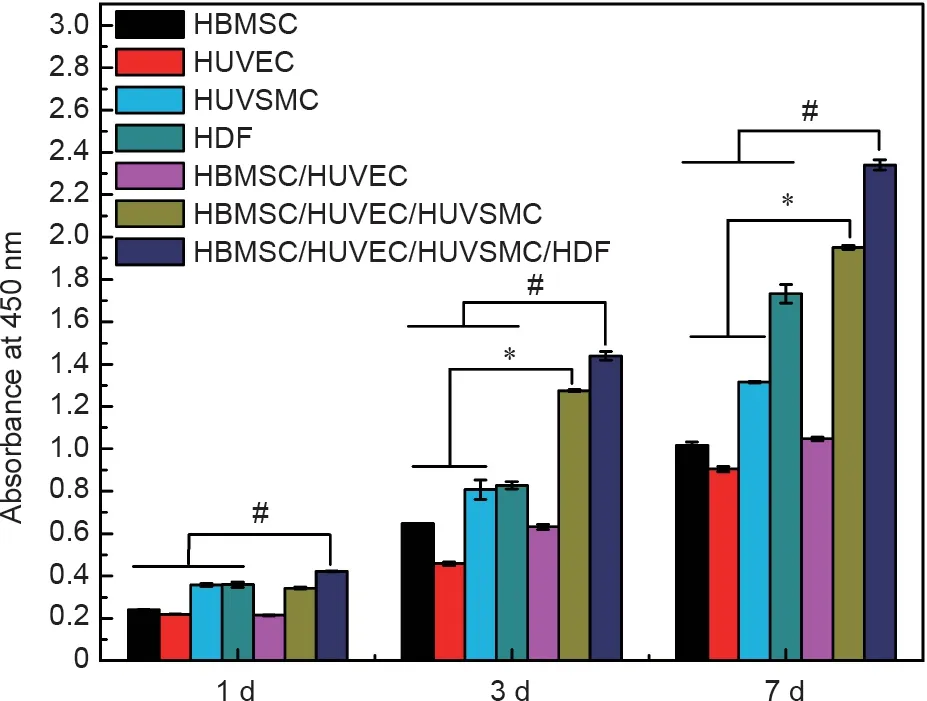
图4. 3D打印的β-TCP/HA细胞容器中的单独培养细胞和共培养细胞分别在第1天、第3天和第7天增殖情况的CCK-8分析。HBMSC、HUVEC、HUVSMC和HDF:3D细胞容器中单独培养的HBMSC、HUVEC、HUVSMC或HDF;HBMSC/HUVEC:HBMSC先接种在3D细胞容器的正方形和长方形微孔中,然后在平行四边形和三角形微孔中与HUVEC共培养;HBMSC/HUVEC/HUVSMC:HBMSC先接种在3D细胞容器的正方形和长方形微孔中,然后在平行四边形微孔中与HUVEC共培养,在三角形微孔中与HUVSMC共培养;HBMSC/HUVEC/HUVSMC/HDF:HBMSC先接种在3D细胞容器的正方形微孔中,然后在平行四边形微孔中与HUVEC共培养,在三角形微孔中与HUVSMC共培养,在长方形微孔中与HDF共培养。*表示HBMSC/HUVEC/HUVSMC共培养组分别与HBMSC、HUVEC、HUVSMC单独培养组之间存在显著差异(p < 0.05);#表示HBMSC/HUVEC/HUVSMC/HDF共培养组分别与HBMSC、HUVEC、HUVSMC、HDF单独培养组之间存在显著差异(p < 0.05,每组n = 6)。
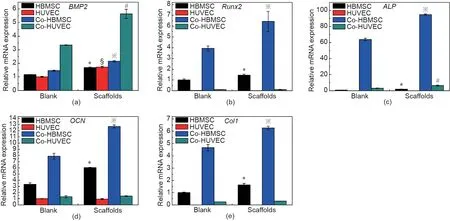
图5. 细胞培养板和3D细胞容器培养的细胞的成骨标记基因BMP2(a)、Runx2(b)、ALP(c)、OCN(d)、Col1(e)的表达。“Blank”指在细胞培养板中培养的细胞,“Scaffolds”指在3D细胞容器中培养的细胞。HBMSC、HUVEC:单独培养的HBMSC或HUVEC;Co-HBMSC:从共培养的HBMSC/HUVEC中分离出的HBMSC;Co-HUVEC:从共培养的HBMSC/HUVEC中分离出的HUVEC。*、§、※和#分别表示β-TCP/HA支架与“Blank”组(每组n = 3)之间的HBMSC、HUVEC、Co-HBMSC和Co-HUVEC的基因表达存在显著差异(p < 0.05)。
尽管制备3D支架的方法有很多,如模具成型法和冰模板法,但是所制备的支架的微孔结构并不是最佳的。众所周知,3D打印是一种可有效制备具有各种孔径和形态的复杂结构支架的首选技术[27-31]。在本研究中,我们使用基于挤压的3D打印方法成功地制备出具有四种不同微孔结构(包括三角形、正方形、平行四边形和长方形)的β-TCP/HA复合支架(图1)。先前的研究发现,在接种细胞的过程中,大量的细胞从3D多孔支架中泄漏出来。本研究制备了一个细胞容器,其中,支架不同微孔结构之间相连的内壁、底部和边界是封闭的且无缝连接。这种方法可以精确控制细胞的接种密度和比例,且不会造成细胞悬浮液的损失。据报道,支架的多孔结构和孔形态对细胞行为(如细胞黏附、增殖)以及营养传输和组织生长影响很大[32-35]。本研究发现,具有不同微孔结构的3D非接触式细胞容器不仅可以促进单一类型细胞增殖,而且可以显著促进共培养的细胞增殖。特别是,与单一细胞类型相比,3D支架共培养的三种或四种细胞在刺激细胞增殖方面显示出显著优势,这表明在3D非接触式细胞容器中发生了细胞间相互作用和通讯交流。支架调节的细胞增殖可能存在多种潜在的分子机制,目前,我们倾向于认为3D细胞容器样支架一方面可能会通过结构效应影响细胞骨架,从而激活细胞增殖相关的信号通路并促进细胞增殖,另一方面可能会通过放大共培养细胞的旁分泌作用,加强细胞增殖。当然,这些假设需要进一步确认。
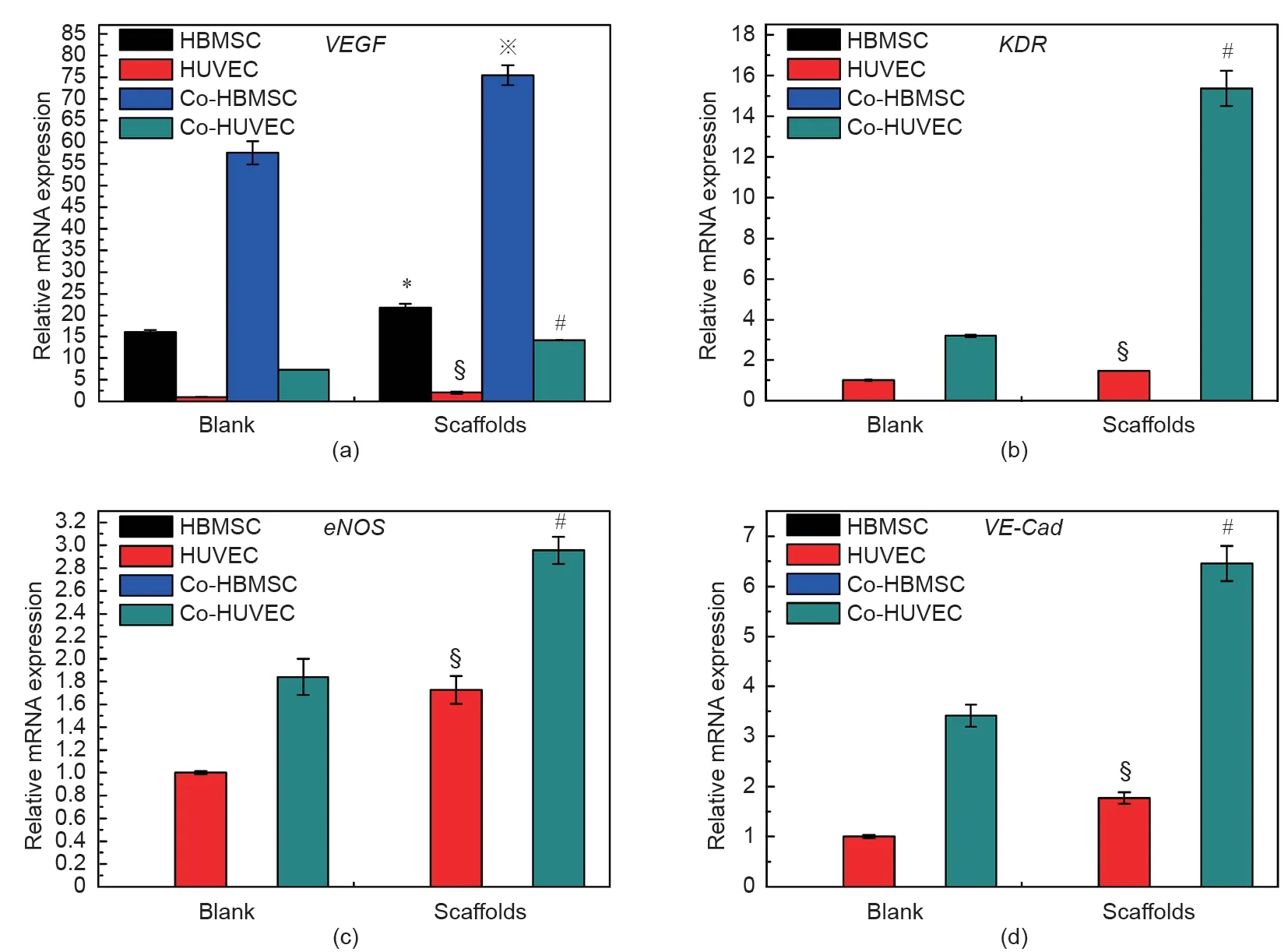
图6. 由细胞培养板和3D细胞容器培养的细胞表达的血管生成标记基因VEGF(a)、KDR(b)、eNOS(c)、VE-Cad(d)。“Blank”指在细胞培养板中培养的细胞,“Scaffolds”指在3D细胞容器中培养的细胞。HBMSC、HUVEC:单独培养的HBMSC或HUVEC;Co-HBMSC:从共培养的HBMSC/HUVEC中分离出的HBMSC;Co-HUVEC:从共培养的HBMSC/HUVEC中分离出的HUVEC。*、§、※、#分别表示β-TCP/HA支架与“Blank”组(每组n = 3)之间的HBMSC、HUVEC、Co-HBMSC和Co-HUVEC的基因表达存在显著差异(p < 0.05)。
为了阐明3D细胞容器对细胞间通信的影响,我们首先选择了一个相对简单的含有HBMSC和HUVEC的两种细胞的共培养系统进行研究。先前,科研人员对2D直接接触式HBMSC/HUVEC共培养系统的研究表明,HBMSC分泌的血管内皮生长因子VEGF促进了HUVEC中KDR的活化,从而进一步增强了BMP2和eNOS的表达,驱动了骨生成和血管生成[12]。我们的研究表明,在基于支架的3D间接共培养系统中,HBMSC和HUVEC在骨生成和血管生成中的协同作用得到了放大,其特征与2D共培养模型相比,从3D共培养模型中分离的共培养细胞的成骨分化和成血管分化相关基因的表达显著上调。有趣的是,我们的实验表明,血管内皮生长因子VEGF主要由Co-HBMSC表达,并且Co-HBMSC在3D共培养模型中的表达明显高于其在2D共培养模型中的表达。同时,共培养的HUVEC在3D细胞容器中的VEGF受体(如KDR)表达显著增强。另外,3D支架中的Co-HUVEC显示出血管生成基因,如eNOS和VE-Cad更高比例的上调。据报道,与2D基底相比,在3D基底中共培养HBMSC和HUVEC时,HBMSC可能会通过对微孔结构敏感的旁分泌作用促进血管生成[36]。因此,有理由推测,与2D细胞培养板相比,具有3D多孔结构的细胞容器将增强共培养物的血管生成作用,这可能是因为它会放大共培养系统的旁分泌作用。除VEGF外,实验还发现另一种重要的生长因子,即BMP2在骨再生的早期阶段起着重要的作用[37,38]。有趣的是,我们的结果发现BMP2主要由Co-HUVEC表达,并且Co-HUVEC在3D共培养模型中表达的BMP2明显高于在2D共培养模型中表达的BMP2。据报道,HUVEC分泌的BMP2可以调节HBMSC的骨生成作用[12]。我们的研究结果还表明,3D支架中的Co-HBMSC显示出更高的成骨基因(如Runx2、ALP、OCN和Col1)上调。根据这些发现,在3D水平的HBMSC/HUVEC共培养系统中,Co-HBMSC表达的VEGF可以作用于Co-HUVEC:一方面,它激活其表面VEGF受体KDR,促进下游基因,如eNOS和VE-Cad在Co-HUVEC中的表达,从而驱动血管生成;另一方面,它刺激Co-HUVEC中BMP2的表达,以促进Co-HBMSC中下游基因,如Runx2、ALP、OCN和Col1的表达,从而促进骨生成。我们的结果表明,制备得到的3D细胞容器通过旁分泌途径为细胞间相互作用和通讯提供了良好的3D环境。
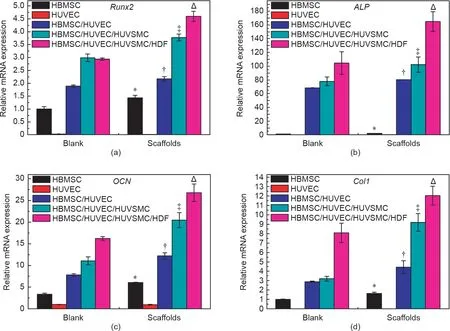
图7. 在单独培养系统或多细胞共培养系统中,由细胞培养板和3D细胞容器培养的细胞表达的成骨基因Runx2(a)、ALP(b)、OCN(c)和Col1(d)。“Blank”指在细胞培养板中培养的细胞,“Scaffolds”指在3D细胞容器中培养的细胞。HBMSC、HUVEC:单独培养的HBMSC或HUVEC;HBMSC/HUVEC:HBMSC和HUVEC两种细胞共培养系统;HBMSC/HUVEC/HUVSMC:HBMSC、HUVEC和HUVSMC三种细胞共培养系统;HBMSC/HUVEC/HUVSMC/HDF:HBMSC、HUVEC、HUVSMC和HDF四种细胞共培养系统。*、†、‡和Δ分别表示在β-TCP/HA支架和“空白”组(每组n = 3)之间,HBMSC、HBMSC/HUVEC、HBMSC/HUVEC/HUVSMC和HBMSC/HUVEC/HUVSMC/HDF的基因表达有显著差异(p < 0.05)。
在过去的几十年中,用于增强血管生成和骨生成作用的生长因子已被广泛用于骨组织工程,并且许多研究报道称,在组织工程支架中添加生长因子BMP2和VEGF可以增强生物材料的成骨和成血管活性[39-41]。然而,由于外源性生长因子存在活性维持和可控释放等方面的挑战[42,43],因此,其临床应用受到了限制。在本研究中,通过增加共培养细胞中BMP2和VEGF的表达,3D细胞容器激活了骨组织再生过程中骨生成和血管生成两大主要生物学事件。该结果表明,工程化的3D共培养模型创造了一个细胞可以相互交流,并进一步分泌内源性生长因子的微环境,以增强组织再生。我们的结果为采用组织工程技术构建组织和器官提供了新的策略。
由于骨生成是一种血管依赖的过程,因此血管生成在骨修复和骨骼发育中起着关键作用[44,45]。除内皮细胞外,平滑肌细胞和成纤维细胞是血管壁的主要细胞,这些细胞以更复杂的自分泌和旁分泌方式相互作用以维持血管的稳态[46-48]。在本研究中,我们将平滑肌细胞和成纤维细胞添加到HBMSC/HUVEC两种细胞的共培养系统中,并构建了含三种细胞和四种细胞的共培养系统,以研究3D水平的多细胞共培养模式对人体骨生成和血管生成的影响。结果表明,与单细胞培养和两种细胞共培养模式相比,三种细胞和四种细胞共培养模式在增强成骨分化和成血管分化方面均显示出明显的优势。通过向共培养系统中添加HUVSMC和HDF,成骨分化相关基因Runx2、ALP、OCN和Col1的表达以及成血管分化相关基因VEGF、KDR、eNOS和VE-Cad的表达显著改善。此外,3D细胞容器中的四种细胞非接触式共培养模型(HBMSC/HUVEC/HUVSMC/HDF)表现出最佳的骨生成和血管生成活性。我们的结果表明,基于3D支架的多细胞非接触式共培养系统的开发,允许构建多种生理组织的细胞共培养物,这对于模拟体内组织微环境和进一步诱导组织再生非常有帮助。

图8. 在单独培养系统或共培养系统中,由细胞培养板和3D细胞容器培养的细胞表达的血管生成基因VEGF(a)、KDR(b)、eNOS(c)和VECad(d)。“Blank”指在细胞培养板中培养的细胞,“Scaffolds”指在3D细胞容器中培养的细胞。HBMSC、HUVEC:单独培养的HBMSC或HUVEC;HBMSC/HUVEC:HBMSC和HUVEC两种细胞共培养系统;HBMSC/HUVEC/HUVSMC:HBMSC、HUVEC和HUVSMC三种细胞共培养系统;HBMSC/HUVEC/HUVSMC/HDF:HBMSC、HUVEC、HUVSMC和HDF四种细胞共培养系统。*、§、†、‡和Δ分别表示在β-TCP/HA支架和“空白”组(每组n = 3)之间,HBMSC、HUVEC、HBMSC/HUVEC、HBMSC/HUVEC/HUVSMC和HBMSC/HUVEC/HUVSMC/HDF的基因表达有显著差异(p < 0.05)。
5. 结论
在本研究中,我们通过3D打印技术成功制备出具有四种不同微孔结构的细胞容器样β-TCP/HA支架,包括三角形、正方形、平行四边形和长方形。将该支架作为细胞载体,我们进一步构建了由HBMSC、HUVEC、HUVSMC和HDF组成的且具有空间受控分布的工程化的3D细胞共培养模型,以模拟人体骨组织的细胞微环境。与2D平面培养的细胞相比,3D打印的细胞容器样支架在共培养模式下,在增强细胞增殖以及成骨分化和成血管分化方面显示出明显优势。在两种细胞共培养模式下,HBMSC与HUVEC之间的相互作用表明,具有不同多孔结构的3D细胞容器可通过放大共培养系统的旁分泌效应来增强共培养体系的血管生成和骨生成作用。其中,由支架刺激共培养的细胞表达VEGF和BMP2,在促进成骨分化和成血管分化方面起关键作用。此外,3D细胞容器中的四种细胞非接触式共培养模式(HBMSC/HUVEC/HUVSMC/HDF)表现出最佳的骨生成和血管生成活性。我们的研究表明,开发基于支架的多细胞非接触式共培养系统是实现组织再生的新方向。
致谢
本研究得到了国家重点研究发展计划(2016YFB0700803)、国家自然科学基金(51761135103)、中国科学院科学技术与创新跨学科合作团队计划(JCTD-2018-13)、中国科学院STS计划(KFJ-STS-QYZD-092)、上海市科学技术委员会(17441903700)和德国研究基金会(DFG, GE1133/24-1)的支持。
