医用增材制造领域中的微流控技术
2020-04-12王洁邵长敏王月桐孙凌云赵远锦
王洁,邵长敏,王月桐,孙凌云*,赵远锦,*
a Department of Rheumatology and Immunology, Institute of Translational Medicine, The Affiliated Drum Tower Hospital of Nanjing University Medical School, Nanjing 210008, China
b College of Artificial Intelligence, Nanjing Agricultural University, Nanjing 210031, China
c State Key Laboratory of Bioelectronics, School of Biological Science and Medical Engineering, Southeast University, Nanjing 210096, China
增材制造(additive manufacturing),又被称为固体自由成型制造。与减材制造截然不同,增材制造是以计算机三维(3D)模型数据为蓝本、以逐层叠加为主要制造方式的三维立体结构构建手段[1,2]。自20世纪80年代第一个3D结构通过逐层叠加方式成功构建到现在,增材制造已经成为工业生产和科学研究领域中的一种新奇且实用的工具[3,4]。基于增材制造的方式,金属、陶瓷、聚合物、生物材料和有机物化合物等具有不同制造特性的材料可被用于构建复杂的3D结构[5-8],且在食品、制药、医学和机械加工等领域得到广泛应用[8-11]。由于增材制造具有成本低、可定制化和结构构建快速的加工特性,微流控、电喷、3D打印、熔融沉积制造和选择性激光烧结等成型制造技术体系在医用增材制造领域得到迅速构建[12-15],有效推动了医疗器械、医学假体和临床移植物的发展。
微流控(microfluidic)是一种可在微尺寸通道(几十到几百微米)中控制微量流体(通常为10-9~10-18L)的技术[16-20]。由于微流控技术对流体精准控制的特性,其在构建复杂结构的微流控液滴/纤维方面的应用被寄予厚望[21-24]。通过对液滴/纤维相关元件的装配、堆叠,可以构建由不同结构和材料组成的3D结构。此外,选择在液滴/纤维中包埋、负载细胞还可以构建具有生物相容性的细胞结构[25-27]。近年来,高通量、结构和尺寸控制精准等优势使微流控技术在医用增材制造领域显露头角,且已被应用于药物开发、组织工程和器官芯片的构建[28-30]。在此背景下,对微流控技术在医用增材制造领域的应用现状进行全面综述,对具有不同学科背景的研究者来说是必要的。
本文综述了微流控技术在医用增材制造领域的最新研究进展。首先,阐述了基于微流控技术的单、双和多重乳液微载体的制作方式,以及不同结构微纤维的制备手段及其编织、堆叠和缠绕;其次,详细介绍了微载体、微纤维在医用增材制造领域的不同应用,如细胞定向、细胞3D培养、体外组织构建和细胞治疗等;最后,讨论了基于微流控技术的医用增材制造未来发展面临的挑战与应用前景。
2. 微流控液滴在医用增材制造领域的应用
微流控技术是一种在微尺寸通道中对流体进行系统操作和控制的技术。自20世纪70年代微流控技术问世以来,该多学科技术迅速发展,并逐渐渗透到生物学、微电子学、医学、材料科学、化学和机械工程等诸多领域[31-36]。微流控系统中的流体具有高效的质-热传递、黏性相对于惯性的绝对优势以及显著的表面效应的特点,使得微流控系统对流体和流体界面的控制具有重要的现实意义。此外,微流控系统的高度集成性促进了多相流体的共轴流动和相互作用,从而能够构建复杂的流体体系[27,33,37,38]。因此,微流控技术被认为是实现微尺寸复杂形貌和结构的有效方法。
2.1. 液滴微流控的成型机理
作为微流控技术的重要分支,液滴微流控在其通道中可引入不相溶的多相(分散相和连续相)流体,并将流体分解成离散的液滴[21,39]。液滴微流控生成的液滴具有分散性好、体积小且大小可控、制备条件稳定、液滴环境密闭无污染等优点。因此,微液滴可以作为理想的模板或微反应器,在材料制备、化学合成、细胞培养等方面具有重要的应用价值。
多种材料可用于制造微流控芯片,如玻璃、晶体硅、石英、聚二甲基硅氧烷(PDMS)、塑料等[40-43]。在上述材料中,最常用的是PDMS和玻璃毛细管,如图 1(a)、(b)所示[42,43]。1998年,Whitesides制备了第一个PDMS微流控芯片 [44]。PDMS器件的制作通常需要以下步骤:首先,通过标准接触光刻技术[图1(a-i)~(a-iii)]在光刻胶中构建正结构母版;其次,将混合的PDMS倾倒入母版生成有孔道的复制版[图1(a-iv)、(av)];最后,PDMS复制版黏合在平坦的基板上[图1(avi)]。PDMS器件的低成本、易成型、良好的生物相容性和透明性等优点使其得到广泛应用。然而,它们的二维(2D)特性、有机溶剂中的溶胀和形变效应以及高压耐受性不足限制了其在微流控技术中的应用。因此,具有3D几何形状和极好的耐溶剂性的玻璃毛细管被引入微流控装置的制作程序[42]。这些装置由具有易改变通道表面润湿性的玻璃毛细管共轴组装而成[图1(b)]。通过组装一系列玻璃毛细管[图1(b-ii)、(b-iii)]或使用阵列毛细管[图1(b-i)],可以获得具有单、双和多重乳液或结构更复杂(如多个组分)的液滴。虽然具有以上优点,但这种玻璃装置在某些情况下也会受到限制。例如,手工制作玻璃毛细管装置限制了它们的单次生产量。因此,应根据不同的情况选择不同的微流控器件。
在微流控通道中,互不相溶的流体在界面处交汇,并在流体动力作用下形成液滴。液滴的大小、速度和产生频率受流速、几何参数和流体性质影响。基于通道几何形状和流体结构,现已开发了不同的液滴形成技术,这些形成装置可分为阶梯状、横流、共流、几何流动聚焦等[18,27,45]。图1(c)[45]展示了用于生成液滴的典型微流体的几何结构示意图。通过毛细管压力的急剧变化,阶梯状的几何结构导致通道限制的改变从而产生均匀的液滴。在界面张力的驱动下,分散相在通道末端断裂成液滴。在横流装置中(通常表现为T形接口装置),两种流体以0~180°角度分流,并在交界处形成界面。分散相在剪切力作用下进入连续相通道,随后由于梯度压力而破裂成液滴。共流是通过一组同轴通道实现的,这些通道可以是2D(PDMS)或3D(玻璃毛细管)同轴。与共流几何结构相似,两相在流动聚焦芯片中通过一个狭窄区域同轴流动。由于收缩孔中剪切聚焦的作用,液滴的尺寸比同流结构的小。
2.2. 单乳液和多组分液滴
基于不同的微流控液滴模板,研究人员对具有可设计尺寸、结构和微环境的细胞微载体进行了研究。简要来说,通过将生物相容性材料注入微流控通道,可以生成单分散的单乳液,随后可聚合以获得用于细胞培养的微载体。Liu等[46]通过在单液滴模板中分散二氧化硅纳米粒子,开发出了一种尺寸可控、生物相容性好的新型光子晶体(PC)微载体。与2D培养相比,微载体表面培养的细胞更具有3D的形态[图2(a-i)],这是由微载体上悬浮培养细胞的特点引起的。此外,如图2(a-ii)所示,Zheng等[47]通过在表面修饰适体探针,开发了用于捕捉、检测和释放多种循环肿瘤细胞(CTC)功能的PC微载体。
除二氧化硅外,水凝胶材料也被广泛用于制造细胞微载体,如海藻酸钠[48]、明胶[28]、胶原蛋白[49]、聚乙二醇[50]和壳聚糖[51]。这些微载体可以通过离子交联、温度诱导凝胶化和冷冻以及紫外线(UV)照射等多种方法固化。微载体的尺寸、形状、孔隙率和机械性能可以通过调节微流控通道尺寸、流速、前体物浓度和交联密度来调节。Segura等[52]利用微流控方法制备了由多臂聚(乙烯)乙二醇-乙烯基砜(PEG-VS)和细胞黏附肽组成的可注射微载体[图2(b)]。细胞黏附在微载体表面,并具有高细胞活力和快速增殖能力。值得注意的是,微载体可以组装成具有所需形状的微孔粒子支架。
细胞除被接种在微载体的表面外,还可以在水凝胶前体乳化和聚合之前将其包埋。Garcia等[53]利用微流控技术制造了尺寸、渗透率和细胞微环境可控的微腔[图2(c)]。他们证实了微载体可提高相关临床细胞(如人胰岛细胞和人间充质干细胞)的活性。近年来,作为细胞微载体的响应性水凝胶引起了广泛关注。例如,Zhao等[54]利用近红外(NIR)光响应水凝胶开发出细胞可控培养的微载体系统,如图2(d)所示。水凝胶前体物中的氧化石墨烯可以吸收近红外光谱并将其转化为热量,从而导致温度响应水凝胶的收缩和微载体孔中捕获细胞的释放。微载体释放的细胞具有与传统消化细胞相似的活性,而微载体支架在释放前可保护细胞免受免疫系统的伤害。这些特点促进了微载体在小鼠肿瘤模型构建中的应用。
用多个平行通道代替单乳液微流控装置的分散通道,可以制备多室液滴。不相溶的分散相相互接触,同时被连续相乳化。由于微流体中雷诺数(Re)较低,流体保持层流状态。因此,液滴形成过程中的对流流动不会导致分散相的混合,而分散相的混合是以流体间扩散为主。因此,当流体间扩散速度较慢时,会出现明显的界面和隔室。基于这些理论,Weitz等[55]通过应用多个注入通道制备多室微载体[图3(a)]。海藻酸钙(Ca-Alg)快速凝胶化可用于制备微载体间的明显界面。有学者认为这项技术可以作为一种在单细胞水平上,研究细胞间相互作用的新方法。微流控技术可以制备出结构复杂的多室微载体。Zhao等[56]应用毛细管阵列微流控技术,在中心生成具有多种结构和大孔的细胞微载体,如图3(b)所示。Zhao等利用微纤维阵列首次制备出多室液滴的微纤维。通过去除聚合液滴中的微纤维,相应地开发了具有大孔的多室微载体。与没有大孔的微载体相比,大孔微载体在细胞培养过程中可提供充足的营养。
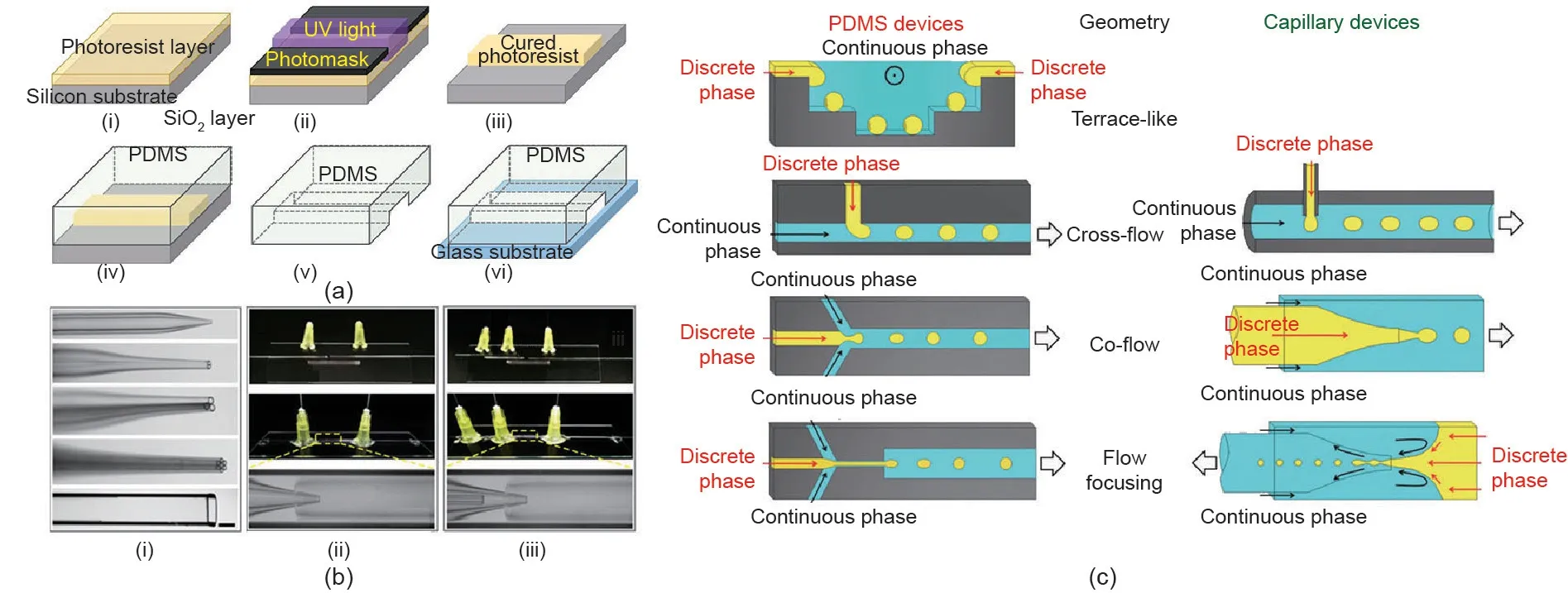
图1. 微流控装置和液滴制备过程。(a)PDMS微流控器件的制作步骤[43];(b)玻璃毛细管微流控芯片的组装[42];(c)在PDMS和玻璃毛细管芯片中制备不同几何结构的微流控液滴[45]。
2.3. 双乳液和多重乳液液滴
虽然由单乳液液滴作为模板的细胞微载体具有许多优点,但过于简化的结构限制了其在某些情况下的应用。因此,能够制造出结构更复杂的微载体尤为重要。通过多级乳化,可以根据需要获得双乳液或多重乳液液滴。
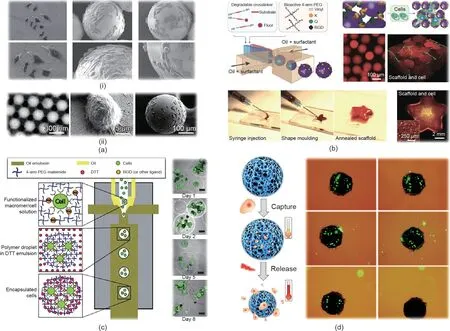
图2. 由单一乳液模板制备的微载体。(a)PC微载体[46-47];(b)PEG-VS微载体[52];(c)具有可控细胞微环境的微载体[53];(d)NIR光响应水凝胶微载体[54]。DTT:二硫苏糖醇;RGD:海藻酸钠-精氨酸-甘氨酸-天冬氨酸。
在单乳液液滴形成的基础上,对混合液进行二次乳化,可以制备出双乳液液滴。双乳液是通过双重共流毛细管装置实现的,如图4(a)[57]所示。首先,在内毛细管的末端产生油包水乳液;然后将混合液乳化成水包油双乳液。基于双乳液,可制备具有内外连通结构的多孔微载体和生物聚合物基质填料,用于3D细胞培养。多孔结构不仅能保护细胞在培养过程中不受剪切力的影响,而且为多个细胞球体的形成提供了良好的环境。除了在微载体上接种,细胞还可以被封装在具有核-壳结构的水凝胶微载体中,这种微载体是基于双乳液液滴制备的。如图4(b)[58]所示,癌细胞被包埋在微载体的核心中,以获得无血管的微肿瘤。这些微载体与基质细胞组装成3D血管化肿瘤,用于肿瘤研究。与普通水凝胶微载体相比,核-壳微载体具有更好的细胞包埋性。图4(c)[59]为在固体水凝胶微载体中培养的胰岛细胞与在核-壳微载体中培养的胰岛细胞的比较,结果表明后者具有良好的细胞包埋性以及免疫保护作用。除了固态的水凝胶核心,核-壳微载体的核心也可以是液体。Kang等[60]将细胞悬浮液与培养基一起注入核心,同时利用海藻酸盐溶液形成微载体的外壳。研究人员发现,在核-壳微载体的核心中培养的细胞比在固体水凝胶微载体中培养的细胞更容易聚集[图4(d)],这对单个胚胎体的形成是有利的。
与双乳液的形成类似,多重乳液液滴可以通过多液滴反应器或一步乳化法制备。图4(e)[60]为具有三分支的三重微载体的微流控装置。Kang等[60]利用这一设备制备微载体,其核心是干细胞,周围层是分化细胞,外壳用于负载荧光标记、磁操控的多功能微珠或药物递送。
3. 微流控纤维在医用增材制造领域的应用
3.1. 微流控纺丝
微流控纺丝技术被用于构造具有不同形态、组分和结构的纤维状组织,其在芯片设计和操控方面与上文提到的液体微流控技术类似[19,42,61-64]。如图5(a)[62]所示,用于生成微纤维的微流控芯片中的流体的流动方式主要有交叉流、聚合流和并行流三种。其中,并行流是稳定构建纤维材料的一种温和且应用较为广泛的方式。在并行流过程中,内相(核)和外相(壳)两组分流体通过两个共轴通道在微流控芯片的连接处交汇,流体的黏度、界面张力等参数,以及设备的几何结构都会影响流体在芯片通道中的流动。由于流体在通道内的雷诺数较小,流体在通道内将始终保持层流状态而无湍流情况发生,内相和外相流体受制于两相界面处的缓慢扩散。基于流体动力学,两相流体形成同轴结构,于通道内原位固化并经出口挤出成纤维。
用于构建微流控纤维的材料种类繁多,大致可划分为自然提取材料和人工合成材料[65-71]。自然提取材料主要由海藻酸钠、透明质酸、壳聚糖和琼脂糖等多糖以及胶原蛋白、明胶和纤维蛋白等蛋白质组成。基于这类材料的物理/化学交联,可形成具有水凝胶网络结构的高度生物相容微纤维。虽然自然提取材料具有良好的生物相容性,但是机械强度低、改性困难等材料固性在一定程度上限制了其在微流控技术中的应用。相比之下,人工合成材料是高度工程化的,可以通过对其改性来系统地研究材料结构、功能和性能之间的关系,诸如聚乙二醇二甲基丙烯酸酯(PEGDA)、聚乳酸-羟乙酸共聚物(PLGA)和聚(N-异丙基丙烯酰胺)(pNIPAM)此类典型的人工合成材料,这些材料在固化后可被用于微流控纺丝技术制备功能性纤维。
不同的纤维材料对应不同的固化成型方式,如图5(b)[72]所示的光聚合、离子交联和溶剂交换。在光聚合过程中[图5(b-i)],光聚物和光引发剂作为核流被挤出,并在紫外线的照射下诱导聚合以形成纤维的骨架结构,而鞘流则作为润滑剂以加速固化后纤维的挤出。虽然光聚合方式具有简单、快捷的聚合特性,然而基于光聚合方式的微纤维材料的应用受限于其潜在的细胞毒性及缺乏生物降解性。对离子交联来说,最具代表性的是海藻酸盐和Ca2+之间的交联反应[图5(b-ii)]。在此过程中,海藻酸盐和Ca2+分别作为核流和鞘流被注射进微流控芯片通道,并在两相流体交汇的瞬间即发生交联固化。与离子交联聚合类似,在溶剂交换法中,核流和鞘流组分分别被替换成溶剂相和非溶剂相流体[图5(b-iii)]。值得一提的是,基于扩散效应的组分交换也可诱导微流控内相的固化以生成微纤维,这种方式在基于PLGA这种聚合材料的微纤维生成中应用较广。利用微流控技术可以连续生成不同形状、组成和结构的微纤维,其小尺寸、高比表面积、多孔水凝胶结构和良好的生物相容性使微纤维成为理想的细胞培养平台。
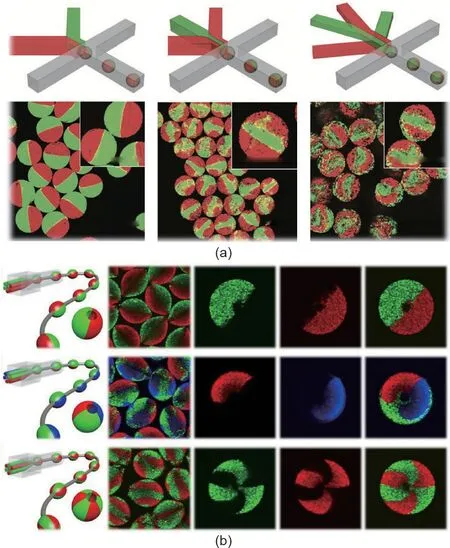
图3. 不同微流控装置制备多室微载体。(a)PDMS芯片[55];(b)玻璃毛细管芯片[56]。
3.2. 微纤维的特殊形态和结构
基于微流控技术,微纤维以一种温和且连续的方式生成,并展现出高比表面积、生产方式灵活且可重复,以及形态和组分可调控的独特优势。因此,负载细胞的微纤维也在细胞研究和组织工程领域被寄予厚望[73,74]。迄今为止,构建具有特殊形态和结构的细胞负载微纤维受到越来越多的关注和研究。Zhao等[75]利用玻璃毛细管微流控装置成功构建了具有可伸缩性的螺旋型海藻酸盐纤维[图6(a)]。基于流体聚焦原理和扩散效应,海藻酸钙微纤维在原位生成并通过离子交联快速成型。此外,研究发现,改变装置内流体的流动速率可在微纤维收集装置中观察到微纤维的4种不同的流动形态(阻塞型、波浪型、直线型和螺旋型)[76]。如图6(b)所示,通过扩大内相流与外相流流速的比值,可将该理论进一步应用于螺旋型微纤维的制备[76]。由于两相流动速率的差异,使得通道内流体剪切力不稳定,从而进一步导致微纤维形态转变的现象发生。这种新式的螺旋型微纤维被广泛用于心肌细胞力学传感器的构建,并在心脏器官芯片研究领域起着关键的作用。
除螺旋结构外,还可以针对微流控通道进行改进和修饰以构建形态和结构更为复杂的微纤维。Seki等[77]设计了一种微流控装置,该装置由三通道入口网络联合一个平头微喷管构成,负载/不负载细胞的海藻酸钠的溶液首先被注入多通道网络,然后通过特殊的平头微喷管组合在一起,再一同被挤出形成片层状条带微纤维[图6(c)] [77]。肝癌细胞和成纤维细胞被包埋于这种片层状微纤维中,用于模拟肝脏的微结构。如图6(d)所示,Lee等[78]通过一个计算机控制的气动阀单独控制微流控装置的输入端,可数控编码生成连续、平行或者混合体系的海藻酸盐微纤维。此外,研究人员还利用带有沟槽的柱形毛细管成功构建了表面带有沟槽结构的管状纤维[图6(e)] [78],且沟槽结构基于通道几何特性和流速等参数高度可控,随后这种表面带有沟槽结构的微纤维被证实有助于神经元细胞的定向排列。除上述两种具有不同形态、结构和化学性质的微纤维外,还可以通过微流控系统交替控制流体相的流动行为以形成串珠型纤维。基于该理论,Zhao等[79]将微纳纺丝技术和材料乳化效应进行了巧妙的结合,生成了一种液滴串联纤维的复合结构,这给串珠型微纤维的生成提供了实例模板[图6(f)]。一些研究人员还采用甲基丙烯酸化明胶(GelMA)等光聚物替代乳化效应以在微纤维上形成串珠,用于3D细胞培养。此外,其他设计也被用于生产串珠型微纤维,如将气泡和液滴包埋进海藻酸盐微纤维[78,80]。
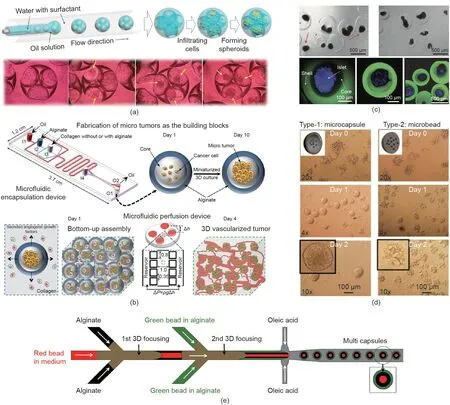
图4. 以双乳液和多重乳液液滴为模板构建的微载体。(a)多孔微载体[57];(b)具有核-壳结构的水凝胶微载体[58];(c)具有改进的细胞封装的核-壳微载体[59];(d)具有液体内核的微载体[60];(e)三重微载体[60]。
除上文主要讨论的实心微纤维外,一些具有核-壳结构、中空结构和多组分结构的微纤维也备受关注。如图7(a)所示,Zhao等[75,81]对常规的微纤维纺丝毛细管装置进行改进,使流体在其中具有多个输入端和分层同步输出端,最终得到具有复杂结构的微纤维。其中,以内相海藻酸盐通道为基础,再向其中插入一个或数个CaCl2毛细管通道[图7(a-i)]。当海藻酸盐相与CaCl2相接触时,海藻酸盐在内、外界面处发生瞬时交联,随后具有单个或多个中空结构的微纤维被连续挤出。若想进一步生成带有多个组分结构的微纤维,则需要用多管道毛细管代替原始单通道作为输入端通道[图7(a-ii)],在此过程中,位于海藻酸盐溶液中的多相流体被同步注入毛细管并在原位固化。由于流体的雷诺数较低,层流效应在微流控通道内发生,流体间无明显的扩散混合现象发生,使得微纤维中不同组分间的界面线清晰明显。有趣的是,选择将中空纤维微流控装置和多组分微流控装置结合使用后,可得到具有中空和多组分两种结构性质的微纤维[图7(a-iii)]。在微流控技术领域中,制作具有特殊形态和结构的微纤维的装置并不局限于玻璃毛细管,PDMS微流控芯片也是一种被广泛应用的微流控装置。如图7(b)所示,Qin等[82]在一项研究中开发了一种创新的PDMS微流控芯片,该种芯片具有分层、多层和微通道的结构,可制备多孔、多组分的微流控纤维。这种芯片由内层流体相、中层水凝胶支架相和外层壳相三层结构组成,与玻璃毛细管微流控装置相比,PDMS微流控芯片具有较好的稳定性和可重复性。
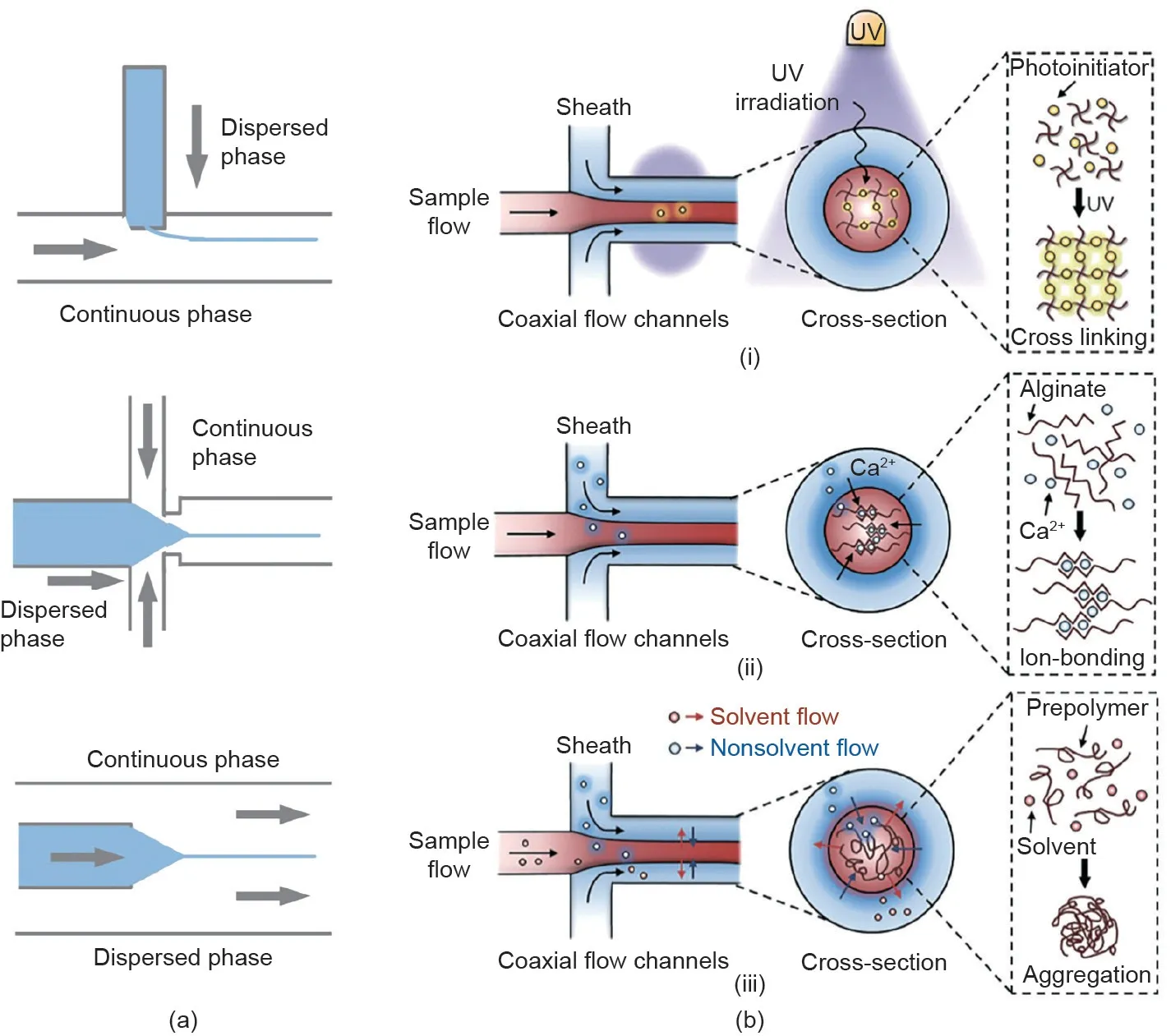
图5. 微流控纺丝技术与微纤维的聚合。(a)微流控芯片中流体的不同流动方式[62];(b)各相流体的三种聚合方式[72]。
3.3. 微纤维集成的3D 细胞结构
得益于微纤维稳定、易操控以及生成方式平缓和良好的生物相容性,负载细胞的微纤维被通过各种方式进行体外组装成3D细胞结构。Fukuda等[83]将磁性纳米颗粒包埋入微纤维,然后在磁场的作用下将微纤维聚集在支撑模型中,以实现3D结构[图8(a)]。这种组装方法对负载细胞的损伤可以忽略不计。此外,Lee等[84]利用微流控纺丝技术成功制备了纯壳聚糖基微纤维,然后使用X-Y轴可调的缠绕器将微纤维缠绕成3D结构[图8(b)]。微纤维中负载的肝癌细胞经一段时间培养后,自组装成球状体并具有较高水平的肝脏功能特异性表达。Juncker等[85]开发了基于微流控直写技术(MFDW)的3D细胞结构搭建技术,将固化的海藻酸盐微纤维从受电机控制的微流控喷头中挤出,在载物台上一层层堆积形成特定的3D结构[图8(c)] [85]。Takeuchi等[86]设计了一种实验室级别的微流控编织机[图8(d)],该设备以负载细胞的功能性纤维为纺织单元,随后对其进行高度集成。这项技术的基本原理是通过玻璃毛细管喷射微纤维,然后在编织机的作用下编织成2 cm × 1 cm的3D细胞实体。
如图8(e)[81]所示,除编织外,逐层堆积也是构建3D细胞结构的重要手段,因此生物3D打印技术在3D细胞结构搭建方面被寄予厚望。如图8(f)[87]所示,研究人员将微流控喷头整合到生物3D打印机上即可打印多组分纤维集成结构。此外,3D打印技术的多喷头打印特性可以实现微流控多喷头的3D打印[图8(f-iii)],进而构建更为复杂、更贴合体内组织结构特性的工程组织。
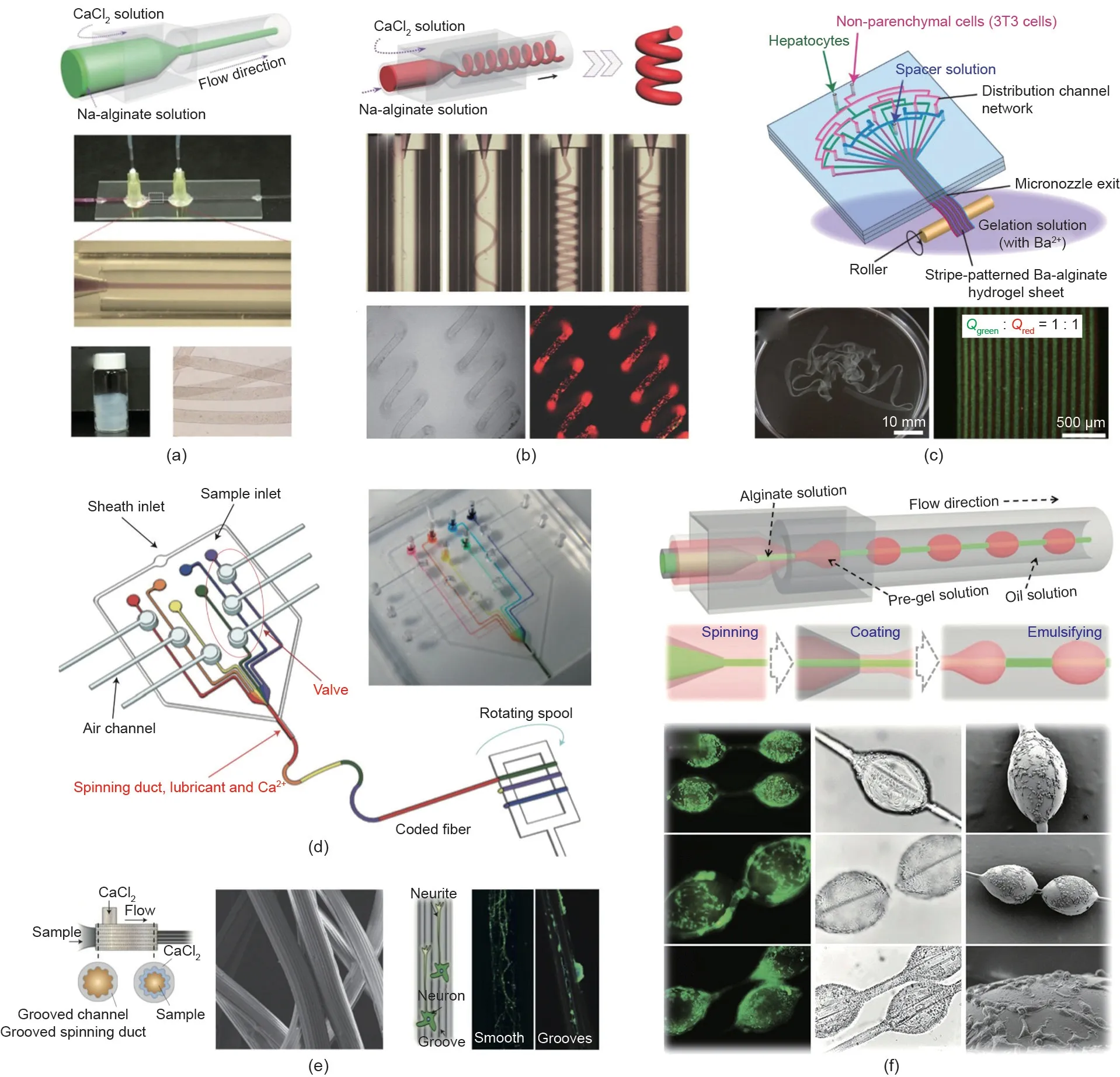
图6. 具有不同形态、结构的微纤维。(a)海藻酸盐微纤维[75];(b)螺旋型微纤维[76];(c)条带型微纤维[77];(d)编码型海藻酸盐微纤维[78];(e)沟槽型微纤维[78];(f)串珠型微纤维[79]。
4. 应用
基于微流控技术形成的液滴或微纤维具有尺寸调节方便、组成成分多样及结构可控的优势。微流体的形成不需要高温或高压条件,只需要构建一个相对温和的环境。因此,一些包括细胞在内的对环境敏感的生命体,可以在液滴或微纤维中培养而不会失去其功能活性。这些独特的性质使得通过微流控制备的细胞负载的微载体或微纤维,在医用增材制造方面具有一定的应用性[88-112]。
4.1. 细胞定向
细胞外基质影响不同类型细胞的形态和排列方式[88-90]。目前利用微流控纺丝微纤维引导不同类型细胞定向生长已被广泛报道,如成肌细胞、成纤维细胞、心肌细胞和神经元细胞等。Scheibel等[91]对在胶原微纤维中孵育72 h后的神经元NG108-15的细胞形态进行研究,发现神经元NG108-15细胞沿着微纤维轴方向发生了轴突生长(最长可达100 μm)。Lee等[92]提出用连续微流控技术制造一种带有沟槽结构的微纤维,并对带沟槽结构的纤维和光滑纤维上神经元细胞的生长状况进行比较[图9(a)],发现在带沟槽结构的纤维中大多数神经元细胞沿沟槽定向生长,而在平滑纤维上的神经元细胞随机排列。结果表明,微纤维表面的沟槽结构有助于神经元细胞的定向生长。此外,还有学者研究了微纤维尺寸对黏附细胞排列方向的影响[93],发现成纤维细胞在PLGA微纤维上生长时,随着微纤维尺寸的减小,细胞沿着纤维取向定向排列增加。

图7. 不同微流控装置制得的多中空、多组分微纤维。(a)玻璃毛细管装置[75,81];(b)PDMS装置[82]。
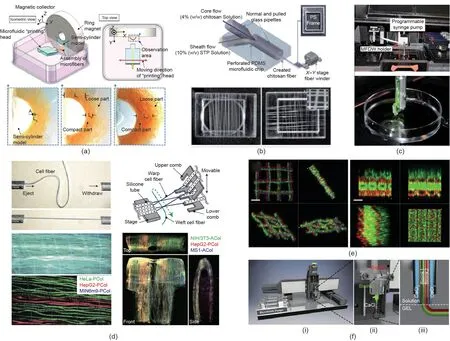
图8. 微纤维集成3D细胞结构的不同方法。(a)磁诱导[83];(b)缠绕器[84];(c)微流控直写[85];(d)微流控纤维编织机[86];(e)逐层堆叠[81];(f)生物3D打印[81]。STP:三聚磷酸钠。
除了带沟槽结构的纤维外,通过其他方法构建的图案化微纤维也具有引导细胞定向生长的能力[94,95]。Zhang等[94]基于开尔文-亥姆霍兹不稳定性波的形成原理,构造了一种表面具有定向排列的亚微米结构的海藻酸盐微纤维。通过调节纤维的灌注速度和纺丝速度来调整水凝胶纺丝制得微纤维的亚微米形态,以此改变细胞生长的定向性。PC12细胞在表面具有剪切花纹的微纤维上培养时呈现沿纤维轴定向生长的趋势,但在培养皿或者光滑纤维上生长时呈现随机排列的趋势[图9(b)]
[94]。如图9(c)[95]所示,通过3D打印微流体构建的3D微纤维网络,也具有引导细胞定向生长的功能。在空气中打印一种表面具有程序化周期褶皱的壳聚糖支架,发现L929成纤维细胞在支架中沿着壳聚糖纤维丝方向定向生长。
4.2. 3D 细胞培养
细胞易受微环境的影响,微环境会影响细胞的形态、黏附、迁移、增殖和分化[96,97]。与传统的2D培养相比,3D培养的优势在于能够模拟细胞间的相互作用和体内的微环境[98,99],且3D培养能够在体外重构组织的3D结构以及恢复组织生理学的部分功能。因此,细胞3D培养技术在细胞生物学、药物研发、组织工程等领域至关重要。现已有多种细胞3D培养的方法[100-102]。由于微流控技术具有可构建仿生体系、高通量制造、形状及细胞微环境可控等优势,其生成的微载体或微纤维已经成为一种新型的3D细胞培养平台。目前研究人员在这个领域已经开展了大量的研究工作。
Wang Y和Wang J [103]开发了一种液滴微流控的方法,采用由海藻酸钠和人工基底膜交联形成的水凝胶微载体制备肿瘤多细胞球体。将人宫颈癌细胞(HeLa细胞)包埋在微载体内,细胞间紧密相连。用抗肿瘤药物测试在微载体中形成的HeLa细胞球体,发现肿瘤多细胞球体在体外具有模拟肿瘤特性的能力。这种制备肿瘤多细胞球体的微流控方法可用于细胞间相互作用的研究、肿瘤的治疗和高通量抗肿瘤药物的筛选。He等[104]用微流控技术制备了一种包裹胚胎干细胞(ES细胞)的核-壳结构微载体,这种微载体在ES细胞的3D培养中表现出良好的促聚集和促增殖的能力。且与2D培养相比,3D培养的ES细胞保持了更高的多能性。此外,研究人员将细胞封装在具有核-壳结构的微载体中进行培养,通过用不同种类的生物相容性聚合物取代核-壳结构中的核材料,研究细胞微环境对细胞3D培养的影响[105]。这种仿生3D细胞技术在发育生物学和高通量药物筛选方面具有较好的应用发展前景。Leong等[106]更为详尽地对细胞球状体在微载体中培养的微环境进行评估[图9(d-i)]。研究人员用油层代替水凝胶外壳,简化了封装过程,同时降低了各相的黏度要求。如图9(d-ii)[106]所示,由于与油中的两亲性表面活性剂相结合,液滴微流控系统在150 min后即可诱导形成球状体,而现有的其他技术则需要1~4 d。此外,分别用海藻酸钠和海藻酸钠-精氨酸-甘氨酸-天冬氨酸(-RGD)将hMSC包裹在核-壳结构中形成球状体,其中后者展现出增强的细胞成骨分化能力[图9(d-iii)、(d-iv)[106] ]。结果表明,可以微调微环境,如改变液滴微流控系统的内芯材料,从而促进细胞分化。
负载细胞的微纤维在3D细胞培养中也起着重要作用。如图9(e)所示,Zhao等[75]用海藻酸盐微纤维进行细胞3D培养,发现肝癌细胞(HepG2细胞)在微纤维中增殖并聚集形成球状体。用连续微流控纺丝制得负载细胞的微纤维,可获得大量的细胞球体。通过破坏海藻酸钙凝胶的网状结构释放出细胞球体,以进行后续研究与应用。另外,该研究还探究了不同微纤维结构对细胞性能的影响。
4.3. 组织构建
将工程化的微载体、微纤维经过组装或堆叠成任意的3D结构,可以体外构建3D细胞结构。Takeuchi等[107]将大量负载细胞的胶原蛋白微载体堆叠到设计好的硅树脂组分中[图10(a)],由于位于微载体表面的细胞间存在黏附作用,无需添加任何黏合剂,从而快速构建了宏观3D细胞模型。He等[58]用类似方法进行自下而上组装,在体外构建了人类乳腺血管瘤。在这项研究中,研究人员首先将癌细胞在微载体中进行3D培养,以获得无血管的微肿瘤,然后将其与内皮细胞和其他基质细胞组装在一起制造出人工血管瘤。人工血管瘤比无血管的微肿瘤或2D培养的癌细胞表现出更高的耐药性,这表明了细胞外微环境的重要性。Zhao等[81]利用微流控技术制备了具有生物活性的微纤维以建立多种形态的3D结构,并首次构建了能够装载人脐静脉内皮细胞(HUVEC)的中空水凝胶微纤维。结果发现,HUVEC附着在中空微纤维的内界面上,铺展形成在成分和结构上与血管相似的单层细胞管。随后,通过堆叠或交叉纺织微纤维构建了多层结构或网格结构,这在仿生微纤维网络组织方面具有一定的应用前景。除了基于微载体或微纤维构建3D细胞模型,Wallace等[108]使用手持式微流控生物打印方法构建了3D类脑结构模型[图10(b)]。这种自由形成的3D结构具有分层结构,由多肽修饰的生物聚合物和装载的原代神经细胞组成。如图10(b-iii)所示,在该3D结构模型中形成了多层神经回路,推动了对脑部疾病病发机理与大脑学习和记忆功能相关的研究。
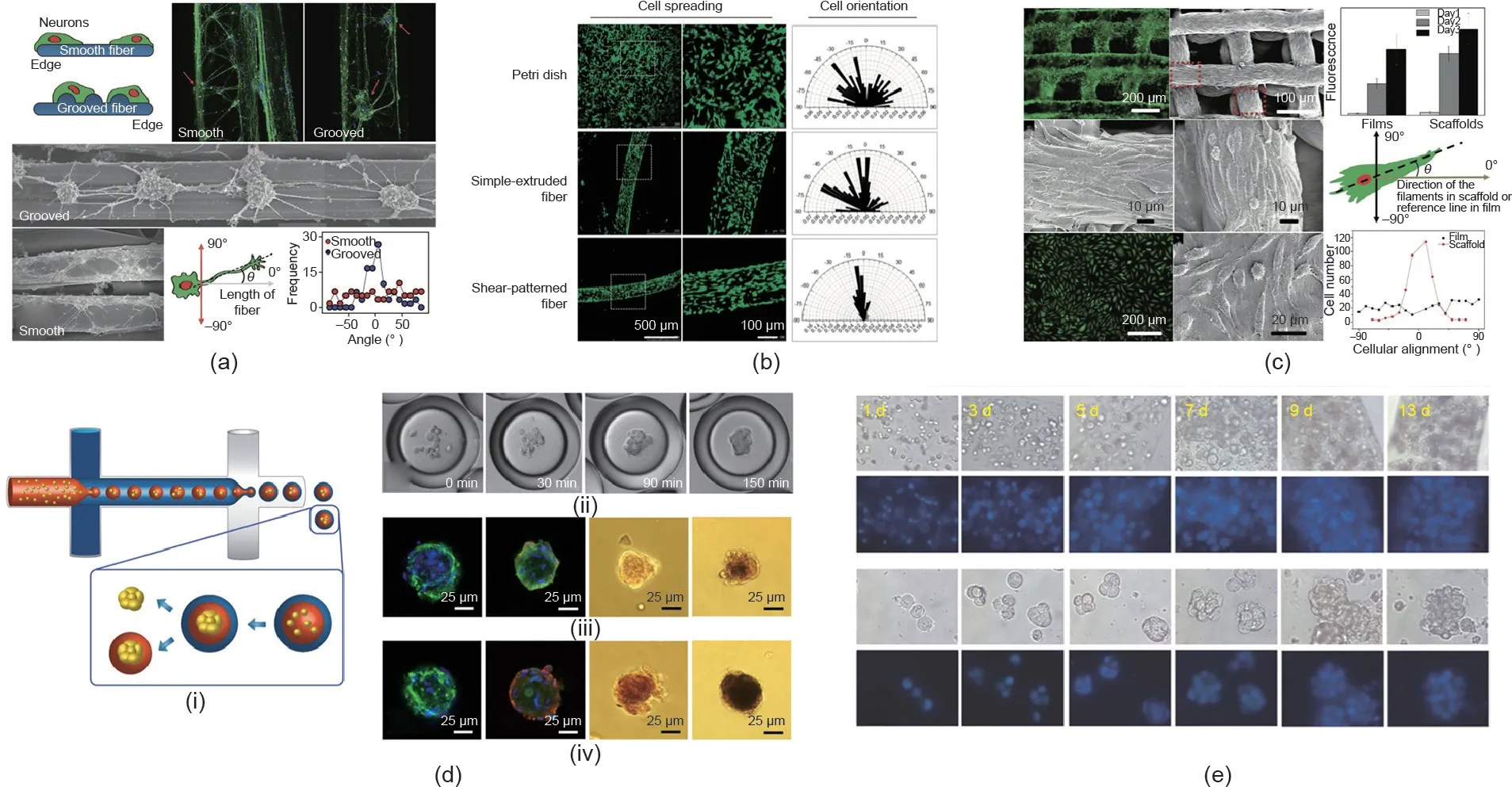
图9. 细胞定向和细胞3D培养在医用增材制造领域的应用。(a)~(c)细胞定向[92,94,95];(d)、(e)细胞球状体制作[106,75]。
4.4. 细胞治疗
可将在负载细胞的微载体或微纤维中注射水凝胶材料、生物活性物质或者治疗性细胞的方法应用于医学移植、伤口愈合和组织再生领域[109,110]。这些方法能够复制组织结构功能,在微创植入方面具有巨大的潜力和前景。因而这些方法在这一领域的应用越来越受到人们的重视,各类相关的研究成果相继问世。
Takeuchi等[86]探讨了负载细胞微纤维在医学移植中治疗糖尿病的适用性。他们首先用海藻酸盐-琼脂双交联互穿网络(IPN)水凝胶包裹负载有胰岛细胞的微纤维,以避免纤维发生纤维化反应,同时保护细胞免受免疫攻击。然后,他们将被水凝胶包裹的负载有胰岛细胞的微纤维植入糖尿病小鼠体内,小鼠血糖浓度逐渐恢复正常。相反地,直接在小鼠体内注射负载有等量原代胰岛细胞却不起作用。这一结果证实了负载有原代胰岛细胞的微纤维对糖尿病具有治疗能力。Zhao等[111]提出了一种新型微纤维,负载维生素金属有机骨架(MOF),用于伤口愈合[图10(c)]。在通过微流控纺织具有核-壳结构的海藻酸盐微纤维的过程中,MOF在原位合成了。微纤维高度可控的核-壳结构使得负载的MOF可被温和地释放,从而具有抗菌和抗氧化能力。当将微纤维制成的薄膜应用于皮肤创口感染的小鼠模型时,释放出的铜离子、锌离子和生物相容的维生素配体加速了组织创伤的愈合过程。除了在创伤愈合上的应用,Segura等[52]还开发了一种构建块的方法,以获得基于微载体可注射的组织仿生结构,并将其输送到伤口部位用于伤口愈合。如图10(d)[52]所示,注射组织的仿生结构的伤口愈合速度明显快于其他对照组。伤口愈合的速度由3D仿生结构模型中微载体孔隙的大小决定。
负载干细胞的微载体或微纤维已经在细胞治疗方面展现出一定的应用前景。携带干细胞的微载体或微纤维在被注射入体内后能够迅速降解,使细胞在体内释放。例如,人脐带间充质干细胞(HUCMSC)在注射4 d后即从微载体中释放出来,并表现出良好的增殖特性和成骨分化能力[112]。另外,负载干细胞的微载体或微纤维具有良好的生物相容性,有望用作长期运输治疗因子的新平台。综上所述,负载功能细胞(无论是高度分化的细胞还是干细胞)的微载体或微纤维在细胞治疗和再生医学中展现出极为重要的作用。
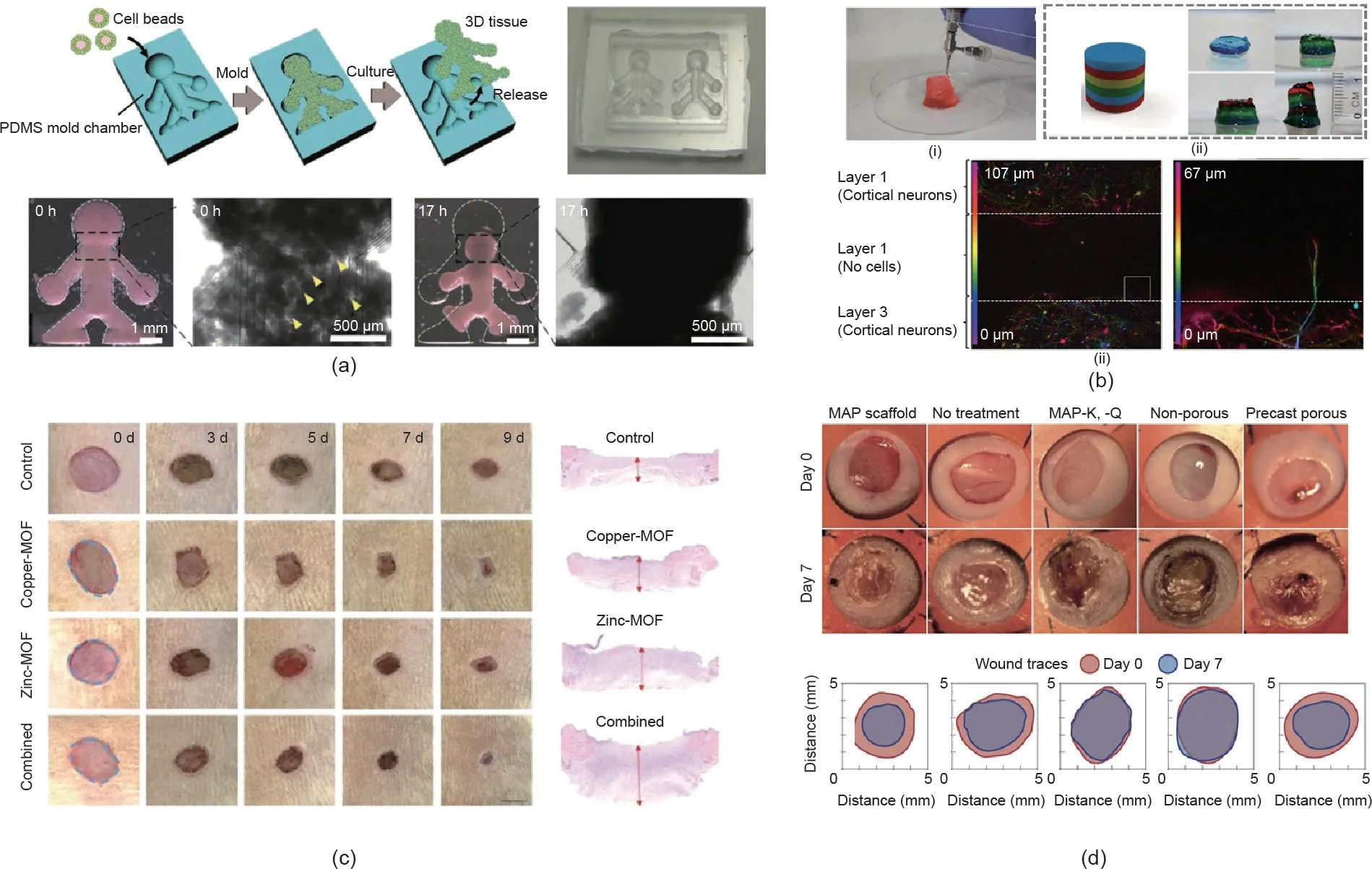
图10. 组织构建和细胞治疗在医用增材制造中的应用。(a)、(b)组织构建[107,94];(c)、(d)创伤愈合[111,52]。MOF:金属有机骨架。
5. 总结与展望
本文针对负载细胞的微载体、微纤维的微流控生成技术及其在医用增材制造领域的应用进行综述。从对液滴微流控和微流控纺丝技术的原理介绍开始,阐述了基于微流控技术的特殊形态、结构的微载体和微纤维的生成,并着重介绍了将负载细胞的微载体和微纤维进行体外组装成复杂3D细胞结构的各种方法。负载细胞的微载体、微纤维具有良好的机械性能、加工特性和生物相容性,未来将会在细胞定向、细胞3D培养、组织构建和细胞治疗等领域得到广泛的应用。
尽管微流控技术在医用增材制造领域已经取得了不少开创性的成果,但一些科学问题依然需要解决且该学科仍具有长远的发展前景。主要涉及以下三个问题:其一,虽然具有复杂形态、结构的微载体在体外构建仿生3D细胞结构过程中起到关键作用,然而鉴于微流控装置的固有特性,目前这种微载体的大规模生成面临着严峻挑战。文中提到,PDMS和玻璃毛细管是制造微流控装置最常用的材料。基于PDMS的微流控芯片具有规模化生成液滴的优势,而使用玻璃毛细管构造的微流控装置可稳定生成结构更为复杂的微流控液滴。若将上述两种方式的优势进行有机结合,则有机会推动新一代微流控装置的诞生,并为具有复杂形态和结构的微载体的规模化生产提供潜力。其二,人工体外构建的细胞3D结构与体内天然组织结构之间存在较大的差异。一方面,在细胞种类、形态、排列和结合位点等方面模拟天然组织的非均质结构需要付出巨大努力;另一方面,细胞外微环境和细胞间的相互作用在维持体内组织的生理功能方面发挥着重要作用,可通过在工程组织中附加适合的天然组织源材料以更好地模拟体内环境。其三,目前工程组织搭建方式的可控性和精度都较低,在复杂的微小组织搭建方面并不适用,此时则需要借助器械装置。生物3D打印是一种具有广阔前景的机器构建宏观细胞组织的方式,可用微流控芯片喷头对生物3D打印机单口喷头进行替换以实现对多种生物墨水的控制。除上述三个主要问题外,用于长期递送治疗因子或分化细胞的负载细胞的微载体、微纤维的开发,及其在器官芯片领域内的应用同样值得期待。
致谢
本研究得到国家重点研究发展计划(2020YFA0908200)、国家自然科学基金(22002061、52073060、61927805)、 江 苏 省 自 然 科 学 基金(BE2018707)、江苏省农业科技自主创新基金[CX(20)3051]的资助。
Compliance with ethics guidelines
Jie Wang, Changmin Shao, Yuetong Wang, Lingyun Sun, and Yuanjin Zhao declare that they have no conflict of interest or financial conflicts to disclose.
