北柴胡转录因子BcbZIP179的基因克隆及原核表达*
2020-04-12韩文静朱楚然魏建和
韩文静,徐 娇,朱楚然,隋 春,魏建和
(中国医学科学院&北京协和医学院药用植物研究所/中草药物质基础与资源利用教育部重点实验室/濒危药材繁育国家工程实验室 北京 100193)
伞形科柴胡属多年生草本植物北柴胡(Bupleurum chinenseDC.),是我国药典规定的中药柴胡的基原植物之一。柴胡皂苷是北柴胡的主要药效成分之一,具有抗炎、保肝、提高免疫力等作用[1]。碱性亮氨酸拉链(basic leucine zipper,bZIP)转录因子,是真核生物转录因子中分布最广泛的家族之一[2],植物bZIP 转录因子能够参与调节多种生理功能,包括调节生长发育、调节次生代谢及生物与非生物胁迫的应答反应[3-4]。根据拟南芥碱性区域及其他保守区域的相似性78 个bZIP 转录因子可划分为13个组(A-I,S,M,K,J),同一组bZIP转录因子往往具有相似的结构特征及功能[5-6]。本研究在生物信息分析转录组转录因子基因[7]基础上,从北柴胡中克隆了1 个编码bZIP 转录因子的基因BcbZIP179,其氨基酸序列与胡萝卜(Daucus carotaL.)中的类bZIP53 蛋白同源性最高。利用qRT-PCR 对BcbZIP179的组织表达特性及受MeJA 诱导的表达特性进行分析,BcbZIP179可能与植物次生代谢相关。利用原核表达系统摸索出BcbZIP179适宜表达条件,获得体外表达的融合蛋白,为制备抗体、分离互作蛋白和调控靶基因奠定基础,为进一步研究其功能提供条件。
1 材料与方法
1.1 材料
所用北柴胡品种中柴2号种植于中国医学科学院药用植物研究所药用植物栽培育种试验地。BL21(DE3)、Transetta(DE3)菌株和原核表达载体 pET-28a、pEASY-Blunt E1 购自北京康为世纪生物科技有限公司。
1.2 试剂
高 保 真 DNA 聚 合 酶(PrimeSTAR HS DNA Polymerase)、PrimeScript™ RT Master Mix 反转录试剂于宝日医生物技术(北京)有限公司购买;RNA 提取试剂盒(Total RNA Purification Kit,LC Sciences,Houston,USA)、DNA 纯化回收试剂盒(Universal DNA Purification Kit)、质粒小提试剂盒(TIAN prep Mini Plasmid Kit)于天根生物科技有限公司购买;BamHI 和EcoRI 内切酶、T4 DNA 连接酶于 NEB 公司购买[8];异丙基-β-D-硫代半乳糖苷(IPTG)于北京康为世纪生物科技有限公司购买;SDS-PAGE预制胶于Bio-Rad公司购买。
1.3 RNA提取与cDNA合成
采集二年生盛花期北柴胡的根、茎、叶、花、果实,以单株为生物学重复,重复3 次,样品在液氮中速冻后-80℃保存备用。北柴胡不定根培养参照文献报道[9]。将培养21 天的不定根剪成约0.5 cm 的小段,更换到含有 0(CK)和 200 μmol·L-1MeJA 的培养基中,24℃、100 r·min-1振荡暗培养,分别于0 h、2 h、4 h、8 h、12 h、24 h、48 h、72 h 和 5 天时取样,液氮速冻后-80℃保存备用。RNA 提取和cDNA 第1 链的合成均按照试剂盒说明书进行。反转录产物稀释至100 ng·μL-1,-20℃保存备用。
1.4 BcbZIP179基因的全长克隆及序列分析
根据转录组数据中的转录因子基因序列,设计特异性引物(表1),以反转录得到的cDNA 为模板进行PCR 扩增,获得BcbZIP179的全部基因编码序列。利用在线软件ExPASy-PROSITE 确定BcZIP179的特征性bZIP 区域位置,ProtComp9.0 进行亚细胞定位,NLSMapper 进行核定位信号预测,TMHMM Server v.2.0 进行跨膜结构分析,SOPMA 进行蛋白二级结构分析,氨基酸序列比对在NCBI 的蛋白质序列数据库中进行。利用MEGA X 构建系统进化树,bootstrap 重复次数为1000次。
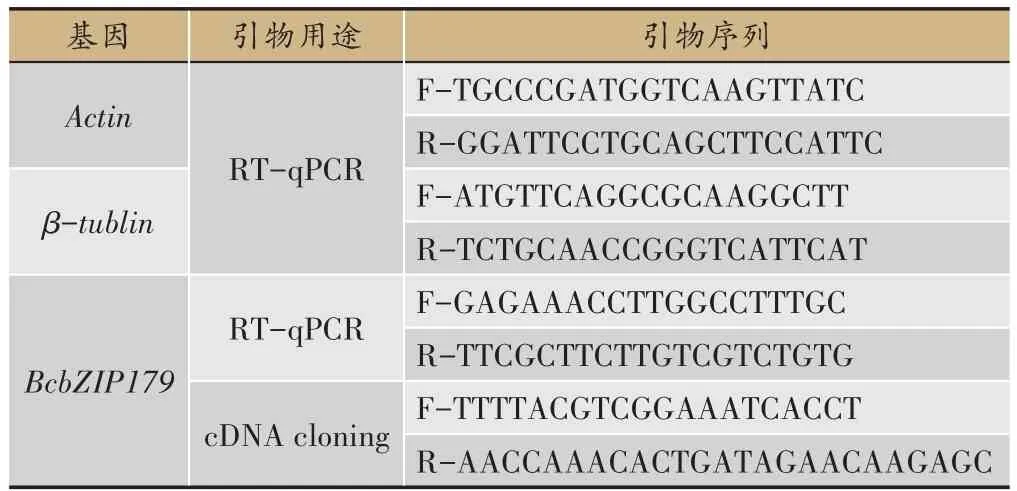
表1 实验用引物
1.5 BcbZIP179基因表达分析
以MeJA 处理的北柴胡不定根及北柴胡植株不同组织器官为材料,内参基因为Actin和β-Tublin,qPCR反应使用LightCycler 96 实时荧光定量PCR 仪进行。SYBR Premix Ex Taq II(2×)7.5 μL,cDNA(100 ng·μL-1)0.8 μL 作为 PCR 反应体系(15 μL),上下游引物(10 mmol·L-1)各 0.2 μL,ddH2O 3.8 μL。PCR 扩增程序:95℃预变性3 min;58℃,30 s,40 个循环。3 次技术重复。相对表达量采用2-ΔΔCt法计算。
1.6 原核表达载体构建
将BcbZIP179编码区分别插入表达载体pET-28a和pEASY-Blunt E1 Vector 中,菌液PCR 验证后选择阳性克隆测序,序列比对完全正确的克隆(分别命名为E2-BcbZIP179 和E1-BcbZIP179)用于转化大肠杆菌BL21(DE3)和Transetta(DE3)感受态细胞,同时转化空载体作为对照。
1.7 原核表达条件摸索
将转化的空载体、重组质粒E1-BcbZIP179 和E2-BcbZIP179 的表达菌株单克隆接种于含Amp(氨苄青霉素50 mg·L-1)的 LB 液体培养基中,180 r·min-1,37℃条件下振荡培养过夜,再按照1∶50 比例在新的LB 培养基中培养至D600 nm 约为0.6,加入IPTG 至终浓度分别为 0.5 和 0.05 mmol·L-1,继续培养 12-16 h,设置37℃和16℃诱导表达温度,离心收集菌体,加上样缓冲液沸水浴变性5 min后,10%SDS-PAGE电泳分析。
2 结果与分析
2.1 北柴胡BcbZIP179的序列分析
根据转录组数据,设计一次性扩增BcbZIP179编码区的特异引物,经PCR、PCR 产物电泳、目的片段回收、克隆和测序,获得编码序列长435 bp 的BcbZIP179基因,推测编码144 个氨基酸。NCBI BLASTx 结果显示,BcbZIP179与不同物种中的 bZIP53 或类 bZIP53 蛋白序列一致性比较高,其中与胡萝卜中的类bZIP53蛋白序列一致性最高,为78.62%(图1)。SMART 结构域分析显示,在BcbZIP179的第23-86 氨基酸位置为bZIP 特征结构域,说明属于S 亚家族,在结构上和S 亚家族的拟南芥具有相同的保守结构域(图2)。
利用ExPASy-PROSITE 分析结果显示BcbZIP179其bZIP 结构域在26-76 位氨基酸位置,利用ProtComp 9.0 在线软件与NLS Mapper 分别预测出该转录因子具有核定位信号,和其核定位信号存在于该蛋白氨基酸序列的第3-32 位,说明BcbZIP179具有转录因子特征。利用TMHMM Server v. 2.0 软件预测显示不存在跨膜结构域,而根据SOPMA 软件二级结构预测表明该蛋白符合亮氨酸拉链主要由α-螺旋组成的结构特点,预测结果显示:氨基酸序列含有66.67%α-螺旋,且第20-110位氨基酸之间主要为α-螺旋。
2.2 BcbZIP179基因表达分析
2.2.1BcbZIP179基因在北柴胡不同组织中的表达分析
在北柴胡不同组织器官中,根据qRT-PCR方法检测BcbZIP179基因的相对表达量,表明在北柴胡各器官中BcbZIP179均有表达,其中果实的表达量最高,其次是茎中的表达量高于根、叶和花(图3)。
2.2.2BcbZIP179基因受MeJA诱导的表达分析
利用qRT-PCR 方法检测BcbZIP179基因在MeJA处理的不定根中的表达,结果表明,BcbZIP179在MeJA 处理后的24 h 内,表达量逐渐升高,随后表达量降低(图4),但仍高于对照。MeJA 诱导的基因通常与次生代谢相关,提示该转录因子可能参与调控柴胡次生代谢。
2.3 BcbZIP179原核表达
为了获得体外表达的BcbZIP179蛋白,用于后续BcbZIP179基因功能分析,采用2 种原核表达载体和2种表达菌株,在不同IPTG诱导浓度和诱导表达温度条件下,进行了BcbZIP179的原核表达分析。首先构建原核表达载体,并能够从重组载体上酶切到与预期片段大小一致的条带。通过对较,采用Transetta(DE3)菌株比BL21(DE3)菌株的效果更好,低温16℃的诱导效果优于37℃。IPTG 的浓度对表达量的影响不大,0.05 mmol·L-1和 0.5 mmol·L-1条件下,表达量没有明显差异(图5)。
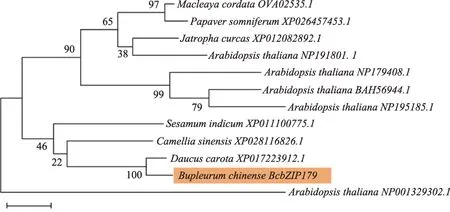
图1 BcbZIP179与其它物种bZIP53的系统进化树

图2 BcbZIP179与AtbZIP53(Arabidopsis)的氨基酸序列比对

图3 BcbZIP179在北柴胡不同器官中的表达分析
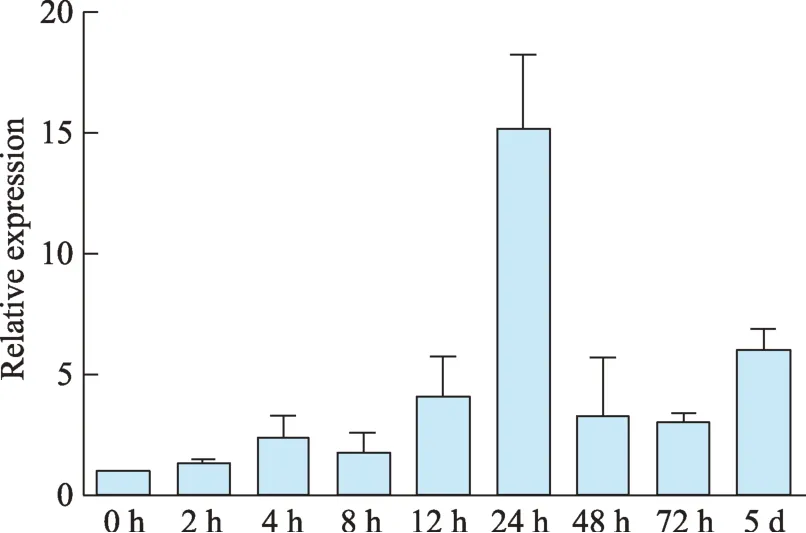
图4 BcbZIP179受MeJA诱导的表达分析
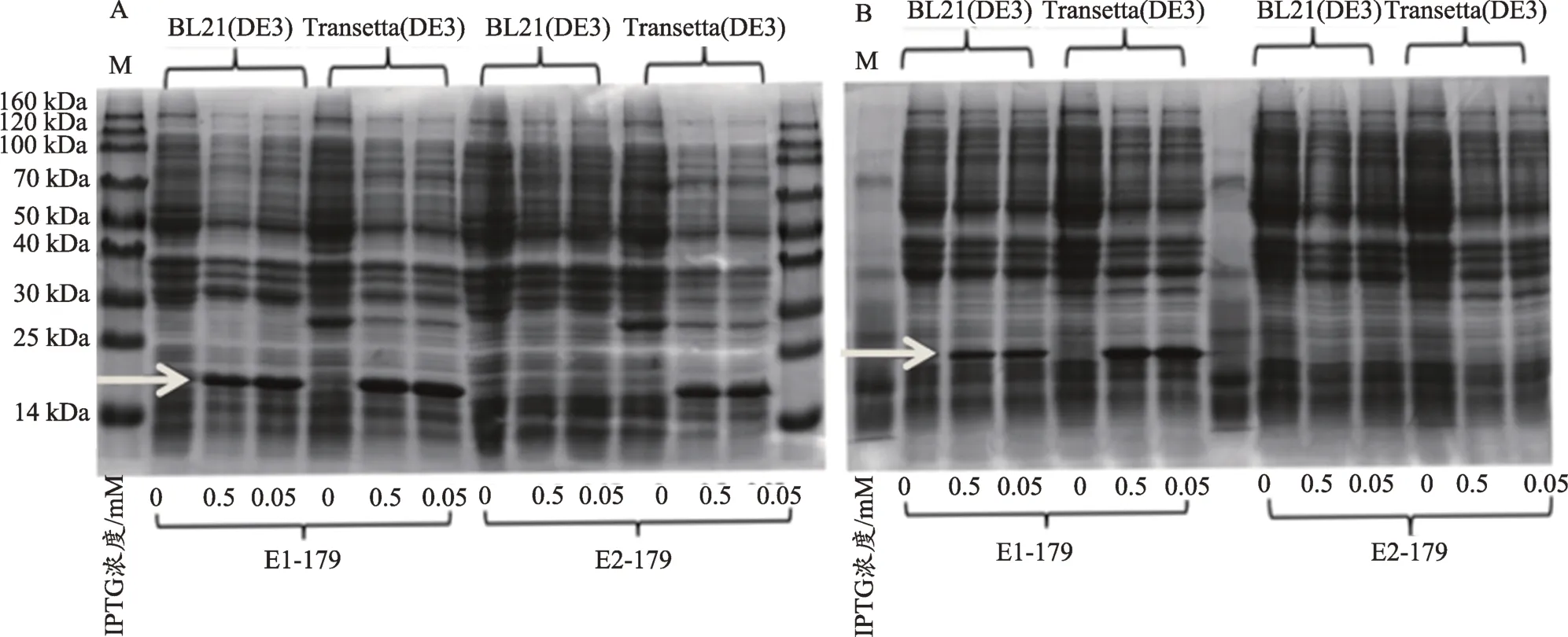
图5 BcbZIP179重组蛋白的原核表达
3 讨论
bZIP 转录因子广泛存在于真核生物中,全基因组范围的转录因子基因分析显示,不同物种中bZIP 转录因子基因数目差异较大。拟南芥中有78 个bZIP 转录因子,水稻中有92 个,玉米中有125 个,油菜籽有247个[10]。bZIP 转录因子数量众多,但只有少数bZIP 转录因子的功能在特定植物中得到解析[11-12],更多bZIP 转录因子在不同物种中的表达调控机制还不清楚。目前已知bZIP 转录因子主要通过调节次生代谢产物的合成参与调节植物的生长发育与环境变化的应答反应。bZIP 转录因子参与调控萜类化合物、黄酮类化合物及生物碱等多种化合物的合成,能够增强植物的抗病性,适应低温胁迫,提高植物抵抗环境胁迫的能力。同时bZIP 转录因子通过调节次生代谢产物的合成调控植物的生长、发育、开花及结果。大量研究表明次生代谢产物是许多药用植物的主要活性成分。bZIP转录因子不仅能够提高植物的抗逆性,调节植物的生长发育,还可以有效提高药用植物中有效成分的含量[4]。本研究获得了北柴胡中的1 个bZIP 转录因子基因BcbZIP179,并进行了生物信息学分析。北柴胡BcbZIP179属于类bZIP53转录因子,拟南芥中的bZIP53研究较多,多与种子的成熟及幼苗形成有关[13-14],也与拟南芥在逆境下的氨基酸代谢调控有关[15]。BcbZIP179在北柴胡各个组织器官中均有表达,但在果实中的表达高于其它组织器官,所以该基因可能与果实的成熟有关。BcbZIP179的表达还受MeJA 诱导,在处理的24 h时,表达量最高。MeJA 通常诱导胁迫条件下的次生代谢,所以该基因可能参与植物次生代谢的调节。BcbZIP179是否参与植物的次生代谢调节,具有与拟南芥bZIP53相似功能,有待进一步探究。
bZIP53 属于bZIP 家族中的S1 组,以往研究显示S1 组成员往往与C 组成员相互作用,共同起调控功能[7]。为深入研究BcbZIP179的调控机制,有必要获得北柴胡体内与之相互作用的的蛋白及调控的靶基因,为此,本研究利用原核表达系统,获得了体外表达的BcbZIP179融合蛋白,为后续制备抗体,筛选BcbZIP179调控的靶基因,深入开展BcbZIP179的基因功能研究提供了条件。
