脾气虚大鼠胃黏膜细胞线粒体自噬相关蛋白表达的研究*
2020-04-12刘璐菘刘文俊许欣竹王凌志于化新刘慧慧单德红
刘璐菘,刘文俊,许欣竹,马 丹,王凌志,于化新,刘慧慧,单德红
(1. 辽宁中医药大学动物实验中心 沈阳 110847;2. 辽宁中医药大学教学实验中心 沈阳 110847;3. 辽宁中医药大学中西医结合学院 沈阳 110847)
传统中医理论认为脾胃相表里,脾气虚时胃气亦虚,因此胃主受纳和腐熟水谷等功能也会受损。现代医学认为,胃黏膜存在主细胞、壁细胞和G 细胞等多种内、外分泌细胞,其合成释放的胃液和多种胃肠激素广泛参与消化吸收。研究发现,脾气虚时胃酸、胃蛋白酶原、胃泌素、胃动素和血管活性肠肽等分泌减少[1-5],胃黏膜细胞的线粒体损伤[6,7]。由于线粒体在胃液和胃肠激素的合成与释放中发挥重要作用[8,9],因此其损伤与脾气虚胃黏膜细胞的内、外分泌功能下降有关,但其损伤机制不明。
线粒体为网状细胞器,对外来刺激极为敏感,但细胞可启动线粒体自噬机制,及时清除异常个体,从而维护其网络健康。线粒体产能主要依赖于呼吸链复合物(respiratory chain complex,RCC)的氧化磷酸化,其副产品还有线粒体膜电位(ΔΨm)。5 种RCC 中的4种由线粒体DNA和核DNA 共同编码,但前者易突变,常导致部分线粒体ΔΨm 下降,但细胞可通过PTEN 诱 导 激 酶 1(PTEN-induced putative kinase protein 1,PINK1)-Parkin 通路,启动线粒体自噬机制,及时识别并隔离异常线粒体,进而为溶酶体降解清除[10]。线粒体自噬过程复杂,受众多自噬相关蛋白严密调控,因此某些关键蛋白表达常用来评价其发生水平,如微管相关蛋白1 轻链3(microtubule-associated protein light chain 3,LC3)-II 和选择性自噬接头蛋白p62 等[11]。本研究主要采用电镜和分生等技术,围绕线粒体超微结构、呼吸链状态和自噬等,探讨脾气虚胃黏膜细胞线粒体损伤的可能机制。
1 材料
1.1 动物
将SPF 级雄性SD 大鼠,体质量(220 ± 10)g,共计16 只,购自本溪长生生物技术有限公司(许可证号:SCXK(辽)-2010-0001),适应性饲养(室温(22 ±1)℃,相对湿度45%-55%,自由进食水)1周后复制脾气虚证动物模型。本研究方案通过辽宁中医药大学实验动物伦理委员会审核(20151205)。
1.2 伦理审查
项目通过辽宁中医药大学实验动物伦理委员会审核,批准号:20151205。
1.3 试剂
线粒体呼吸链复合物I-IV 检测试剂盒(批号:20171120,Solarbio)、BCA 法蛋白测定试剂盒、EasySee Western Blot 发光液(批号:K20316、10419,TransGen)、ATP 含量测定试剂盒(批号:201901,南京建成生物工程研究所)、抗RCC V多克隆抗体和抗p62多克隆抗体(批号:00007313,00010203,Proteintech)、抗 PINK1 多克隆抗体和抗Parkin多克隆抗体(批号:GR248843-1,GR281377-1,Abcam)、抗LC3-II 多克隆抗体(批号:00040972,Proteintech)、GAPDH( 批 号 :20817,TransGen)。
1.4 主要仪器
酶标仪(美国,iMark),蛋白印迹和和电泳仪(美国,Bio-Rad)、高速冷冻离心机(美国,Thermo Scientific)、显影仪(中国,Tanon)。
2 方法
2.1 分组、模型复制及评价
大鼠按照随机数字表法分为正常组和脾气虚证模型组(模型组),每组8 只。按文献[12]复制和评价饮食失节+劳倦型脾气虚证大鼠模型。
2.1.1 模型建立
模型组在15日内①先饱食1日,再禁食2日,不禁水,共5个循环;②每日水温35-37℃游泳至力竭。
2.1.2 模型评价标准
①消瘦:体质量明显下降为达标;②食少:代谢笼计量24 h 单只进食量和饮水量,均明显减少为达标;③神疲:检测大鼠5 min 内在旷场实验中的运动距离和站立次数,显著下降为达标;④乏力:四肢抓力明显变小为达标。⑤毛发枯槁:三人分别判断,结论一致为达标。
2.2 胃黏膜细胞线粒体超微结构观察
二组大鼠腹腔注射10%水合氯醛(0.0035 mL·g-1)麻醉,剖腹取胃,4℃盐水洗净,部分切成约1 mm3,按文献方法[13]处理后,电镜观察胃黏膜细胞线粒体的超微结构变化并拍片,每例计数6 个不同视野下嵴减少的线粒体数量。
2.3 胃黏膜细胞线粒体呼吸链状态评价
同2.2 法取洗净后胃组织,分离胃黏膜层并置于线粒体保护液中,玻璃匀浆器充分匀浆后离心(1 kg,5 min,4℃),弃除沉淀,将上清同法再次离心,吸取上清再次离心(1.2 kg,10 min,4℃),向沉淀物中加入100 μL预冷PBS(pH7.4)制成线粒体混悬液;其次,采用JC-1法,将线粒体悬液与JC-1 冲洗缓冲液混合,用红色荧光/绿色荧光比值表示ΔΨm;最后,取线粒体悬液,按文献采用比色法检测ATP 和呼吸链RCCI-IV 活性[14]。所有操作均严格按照说明书操作。
2.4 相关蛋白表达
参照文献所载Western blot 检测方法[15],简述如下:剪碎胃黏膜组织后加入线粒体蛋白裂解液,冰浴充分匀浆后静置30 min,离心(1.4 kg, 10 min, 4℃)取上清;BCA 蛋白定量,以25 μg 上样调整并计算加样量;2 × SDS-PAGE 蛋白上样缓冲液100℃煮沸5 min,加样,10%分离胶SDS-PAGE 电泳90 min;转膜;5%脱脂奶粉/TBST 室温封闭1 h;分别加入RCCV(1∶2000)、PINK1(1∶1000)、Parkin(1∶1000)、LC3-I(1∶5000)、LC3-II(1∶2000)和 p62(1∶2000)及 GAPDH(1∶5000)等抗体,4℃摇床16 h;TBST 洗膜后二抗室温孵育1 h;TBST 洗膜后加入发光显影,应用AlphaView SA 软件计算目的条带相对于内参的表达量,再计算模型组相对于正常组表达量的百分比(除CV),以方便制图。
2.5 数据处理
3 结果
动物模型复制过程中未有死亡及脱失。通过模型评价发现模型组大鼠均出现体质量下降、进食减少、神疲乏力以及毛色枯槁无华等,实验结果表明动物模型复制成功[13-15]。

图1 二组胃黏膜细胞线粒体超微结构变化
表1 二组胃黏膜细胞线粒体嵴减少线粒体数量()

表1 二组胃黏膜细胞线粒体嵴减少线粒体数量()
注:与正常组比较,**P < 0.01。
嵴减少线粒体数/个1.90±0.45 6.43±2.29**组别(n=3)正常组模型组
3.1 胃黏膜层线粒体形态
图1可见,二组均可见较多卵圆形线粒体,轮廓清楚,大小比较一致,内部的嵴较清晰,但模型组可见大量嵴减少现象(见图1 中*),二组嵴减少线粒体数量见表1。
3.2 胃黏膜细胞线粒体呼吸链基本状态
表 2 可见,与正常组比较,模型组 ΔΨm 和 ATP 水平下降,CI 和CIV 活性及CV 表达降低,均有统计学意义,但RCCII和III活性变化不明显,无统计学差异。
3.3 胃黏膜细胞线粒体自噬相关蛋白表达
图2可见,模型组PINK1、Parkin、LC3-I、LC3-II和p62 表达分别为正常组的 68.69% ± 0.84%,72.67% ±4.74%,134.16% ± 2.27%,69.61% ± 3.07%,121.83% ±4.65%,其中PINK1、Parkin 和LC3-II表达水平下降,而LC3-I和p62表达升高,均有统计学意义。
4 讨论
线粒体是网状细胞器,不仅是细胞的动力工厂,对于胃肠道的内、外分泌细胞内来说,还协同高尔基体和内质网等完成胃蛋白酶原和多数激素的合成、储存与释放,而其损伤又会诱发氧化应激和细胞凋亡,因此胃黏膜细胞线粒体健康对于消化吸收影响极大[16]。
脾气虚胃黏膜细胞线粒体结构损伤早有报道[6-7],本研究也观察到类似现象,如模型组线粒体嵴明显减少。由于线粒体产能依赖于其内膜嵴上的呼吸链的氧化磷酸化反应,所以本研究进一步检测了该类细胞线粒体呼吸链的基本情况。结果显示,模型组的ATP和 ΔΨm 水平明显降低,且 RCCI 和 IV 活性及 RCCV 表达降低,表明脾气虚时胃黏膜细胞线粒体的呼吸链功能受损,此结果还未见报道。线粒体RRCI、III、IV和V均由线粒体DNA 和核DNA 共同编码,但前者靠近氧化磷酸化场所,又缺少修复机制,极易为外来刺激所诱导而发生突变,从而干扰呼吸链功能,如不及时纠正,则会导致诸如ΔΨm下降和ATP合成减少等结果。
正常情况下,功能异常的线粒体可以分裂为健康和异常子代各一,前者融入原有网络能够维持线粒体的数量和质量,而后者则应及时清除,否则将污染原有网络,甚至发生氧化应激和细胞凋亡,因此及时降解异常线粒体个体就显得极为重要[17]。线粒体自噬是细胞清除异常线粒体的重要机制,其介导途径较多,目前研究较多的是PINK1-Parkin 通路[18]。研究显示,ΔΨm 正常的线粒体可将胞浆中的PINK1 转运入线粒体内分解,而ΔΨm 下降会阻碍该过程,造成PINK1 堆积于线粒体外膜,再通过一些中间环节募集Parkin,从而促进异常线粒体被吞噬泡所包裹而形成自噬体,最终被溶酶体分解[19]。本研究结果显示,模型组的ΔΨm下降,但PINK1和Parkin表达均明显低于正常组,表明脾气虚时胃黏膜细胞的PINK1-Parkin 通路抑制。通常来说,ΔΨm 下降会导致PINK1 表达上升,但本研究中模型组PINK1 表达却出现降低,推测可能是脾气虚时胃黏膜细胞内的PINK1 合成减少,或是线粒体转运PINK1的机制增强,具体原因将在以后探讨。
表2 二组胃黏膜细胞线粒体呼吸链情况()

表2 二组胃黏膜细胞线粒体呼吸链情况()
注:与正常组比较,*P < 0.05,**P < 0.01。
RCCV表达(n=4)0.70±0.09 0.36±0.11**组别正常组模型组ΔΨm(n=8)0.81±0.27 0.59±0.080**ATP(μmoL·g-1)(n=8)0.18±0.09 0.11±0.01**RCCI活性(n=8)15.27±4.76 12.61±4.09*RCCII活性(n=8)16.98±6.02 18.14±5.50 RCCIII活性(n=8)12.43±3.62 14.10±5.92 RCCIV活性(n=8)33.72±11.34 18.21±3.93**
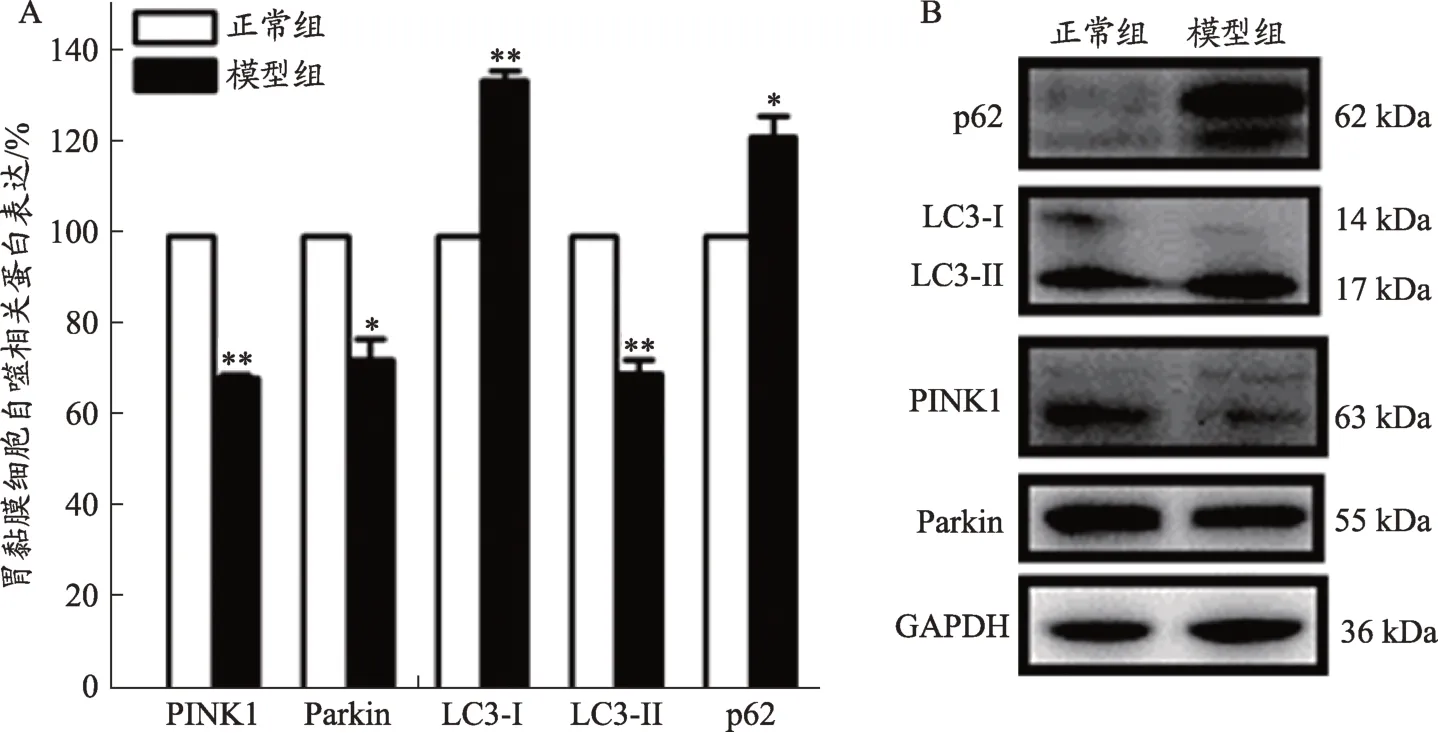
图2 胃黏膜细胞线粒体自噬相关蛋白表达
线粒体自噬因受众多蛋白调控,所以部分蛋白表达水平可用来判定自噬的强弱。LC3-II 由LC3-I 转化,主要表达于吞噬泡和自噬体的膜上,是最常用的自噬评价指标[20]。p62与LC3结合,常在自噬发生后被降解,因此可与LC3-II 配合反映自噬水平[21]。本研究结果显示,与正常组相比,模型组LC3-I 表达较高,LC3-II 表达下降,而 p62 表达上升,分别提示 LC3-I 转化为LC3-II减少和p62降解不足,由此推测,脾气虚时胃黏膜细胞的线粒体自噬水平降低,可能难以及时清除异常的线粒体个体,从而导致整个网络损伤。
综上所述,本研究认为脾气虚胃黏膜细胞线粒体结构和功能损伤与PINK1-Parkin 通路抑制所导致的线粒体自噬水平低下有关。
