DOX@CaCO3复合药物研制及在骨肉瘤中的应用效果*
2020-04-11李天博高磊王江宁
李天博, 高磊, 王江宁
首都医科大学附属北京世纪坛医院矫形外科(北京 100038)
骨肿瘤是发生于骨骼的恶性肿瘤。骨肉瘤作为骨肿瘤的一种,常在20岁以下年龄段发病,且患者的5年生存率很低,通过单纯的手术治疗,患者的生存率仅有20%左右[1-3]。因此,手术治疗联合化疗等手段成为骨肉瘤最重要的治疗手段之一,进而改善骨肉瘤患者的预后。顺铂、阿霉素、甲氨蝶呤等高效广谱抗癌药,对多种肿瘤具有良好的治疗效果[4-6]。然而,肿瘤组织对化疗药物的敏感性低,导致了化疗药物的疗效差;化疗药物本身毒副作用大、非特异性全身血液运输,造成了全身的毒副作用[7-8]。因此,提高化疗药物在肿瘤附近的敏感性和降低全身循环成为提高化疗药物在骨肉瘤治疗的关键所在[9]。近年来,纳米生物材料已经广泛应用于对肿瘤的诊断和治疗[10-14]。其中,纳米生物材料通过设计空隙结构,用于装载具有高毒性的化疗药物可以有效降低血液循环中的毒副作用,减少不良反应;此外,纳米药物通过高通透性和滞留效应(EPR),被动运输并滞留在肿瘤环境,在肿瘤微环境进行缓释化疗药物,进一步降低药物在体内积累形成的不良反应[15-18]。此外,通过对纳米药物的肿瘤微环境(酶、酸碱性、电荷)响应,从而控制药物的定点释放,达到对化疗药物的特异性给药的目的[19-20]。碳酸钙作为一种使用最广泛的无机纳米化合物,由于其具有高含钙量,已经作为补钙技广泛应用于医药、食品、生物技术等多个领域[21-23]。此外,通过不同的合成技术对碳酸钙的结构调控,可以使得碳酸钙具有了空隙结构,通过上载的方法,将化疗药物载入纳米碳酸钙中;此外,碳酸钙可以在酸性环境下分解作为药物载体后可在酸性环境缓释化疗药物。与正常的细胞及组织相比,骨肉瘤肿瘤组织会体现出比较低的pH值(5.5~6.8),通过在低pH环境的响应,实现酸响应从而可控释放药物。分解的钙离子作为补钙剂,减少骨质由于肿瘤形成的缺损。这种既能够降低化疗药物毒性,又能够减少钙缺失的治疗方案有望成为骨肉瘤治疗的新策略[24-28]。本研究于2018年11月至2019年8月,合成碳酸钙纳米颗粒用于包裹常用化疗药物阿霉素,通过对包裹药物的碳酸钙颗粒结构稳定性、体外细胞毒性、体内药物分布、体内肿瘤抑制等不同方面评价此纳米载药体系对骨肉瘤的治疗效果,希望可改善目前化疗药治疗骨肉瘤过程中的不良反应,减少患者痛苦,提升患者生活质量。
1 材料与方法
1.1 材料 体重约25 g,5~6周雄性BALB/c裸鼠(北京维通利华公司);鼠源骨肉瘤细胞K7(协和细胞库购买)。
1.2 方法
1.2.1 载药颗粒的合成 碳酸钙纳米颗粒的制备:碳酸钙纳米颗粒的制备,我们采用的是降温制备法,从而可控地合成粒径均一的碳酸钙。配置2 mol/L的氯化钙溶液,并取1.5 mL加入到反应瓶中,加入磁子之后,放置在冰水浴中,利用磁力搅拌器以600 r/min搅拌30 min,待溶液稳定后,以900 r/min加速搅拌溶液,并向其中缓慢滴加2.5 mL碳酸钠溶液(冰水溶液,1 mol/L),15 min后,向反应瓶中加入5 mL去离子水并停止搅拌终止反应,静置后用过滤瓶滤出沉淀。取上清液,加入15 mL 离心管中,以5 000 r/min离心转5 min,收集沉淀物。将沉淀物烘干备用。
载阿霉素碳酸钙纳米颗粒的制备:配制1 mol/L的DOX·HCl水溶液。精确称取上述碳酸钙烘干粉,利用去离子水配成质量浓度为5 g/L的纳米粒子分散液并调节其pH值至8.0。将1 mL DOX·HCl水溶液缓慢滴加到该碱性溶液中,边滴加边搅拌,避光室温下搅拌过夜。反应12 h后,通过对混合液13 000 r/min离心30 min收集沉淀物,弃上清液从而去除过量的DOX·HCl。将沉淀物利用冻干机冻干,制得复合药物冻干粉,即制得载阿霉素碳酸钙复合纳米药物 (以下简称复合药物)。
1.2.2 复合药物纳米颗粒的表征 通过透射电镜(TEM)测定复合药物的颗粒形貌来验证;通过粒度仪分析并获得复合药物纳米颗粒的水合粒径大小。
1.2.3 复合药物酸响应性的表征 配制pH值分别为5.2、6.8、7.2的缓冲溶液用于酸性响应的检测。称取相同质量的复合药物纳米颗粒,溶解于10 mL的水中并封装入透析袋中,然后完全浸入100 mL pH值为5.2、6.8、7.2的缓冲溶液中,置于37 ℃摇床中避光恒温震荡。待作用2 h后,通过UV-Vis外标法检测复合药物纳米颗粒在不同pH值下的药物的释放量,并绘制图谱。
1.2.4 细胞毒性验证 细胞毒性实验采用的是CCK8法。鼠源骨肉瘤细胞K7以104个/孔的数量接种到96孔培养板中,在二氧化碳培养箱中孵育24 h。配置不同含有药物的培养基,200 μL含药物的培养基。药物浓度分别为0.15、0.3、0.6、1.2、2.5、5、10 mg/mL,对照组加入与上述药物浓度相同浓度的游离DOX溶液,给药后共培育24 h。待孵育完全后,向孔内加入20 μL的5 g/L CCK8溶液,随后继续培养4 h。然后吸出所有培养基,每孔加入150 μL二甲基亚砜,震荡5 min后,检测490 nm处的吸光度值。
筛选上述半数致死率的浓度5 mg/mL,利用该浓度给定相同的药物,按照上述的培养细胞方式,将生长良好的鼠源骨肉瘤细胞K7以104个/孔的数量接种到96孔培养板中,在二氧化碳培养箱中孵育24 h。设定7组内部对照组,在每隔0、1、3、6、12、24、72 h向孔内加入20 μL的5 g/L CCK8溶液,随后继续培养4 h。然后吸出所有培养基,每孔加入150 μL二甲基亚砜,震荡5 min后,检测490 nm处的吸光度值。
1.2.5 动物模型构建及在体安全性验证 取18只BALB/C小鼠,向小鼠皮下注射100 μL鼠源骨肉瘤细胞K7悬液(约含细胞2.5×106个),制备皮下肿瘤模型。当平均肿瘤体积大约到达50 mm3时,随机分为3组,每组6只:DOX@CaCO3组实验组尾静脉注射含载药纳米微粒的PBS,DOX组尾静脉注射含游离阿霉素的PBS,PBS组尾静脉注射PBS,给药量以阿霉素5 mg/kg为标准。每4 d治疗1次,共治疗3次。每天测量并记录肿瘤大小和小鼠体重。
2 结果
2.1 纳米复合药物的合成验证 如图1-A所示:通过透射电镜观察可以得出,纳米复合药物的粒径70 nm左右的规则球状,通过灰度可以观察发现,纳米复合药物为实心球状,且分散均匀。将纳米复合药物溶解于水中,通过粒度仪检测其水合粒径发现,其水合粒径大小为98 nm(图1-B);较之于透射电镜所示,纳米颗粒的水合粒径有增加。
图1-C所示,在pH 7.2时,通过半透膜透过的药物含量极少,在72 h时,仅为负载量的12%,这是由于合成的复合药物表面存在微孔,长期的水溶液会使得极少量药物通过布朗运动扩散到水溶液中,从而通过半透膜透出;当pH 6.8 时,水中存在的H+可以对碳酸钙表面形成微弱的腐蚀作用,药物的最高释放量达到21.3%;当pH 5.2时,水中存在的H+提高了,碳酸钙的溶解效率提高,在72 h可以释放62.7%的DOX药物。
2.2 细胞毒性结果 在检测复合纳米药物体外可行后,验证药物的细胞杀灭效果。如表1所示,我们利用不同浓度的药物对细胞进行杀灭。药物作用时间为12 h时,载药纳米微粒与游离阿霉素杀伤骨肉瘤细胞K7半数致死率的质量浓度分别为2.6、4.5 mg/L;继续孵育细胞,作用时间至24 h时,载药纳米微粒与游离阿霉素均将骨肉瘤细胞杀死。此外,我们利用12 h的半致死率浓度,研究药物在不同时间段对细胞的杀伤作用。如表2所示,尽管在前24 h内游离的DOX比纳米复合药物致死率高,然而在到72 h,纳米复合药物比DOX致死率高。
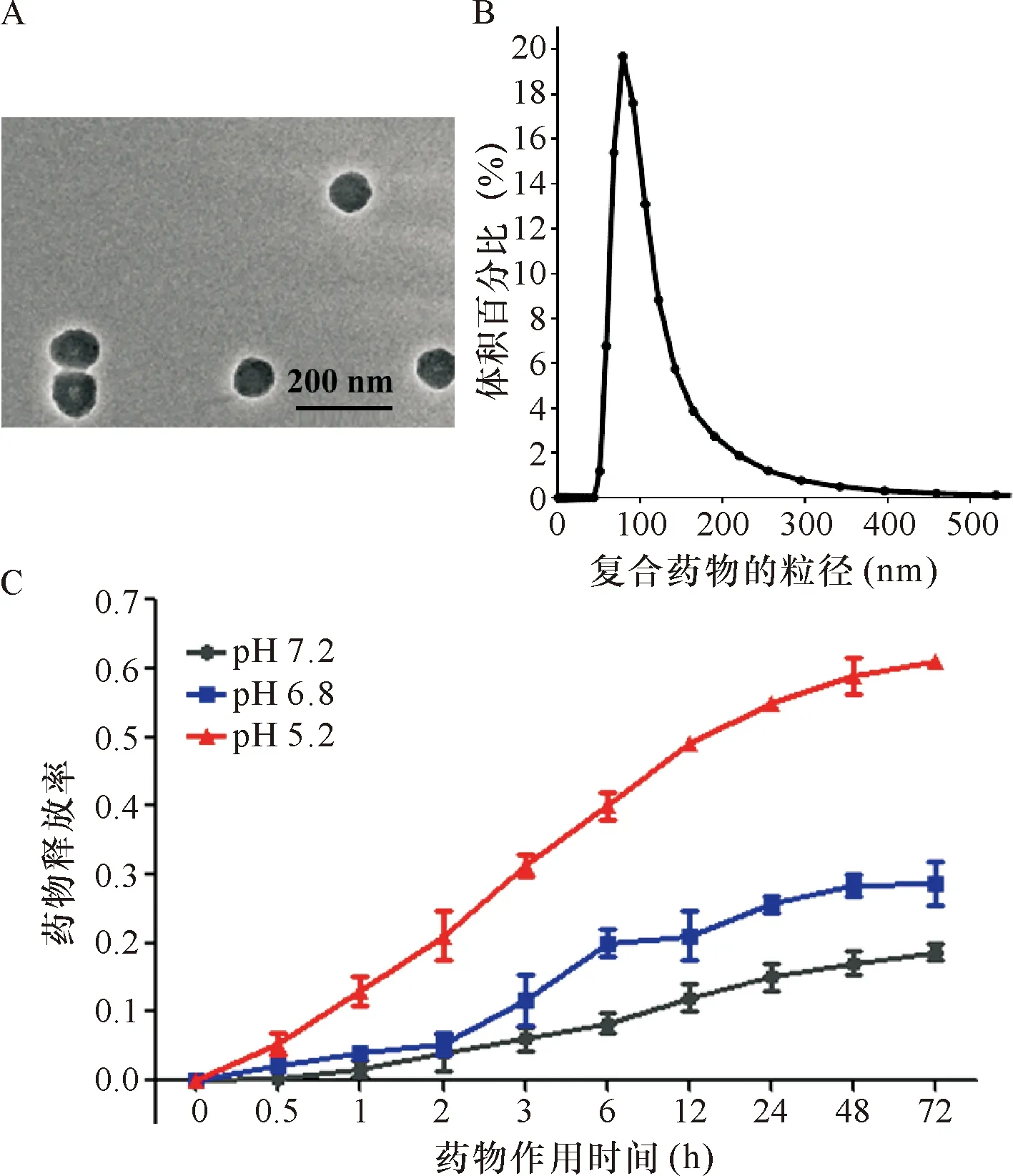
注:A:透射电镜示意图,复合药物呈现球状,控制粒径在100 nm左右;B:水合粒径示意图,复合药物的水合粒径与透射电镜展示的粒径相符;C: 复合药物在不同酸性环境pH 7.2、 6.8、 5.2 下药物的释放量
图1复合药物DOX@CaCO3的表征

表1 不同药物在不同浓度作用下骨肉瘤细胞K7的平均存活率 %

表2 不同药物作用时间下骨肉瘤细胞K7的平均存活率 %
2.3 肿瘤治疗实验结果 在活体动物中开展药物的治疗验证。荷瘤鼠构建成功后,分别设置3个组, 3组小鼠分别注射PBS、 DOX、 DOX@CaCO3开始治疗。如图2-A可见,经过治疗周期22 d后,PBS组肿瘤体积达(607±163) mm3,DOX组平均肿瘤体积达(514±173) mm3,DOX@CaCO3组平均肿瘤体积为(212±89) mm3。尽管DOX@CaCO3组对肿瘤具有治疗作用,但仍然具有肿瘤细胞存活。图2-A的模型动物没有进行手术切除直接注射药物,尽管肿瘤有一定程度的抑制,但是肿瘤还在继续生长,只能从生长速率判定肿瘤的生长效果。为进一步验证疗效,我们决定采用先手术,切除部分肿瘤后,留下较小的瘤块,再给药,如图2-B为药物治疗期间小鼠肿瘤体积变化,研究发现,整体给药后的小鼠肿瘤都在变小,DOX@CaCO3组复合纳米药物组减小的趋势明显。
3 讨论
骨肉瘤常发于青少年,术后化疗是目前骨肉瘤治疗最常见的方式之一。但化疗药物对骨肉瘤不敏感以及全身给药的毒副作用,为患者造成很大的负担[13]。盐酸阿霉素作为细胞周期非特异性抗肿瘤药,对多种肿瘤细胞均有杀伤作用[29]。然而,与大量的化疗药物相同,它对骨肉瘤敏感度低,且全身毒副作用也很大。近年来,新发展的复合纳米药物技术、即纳米载药系统为降低化疗药物毒副作用,提高药物对肿瘤的敏感度具有良好的作用。通过溶解或包埋等技术设计纳米载药材料,将化疗药物吸附或溶解在纳米颗粒内部或表面,通过纳米药物在体EPR作用将药物递送到肿瘤附近,实现了药物在肿瘤附近的缓释,从而缓解了药物在体的毒副作用。此外,纳米载体可以通过设计对肿瘤微环境进行相应,真正实验在肿瘤环境中药物释放的目的。目前常用的载药体系有脂质体、氧化硅等物质,然而这种物质不具备肿瘤微环境响应的特性,因此,我们利用了一种可以在酸性环境下溶解缓释药物的碳酸钙纳米颗粒开展进一步的研究。
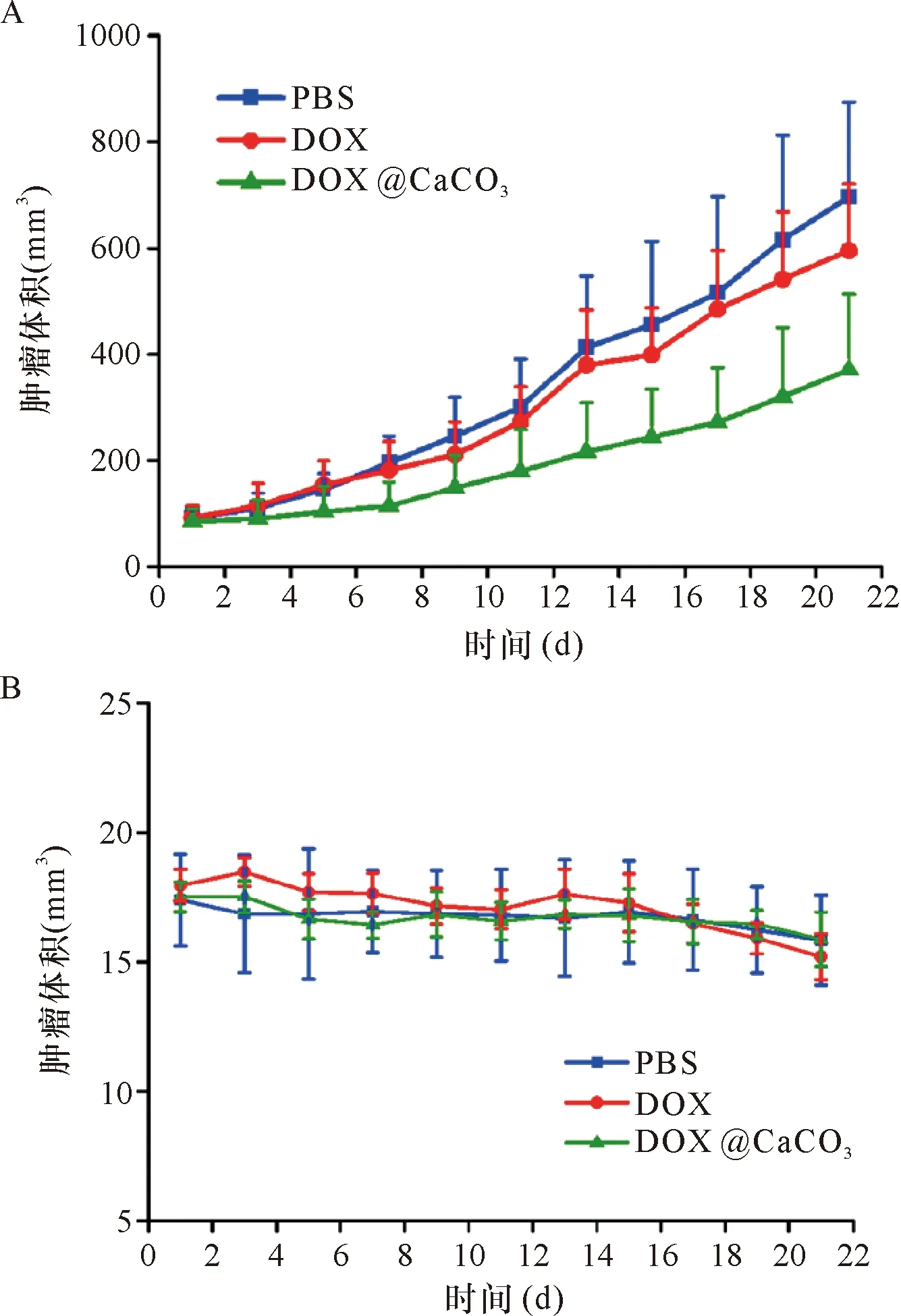
注:A:肿瘤体积变化(没有进行手术切除);B:肿瘤体积变化(进行了部分手术切除)
图2复合药物DOX@CaCO3、DOX·HCl与PBS药物在小鼠肿瘤处的疗效评估
在本次研究中,我们合成的碳酸钙纳米药物复合物能够实现化疗药物向骨肉瘤细胞呈递并且调控释放的目的。透射电镜观察显示,碳酸钙纳米药物具有形态规整的、均一的球状颗粒,粒径大小在70 nm左右。水合粒径的验证证明了纳米颗粒具有良好的水分散性,能够为纳米颗粒在溶液环境中酸性分解产生水膜。为了证明载药纳米微粒的稳定性,实验测量了不同pH值条件下复合纳米药物的药物释放水平,发现在常规pH值(7.2)条件下,复合纳米药物的缓释效率很低,只有自由扩散的部分药物;但随着pH值降低,载药纳米微粒的结构开始变得不稳定,在酸性环境下降解,研究表明,药物的释放量与环境中的酸度呈正相关。这样,载药纳米微粒就具备了微环境酸性降解的功能。在细胞层面,我们验证了复合纳米药物体系对骨肉瘤细胞具有长效杀伤作用,其在24 h内,半致死率低于游离的DOX药物,同时这也证明了游离DOX的毒副作用比复合纳米药物的毒副作用高。在72 h的缓释过程中,复合纳米药物明显优于游离阿霉素产生的肿瘤细胞杀伤作用。在体研究中,不论是直接治疗组,还是手术切除后化疗组,复合纳米药物都比游离的盐酸阿霉素药物对小鼠的肿瘤治疗具有良好的作用,结果表明相对于游离阿霉素来说,载药纳米微粒可明显减小游离化疗药物的系统毒性,提高其安全性。降低了化疗药物的全身不良反应。研究通过碳酸钙纳米颗粒实现了化疗药物的肿瘤部位,碳酸钙在肿瘤微环境中缓释药物可以提高化疗药物的利用率,并且降低了由化疗药物带来的不良反应,提高治疗效果。
在此次研究中所合成的复合纳米药物具有尺度均一,分散状态良好,且在肿瘤酸性微环境可控释放化疗药物的材料,通过体内、外实验证明,较之于游离阿霉素,碳酸钙纳米颗粒能够明显降低化疗药物在骨肉瘤治疗中的细胞毒性,提高DOX在肿瘤部位的高释放率和利用率,降低了化疗药物在机体带来的毒副作用。因此,我们相信这种复合纳米药物在骨肉瘤的临床化疗中具有很高的应用前景。
