ERK5对M1型巨噬细胞标志炎症因子iNOS、MCP-1表达的影响
2020-04-11管新竹王怡茹张一凡刘萍
管新竹,王怡茹,张一凡,刘萍
(上海中医药大学 附属龙华医院 心内科,上海 200032)
细胞外信号调节激酶5(extracellular-regulated kinase 5,ERK5,又称为MAPK7)是MAPK家族目前最后发现的成员,其基因位于17p11.2人染色体上,由816个氨基酸构成,是MAPK家族中最长的一员,是其他家族成员的两倍长度[1],激活时与其他细胞外信号调节激酶一致,遵从三级酶促级联反应,即MAPKKK-MAPKK-MAPK[2],其上游为MEK5,此激酶是ERK5的唯一上游激酶,过表达时对其他MAPK家族成员也无激活作用,对ERK5具有高度特异性[3].炎症反应是动脉粥样硬化(Atherosclerosis,AS)的重要病理机制之一,巨噬细胞主要极化为M1和M2两种亚型,这两种亚型对炎症的发展具有完全相反的作用:M1型巨噬细胞以高表达MCP-1 和iNOS等促炎物质为标志[4],具有促进炎症发展的作用,M2型巨噬细胞具有抗炎作用.AS中的巨噬细胞极化过程中由LPS和ox-LDL共同参与,故本研究欲以脂多糖(lipopolysaccharide;LPS)、氧化低密度脂蛋白(oxidized low-density lipoprotein;ox-LDL)联合诱导的M1型巨噬细胞为研究对象,探索ERK5抑制剂对M1型巨噬细胞模型中单核细胞趋化因子-1(monocyte chemo-attractant protein-1,MCP-1)和诱导型一氧化氮合酶(inducible nitric oxide synthase,iNOS)表达的影响.
1 材料与方法
1.1 材料
1.1.1 细胞
小鼠巨噬细胞株RAW264.7购于中国科学院上海生命科学研究院细胞资源中心.
1.1.2 试剂
ERK5抑制剂XMD8-92购于美国Selleck公司;DMEM高糖培养液和胎牛血清购于美国Hyclone公司;ox-LDL购于中国上海翊圣生物科技有限公司;LPS购于美国SIGMA公司;mRNA提取试剂盒购于中国上海海方生物技术有限公司;PCR反转录试剂盒和PCR反应试剂盒购于日本TAKARA公司,引物设计和合成服务由中国上海生工生物工程有限公司提供;PMSF、蛋白酶抑制剂、磷酸酶抑制剂和蛋白裂解液RIPA购于中国上海威奥生物科技有限公司;BCA蛋白浓度测定,超敏ECL化学发光试剂盒购于中国上海碧云天生物技术有限公司;Anti-MCP-1抗体和Anti-iNOS抗体购于美国Abcam公司;GAPDH购于美国Cell Signaling Technology(CST)公司;兔二抗购于中国上海arigo公司.
1.1.3 仪器与设备
美国Thermo Fisher公司超净工作台和细胞培养箱;芬兰Eppendorf公司紫外分光光度计和高速冷冻离心机;美国应用生物系统公司Applied biosystems 7500荧光定量PCR仪;美国Bio-tek公司酶标仪;上海勤翔科学仪器有限公司凝胶成像系统.
1.2 方法
1.2.1 细胞培养和分组
RAW264.7细胞常规复苏后,胎牛血清和DMEM高糖培养基配置成体积分数为10%胎牛血清的完全培养基,于体积分数为5% CO2、37 ℃的培养箱中常规培养,传至第2代时再进行造模与干预.分为空白组、模型组和模型+ERK5抑制剂组.参考文献[5],应用ox-LDL(质量浓度为10 μg/mL)+LPS(质量浓度为1 ng/mL)建立M1型巨噬细胞模型,ERK5抑制剂XMD8-92浓度为2.5 μmol/mL.
1.2.2 运用CCK-8法测定细胞活性
细胞培养同前,将对数生长期的细胞接种于96孔板,每孔1.0×104个,于37 ℃、体积分数为5% CO2的培养箱中培养24 h,XMD8-92提前1 h加入模型+抑制剂组中,1 h后吸弃上清,每组加入对应的干预培养基,于培养箱中培养24 h,吸弃培养基,加入体积分数为10%的CCK-8稀释液,放入细胞培养箱反应1 h,用酶标仪检测吸光度值,重复3次.
1.2.3 运用实时定量PCR检测MCP-1和iNOS mRNA 的表达
将对数生长期的细胞接种于6孔板中常规培养,每孔3.0×105个,至细胞生长至70%时分组,干预与培养方式同上,3 h后应用RNA提取试剂盒按说明书提取RNA,反转录试剂盒反转录RNA,条件为37 ℃ 15 min;85 ℃ 5 s.得到的样本应用于RT-qPCR检测,反应条件为95 ℃ 1 min;95 ℃ 3 s,58 ℃ 15 s,72 ℃ 30 s,共40循环.引物由上海生工生物工程有限公司设计并合成,引物序列(表1).应用2-ΔΔCT法对得到的数据进行数据分析.
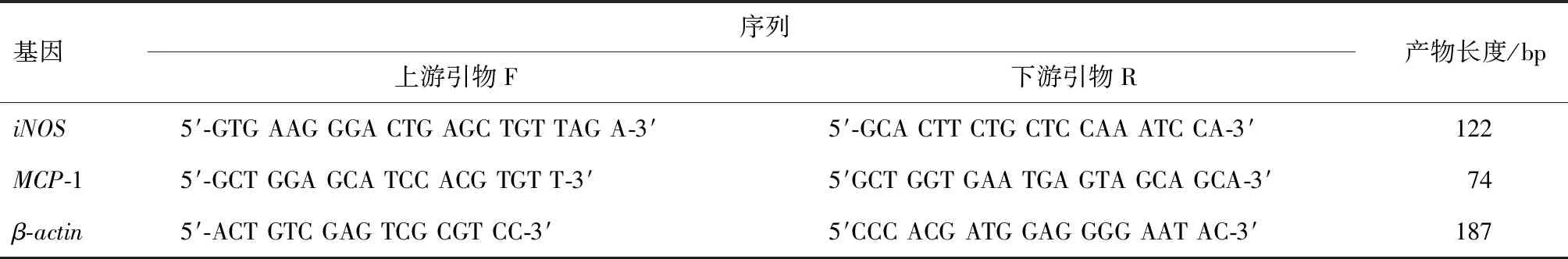
表1 RT-qPCR引物序列Table 1 Primer sequence of RT-qPCR
1.2.4 运用蛋白印记法检测各组MCP-1和iNOS的蛋白表达
细胞培养和分组情况同上,加入干预药物后,培养24 h后吸弃上清,PBS洗两遍,吸弃PBS,将蛋白酶抑制剂、磷酸酶抑制剂、PMSF和蛋白裂解液RIPA按比例混匀后加入培养皿内,用细胞刮刀刮下细胞,移入无菌无酶的1.5 mL EP管中,冰上裂解30 min,4 ℃,12 000 r/min离心20 min,上清即蛋白.用BCA试剂盒按说明书操作检测蛋白浓度,制备上样所需样本,每孔20 μg蛋白,质量分数为10%SDS-PAGE电泳,350 mA转膜1 h,BSA封闭1 h,一抗(iNOS以1∶250体积比稀释;MCP-1以1∶1 000体积比稀释)4 ℃孵育过夜,次日TBST洗膜,兔二抗(1∶2 000体积比稀释)室温摇床孵育2 h,TBST洗膜后ECL化学发光显影.用Image J分析各条带的吸光度值D,进行相对定量分析(蛋白相对表达量=目的蛋白/内参).
1.3 统计学分析
采用SPSS 23.0统计数据,数据以(均数±标准差)表示,采用独立样本t检验进行组间比较,P<0.05为有统计学差异.
2 结果
2.1 ERK5抑制剂对M1型巨噬细胞活性的影响
将CCK-8法所得D值进行计算(生存率=样本孔D值/空白组D值),得出的比值为细胞生存率.结果显示,ox-LDL和LPS联用会刺激巨噬细胞增殖,造模的基础上加入XMD8-92后,与模型组相比细胞的生存率下降,空白组细胞的生存率(1.00±0.08),模型组细胞的生存率(1.70±0.09),模型+抑制剂组细胞的生存率(1.43±0.04),各组间两两比较,有统计学差异(图1).
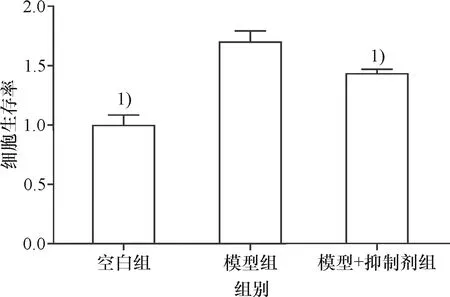
与模型组相比,1)P<0.01.
Compared with model group,1)P<0.01.
图1 LPS、ox-LDL和XMD8-92对细胞生存率的影响
Fig.1 Effect of LPS、ox-LDL and XMD8-92 on cell survival rate
2.2 ERK5抑制剂对M1型巨噬细胞MCP-1和iNOS mRNA的影响
造模后结果可见巨噬细胞MCP-1和iNOSmRNA表达增加,与空白组比较,有统计学差异(P<0.05);加入XMD8-92后,iNOS与MCP-1的表达均显著下调,与模型组比较,具有显著统计学差异(P<0.01),表明ERK5抑制剂可以抑制M1型巨噬细胞标志因子MCP-1和iNOS基因的表达(图2).

与模型组相比,1)P<0.01.
Compared with model group,1)P<0.01.
图2 各组细胞的MCP-1和iNOSmRNA的表达情况
Fig.2 The mRNA expression ofMCP-1andiNOSin each group
2.3 ERK5抑制剂对M1型巨噬细胞MCP-1和iNOS蛋白表达的影响
通过结果可知,模型组MCP-1、iNOS的表达较空白组显著提高,两组比较差异具有显著统计学意义(P<0.01);加入XMD8-92之后,MCP-1、iNOS的表达皆有不同程度的下调,与模型组相比,抑制剂组MCP-1的表达有统计学差异(P<0.05),iNOS的表达具有显著统计学差异(P<0.01).表明ERK5可以抑制M1型巨噬细胞标志因子MCP-1和iNOS蛋白的表达(图3).
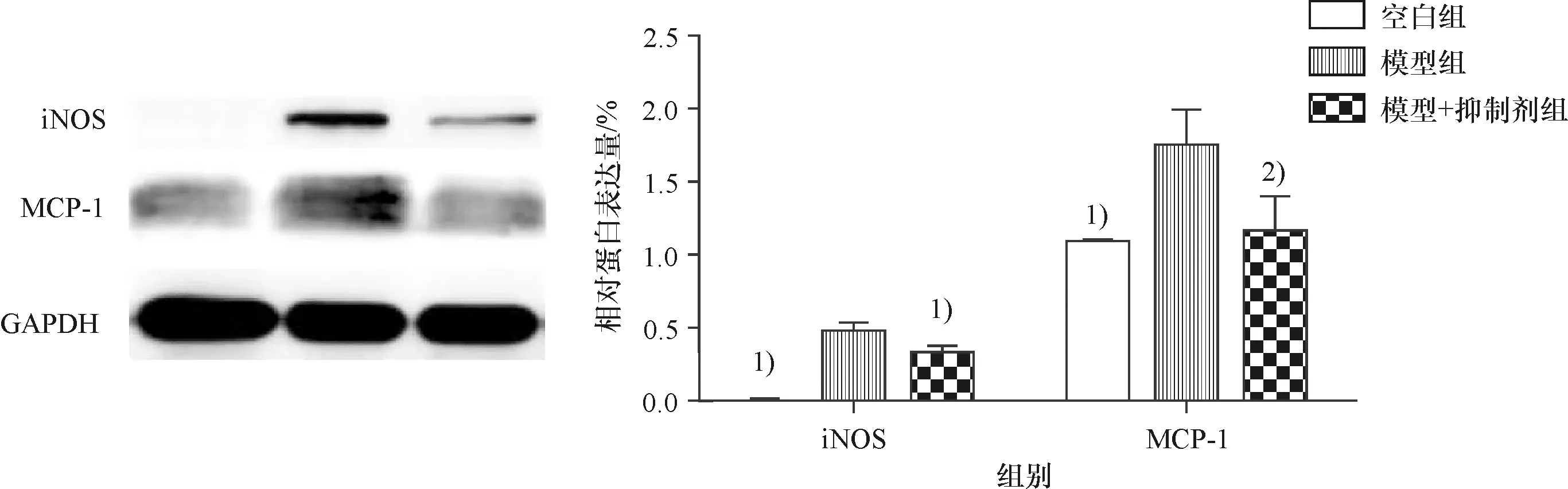
与模型组相比,1)P<0.01;2)P<0.05.Compared with model group,1)P<0.01,2)P<0.05.图3 各组细胞的MCP-1和iNOS蛋白的表达情况3 The protein expression of MCP-1 and iNOS in each group
3 讨论
巨噬细胞的可塑性和异质性强,在不同周围细胞因子和刺激因子的诱导下可以分化成完全不同功能的亚型,这种现象被称之为巨噬细胞极化.Toll样受体配体LPS和干扰素γ[6]、以及ox-LDL[7]可诱导巨噬细胞转化为促炎的经典活化巨噬细胞(M1型巨噬细胞);在白介素4、13的诱导下巨噬细胞可分化成抗炎的替代活化巨噬细胞(M2型巨噬细胞).AS中巨噬细胞不同的极化方向对疾病的发展具有干预作用,与具有争议的M2型巨噬细胞不同,目前认为M1型巨噬细胞对AS的发生和发展具有促进作用,加重斑块内的炎症反应,增强斑块的易损性.
活化后的M1型巨噬细胞会高表达iNOS、MCP-1等促炎细胞因子,并通过核因子κB(nuclear factor kappa-light-chain-enhancer of activated B cells,NF-κB)通路上调C反应蛋白[7],释放基质金属蛋白酶,降解细胞外基质,使斑块处纤维帽变薄,从而降低斑块的稳定性[8],增加心血管事件发生率.M1型巨噬细胞的标志性因子MCP-1可上调AS相关细胞的粘附和迁移能力,具有促进脂肪条纹形成的作用[9-11];另一标志因子iNOS可诱导一氧化氮的分泌,具有促进炎症进展,加重AS的作用[12-13].ERK5信号通路具有向细胞核内传导刺激信号,调控包括巨噬细胞、血管平滑肌细胞等多种细胞的增殖、分化和凋亡的功能[14],本课题组前期研究发现ERK5抑制剂可以通过调控胞葬相关的信号分子的表达,干预巨噬细胞的胞葬作用[15].有研究显示,ERK5特异性敲除的小鼠与未敲除小鼠相比较,其腹腔巨噬细胞极化的差异具有统计学意义[16].XMD8-92作为常用的ERK5的抑制剂,可以帮助研究在ERK5失活状态下,巨噬细胞各炎症因子表达的情况[15].NF-κB是炎症反应中的重要环节,对包括MCP-1、iNOS在内的多种炎症因子具有调控作用,ERK5 作为NF-κB的上游,对其有调控作用[17].本次研究,结果中ERK5抑制剂对ox-LDL和LPS联合诱导的M1型巨噬细胞亚型的细胞活性有显著抑制作用,并可以显著下调M1型巨噬细胞的标志性信号因子MCP-1和iNOS的表达,说明阻断ERK5激酶的表达可能可以通过调控NF-κB,抑制M1型巨噬细胞炎症因子的表达,控制炎症进展.极化是一个动态过程,巨噬细胞极化的方向是M1型巨噬细胞和M2型巨噬细胞数量的相对多少决定的,故ERK5对巨噬细胞极化方向的干预作用还需要进一步深入研究.
