硫唑嘌呤不良反应文献分析*
2020-04-11吴逢波
杨 霞,肖 敏,吴 斌,吴逢波
(四川大学华西医院,四川 成都610041)
硫唑嘌呤(azathioprine,AZA)为甲基咪唑替代6-巯基嘌呤(6-MP)结构中的氢原子和硫原子所形成的非特异免疫抑制剂,在体内通过抑制淋巴细胞的增殖,发挥免疫抑制作用[1],广泛应用于移植术后的免疫抑制治疗及各类免疫性疾病如系统性红斑狼疮、炎症性肠病、类风湿关节炎等。硫唑嘌呤常与糖皮质激素和(或)其他免疫抑制药物联用,但随其广泛应用,相关药品不良反应(ADR)报道也逐渐增多。本研究中基于文献报道分析了硫唑嘌呤的ADR,旨在为临床合理用药提供参考。
1 资料与方法
1.1 文献检索策略
以“硫唑嘌呤”和“不良反应”或“不良事件”或“安全性”为主题词,对中国期刊全文数据库(CNKI)、万方数据库和中文科技期刊全文数据库(VIP)进行检索,各数据库检索时限均为建库至2019年7月。
1.2 纳入与排除标准
纳入标准:主要干预措施为硫唑嘌呤,包括ADR报告(A类)和临床研究(B类),其中B类包括随机对照试验、非随机对照研究及病例观察报告。
排除标准:干预措施虽以硫唑嘌呤为受试药物,但合并使用其他药物,无法判断ADR归属;单一分析硫唑嘌呤引起某一特定ADR;因ADR分析不能提供足够信息以供评价。
1.3 文献筛选与数据提取
文献筛选和数据提取均由2位研究人员独立进行,交叉复核,必要时联系原文作者核实相关信息。若存在争议则协商结局或由第3位研究员仲裁。按事先设计好的资料提取表格提取纳入文献资料,主要包括患者原患疾病,硫唑嘌呤用药情况,ADR患者的性别、年龄及有无过敏史等情况,ADR出现时间、类型、处理及转归等。
2 结果
2.1 检索结果
共检索到相关文献627篇,剔除重复文献158篇,通过阅读题目、摘要及全文,根据纳入和排除标准,最终纳入98篇文献。其中A类42篇,B类56篇(病例观察报告13篇,对照研究43篇)。
2.2ADR情况
ADR例数:98篇文献共有2 464例患者,ADR821例。其中A类(42篇)文献共有患者55例,发生ADR 55例;B类(56篇)文献共有2 409例,发生ADR 766例(31.78%)[1];其中43篇对照研究共报道449例ADR,13篇回顾性研究共报道317例ADR。
ADR患者性别、年龄分布:结果见表1。因B类文献仅提供受试对象的性别和年龄分布,未提供发生ADR患者的性别和年龄分布,故仅分析纳入A类文献患者年龄和性别分布。A类文献(42篇)中,有1篇文献未提及患者的性别和年龄,其余文献中ADR患者男24例,女30例,男女比例为1∶1.25;年龄10~78岁,最多发生于31~49岁。硫唑嘌呤主要用于治疗各种免疫相关疾病,B类(56篇)文献中提及平均年龄分布的文献43篇,平均年龄为31~59岁的文献35篇(81.40%),提示应更重视硫唑嘌呤在此年龄段患者应用中的监测。
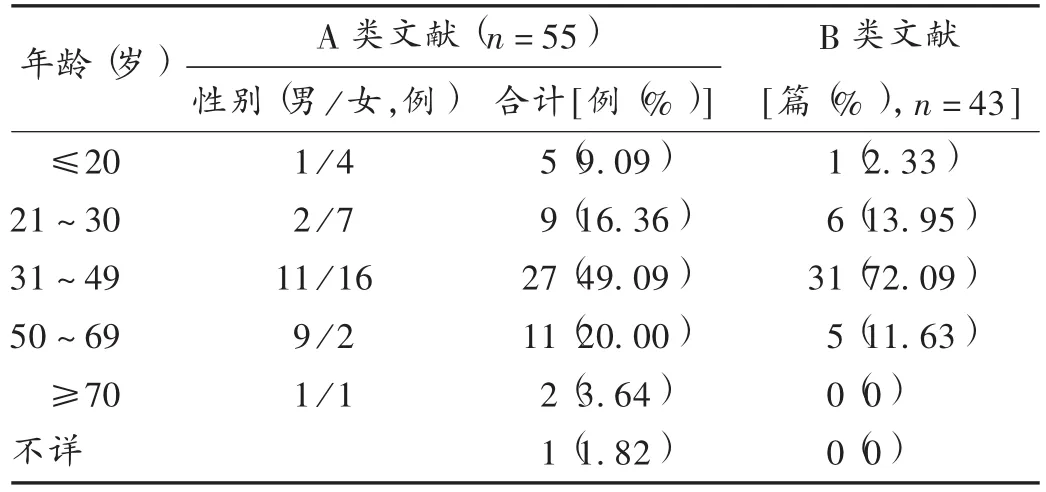
表1 硫唑嘌呤不同年龄段ADR患者分布
ADR涉及系统:硫唑嘌呤ADR涉及全身多个系统/器官,详见表2。A类文献报道的ADR主要集中于血液系统(骨髓抑制、粒细胞缺乏、白细胞减少、再生障碍性贫血)、皮肤(脱发)。B类文献报道的ADR主要集中在消化系统(胃肠道反应如恶心、呕吐、肝功能异常、胰腺炎)、血液系统(白细胞减少、粒细胞减少、骨髓抑制)、全身反应(头晕头痛、发热、感染),以及皮肤(脱发、皮疹、过敏反应)。A类文献报道的ADR涉及系统相对较窄,主要与硫唑嘌呤最易引发的血液系统相关,该类ADR相对较严重,临床医师较重视且易判定。提示将来硫唑嘌呤临床使用过程中,不应局限于监测血液系统相关的ADR。
因ADR死亡患者情况:A类文献55例ADR中,有13例死亡(23.64%),包括因白细胞减少引起感染、粒细胞缺乏致感染各2例,急性白血病导致死亡1例,骨髓抑制引起严重感染3例,再生障碍性贫血引起死亡5例。详见表3。
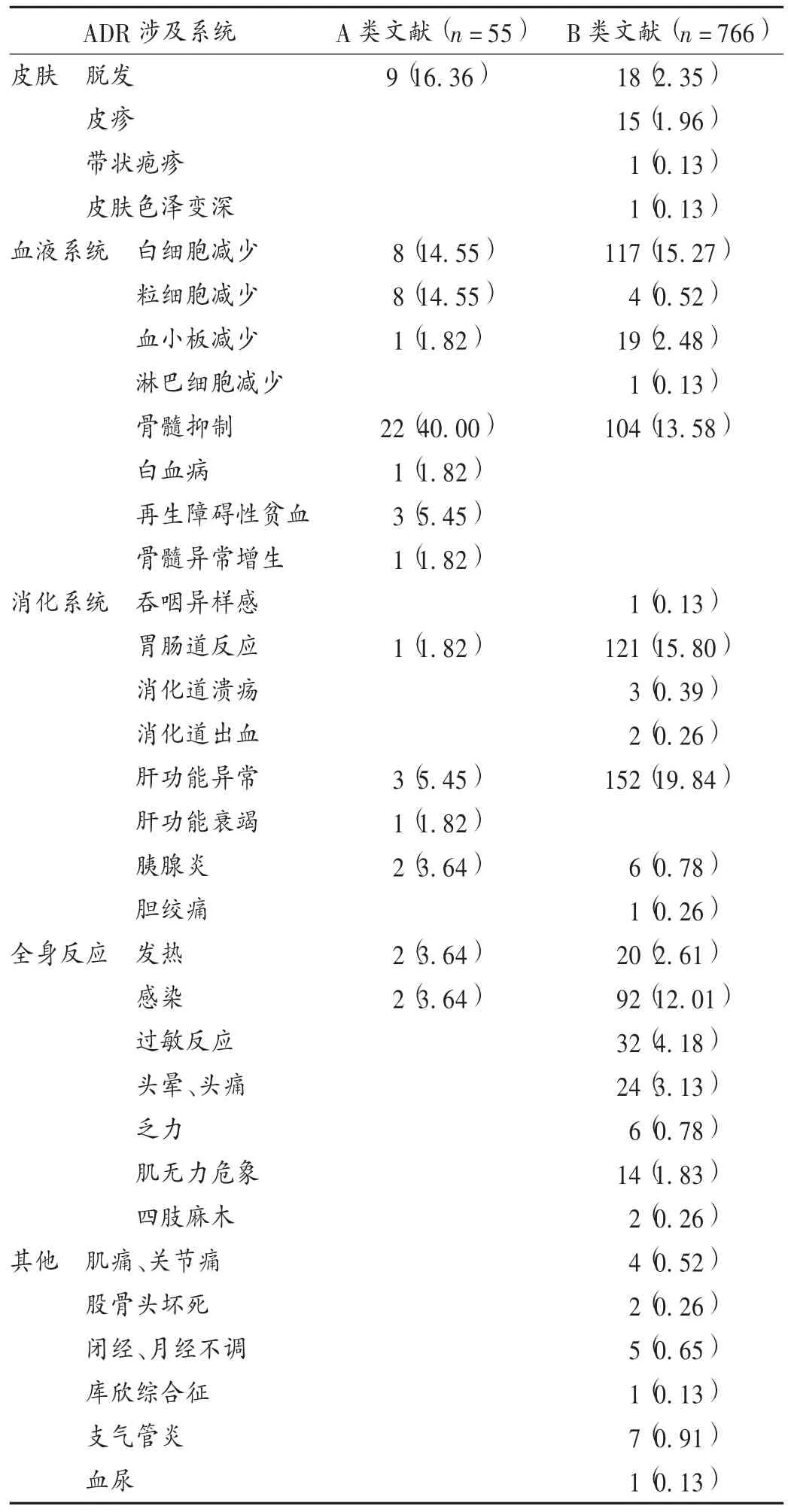
表2 硫唑嘌呤片ADR涉及系统[例(%)]
2.3 发生ADR患者基础疾病分布
结果见表4。A类文献报道的ADR患者中,原患疾病最多的为肾病综合征,其次为系统性红斑狼疮、溃疡性结肠炎、重症肌无力、天疱疮。B类文献所报道的ADR患者中,排前5位的原患疾病依次为炎症性肠病、克罗恩病、视神经性脊髓炎、溃疡性结肠炎、重症肌无力。

表4ADR患者基础疾病分类[例(%)]
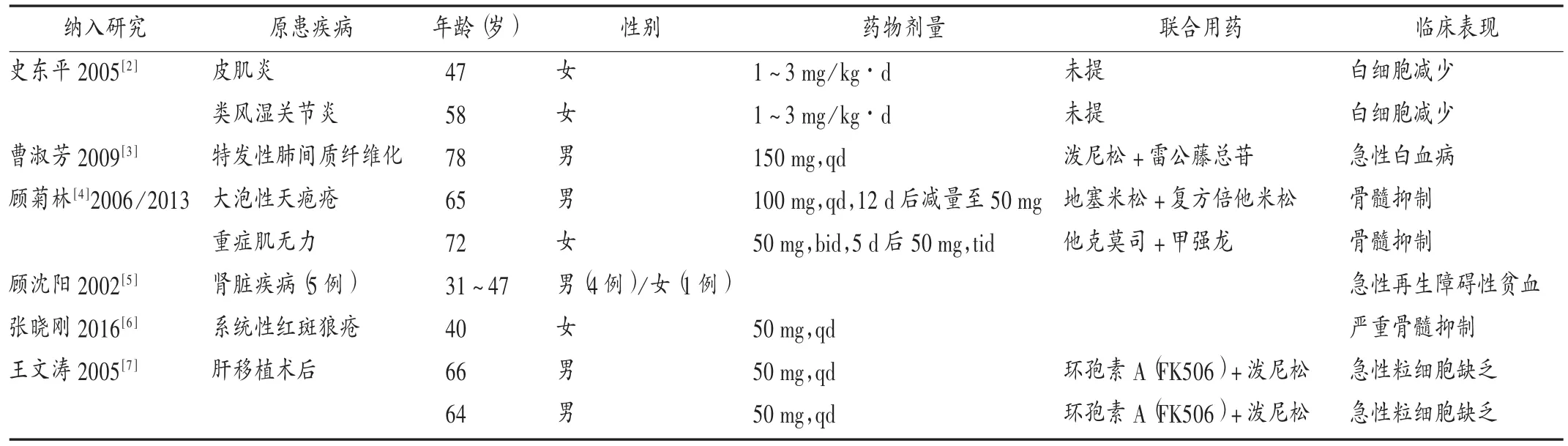
表3 硫唑嘌呤ADR死亡患者情况
3 讨论
硫唑嘌呤为临床常用免疫抑制剂,通过干扰嘌呤代谢的所有环节,抑制嘌呤核苷酸的合成,进而抑制细胞DNA和RNA及蛋白质的合成。硫唑嘌呤主要应用于急性淋巴细胞白血病、器官移植、炎症性肠病及自身免疫性疾病,尤其在炎症性肠炎的药物治疗中,硫唑嘌呤不可替代,其合理使用备受关注[8]。
硫唑嘌呤所致ADR种类繁多,轻重程度不一,导致患者停药的概率高达9%~40%[9-10],其中常见类型包括血液系统损伤、肝损伤、胃肠道功能紊乱、感染等。硫唑嘌呤ADR主要与硫代嘌呤甲基转移酶(TPMT)的活性和遗传多样性有关[11-12]。TPMT是硫唑嘌呤/6-MP代谢的关键酶,可将6-MP及硫唑嘌呤甲基化为无活性的代谢产物6-甲基巯基嘌呤(6-MMP),同时也能影响6-硫鸟嘌呤核苷酸(6-TGNs)等活性代谢产物的生成[13]。当TPMP活性降低,6-TGNs主要通过次黄嘌呤鸟嘌呤磷酸核糖基转移酶途径代谢生成,将明显增加ADR发生[14]。当TPMT活性过高时,6-TGNs生成减少,不能达到药物治疗目的[15],且增加6-甲基巯嘌呤核糖核酸(6-MMPR)的生成,引发肝脏毒性反应[16]。硫唑嘌呤治疗前行TPMT活性检测能减少血液学毒性反应的发生风险[17],英国皮肤学会推荐所有患者接受硫唑嘌呤治疗前进行TPMT活性测定[18]。故临床患者使用硫唑嘌呤前可考虑检测TPMT活性,根据基因检测结果选择最佳用药方案。
硫唑嘌呤ADR死亡病例多因骨髓抑制且免疫力低下引起全身感染治疗无效而死亡。临床患者在接受硫唑嘌呤单独治疗或联用其他免疫抑制药物(如糖皮质激素类),由于机体处于免疫抑制状态,因此对于细菌、真菌和病毒感染的易感性增加[18]。这类患者多合并骨髓抑制状态,白细胞、粒细胞等显著降低。一旦引起感染,患者治疗难度增加,住院时间显著延长且预后较差,严重情况可引起死亡。硫唑嘌呤引起的骨髓抑制通常可逆,故临床应密切监测血常规,患者一旦出现白细胞降低、粒细胞减少应及时停药并给予对症治疗。
本研究也存在局限性。由于本研究是二次研究,原始研究文献未对ADR的严重情况进行分析,同时硫唑嘌呤应按体质量给药但原始文献中未描述患者体质量;本研究仅检索了中文数据库,未对国外数据库进行检索分析;硫唑嘌呤临床多与其他药物联用,其他药物可能影响ADR的判断。因此建议,临床研究过程中应加强ADR监测,应充分报道ADR情况;硫唑嘌呤在临床使用前可考虑进行TMTP基因检测,医护人员在用药全过程应密切观察,一旦发生ADR,应立即采取措施;构建硫唑嘌呤ADR信号检测和预警模型。
