新型冠状病毒肺炎疫情下药物临床试验机构管理策略探讨
2020-04-11骆王敏尚尔宁虞燕霞
陈 诚,骆王敏,尚尔宁,虞燕霞
(南京医科大学附属苏州医院·苏州市立医院药物临床试验机构,江苏 苏州215002)
2019年底,新型冠状病毒肺炎(简称新冠肺炎)暴发后,全国30省市及地区相继宣布启动重大突发公共卫生事件一级响应。截至2020年2月23日24:00,全国累计报告确诊病例77 150例[1]。虽然目前国内确诊病例数有下降趋势,但新型冠状病毒在全球范围仍在不断蔓延[2]。因此,尽快开发有效的防治药物、积极开展药物临床试验是防控疫情蔓延的有效措施[3]。在中国临床试验注册中心网站和美国临床试验注册中心网站检索,2020年1月23日至2月16日与新冠肺炎相关的临床试验达160多项,中国有102家单位参与了这些试验项目。医疗机构临床试验能力水平直接决定着临床试验的进展速度和数据质量,加强新冠肺炎疫情期间临床试验机构管理,保障各项临床试验有序开展,可为公共卫生的各项决策提供有力证据和支撑[4]。现就新冠肺炎疫情下药物临床试验机构管理的改进策略探讨如下。
1 完善临床试验组织管理规范
1.1 药物临床试验机构办公室
在机构主任的领导下,由药物临床试验机构办公室(简称机构办)主任统一负责管理疫情防控期间各项工作,原则上尽量减少现场办公和人员聚集,同时安排机构办人员轮流上班,保证每日线上问题的及时答复,受试者取药,药物快递的收发工作,必要的质控工作等。邀请医院感染管理科专家对机构办开展全员防控知识培训,做到根据工作的不同需求,选择适宜的个人防护,会正确掌握防护衣物穿脱流程[5]。每日安排清点防护用品储备数量并记录。
1.2 专业组
各专业组主要研究者(PI)对目前在研项目进行全面梳理,根据方案内容,与申办方就可能出现的方案偏离、受试者随访困难等情况作出相应的预判,如需修改方案,及时报伦理委员会审核。研究者尽可能利用电话或互联网平台与受试者保持联系,了解受试者目前所在地及其本人的情况,及时收集受试者的相关检查报告、合并用药等,判断其可否继续参与临床试验。
2 加强临床试验人员管理
2.1 长期在院人员
长期在院人员是指办公地点设置在医院,需要在院处理各项工作的人员,如机构人员、研究者、临床协调员(CRC)等。他们在院工作时间较长,对医院其他工作人员的影响较大,需要确保了解、掌握其人员的健康情况。外地返回本地者需在家隔离14 d才能来院工作,来院后需每日上班后、下班前各测量体温1次,汇报身体健康情况,检查防护用品(如口罩、帽子)穿戴情况,并做好记录。在院工作期间,如出现发烧或其他疑似症状,应及时到发热门诊就诊,及时报告PI、机构办公室主任,再按要求上报医院有关部门。
2.2 短期来院人员
短期来院情况包括受试者随访、临床监查员(CRA)来院监查,申办方、合同研究组织(CRO)、临床机构管理组织(SMO)公司从业人员来院递交文件资料或办理业务,以及快递人员收发药物等。非紧急事宜应尽量选择电话或互联网平台进行沟通。所有来院人员需提前1 d与机构办联系,填写《来院人员登记表》,包括来院原因、个人健康情况、有无疫区居住史和旅行史、有无疫区人员接触史,机构办综合考虑人员来院的必要性及其自身健康状况,给出是否同意其来院的答复。如同意其来院,应约定来院时间,嘱佩戴口罩,做好防护工作。目前我院在研临床试验项目共41项,2020年1月30日至2月20日机构办共接待外来人员40人次(详见图1)。日均接待外来人员1.82次,约为疫情前日均接待人次的1/7,较好地将现场接待工作转变为线上处理工作。

图1 疫情期间机构办统计的每日来院人次
3 创新临床试验项目管理
3.1 受试者访视
访视流程:详见图2。
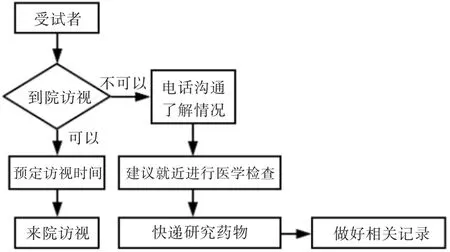
图2 受试者访视流程
必须到院访视的受试者:访视前应充分沟通,了解其个人情况,如身体状况(是否有发烧、咳嗽、呼吸困难等症状)、疫区居住史或旅行史、密切接触情况等,并做好记录。研究者根据项目情况,精确安排其到院时间,避免出现多个受试者在同一时间到院随访,以减少人员的聚集和流动。受试者到院访视必须佩戴口罩,进院必须配合志愿者测量体温,体温正常方可进行访视。
不便到院访视的受试者:仍然应先进行沟通,了解其不能到院的原因。研究者需要对受试者进行电话或网络随访,详细记录随访过程,如本次随访涉及医学检验检查的内容。可建议受试者在当地医院进行检查并保留相关资料,如需要使用研究药物的,可采用快递药物的方式。对于无法完成随访内容的,应如实记录并报备。

图3 受试者取药流程
3.2 中心药房取药
受试者直接取药:访视当天如需要取药,应提前与机构药物管理员预约取药时间,由CRC或研究护士凭处方至药房取药。若受试者预计下次访视时不能完成取药,需要发放超过1个访视周期的药品数量,应由研究者出具情况说明,例如不能取药原因、下次何时可以到院、药品数量计算,并告知受试者具体服用注意事项。药品管理员将受试者取药情况及时通知申办方,对于储备量不足的药品同时申请发药。
家属代领药物:本地的受试者因年龄大、出行不便等原因不能到院而电话随访的,可由家属代领研究药物。研究者同样需要出具材料,说明以其他形式发药的原因和具体的发药情况,并通过电话告知受试者发药品种、数量及服用记录要求。如果有需要特殊储存的药物,应告知代领人保证特殊运输储存方式(如冷链运输)。
快递药物:对于本地或外地受试者不便取药或代领的,可选择快递。机构办审核并保留物流公司的相关资质,物流公司必须对冷链药物提供过程温控记录,如无过程温控必须由申办方出具药物稳定性报告,并作出责任声明。CRC或研究护士与机构药物管理员一同对药物进行查对、邮寄,详细记录邮寄药物的相关信息。研究者电话告知受试者寄出时间、药物品种、数量等,嘱咐受试者受到药物后及时反馈,可拍照记录、保留快递凭据。
受试者取药流程:详见图3。疫情前,受试者取药均以直接取药的方式在药房领取。对疫情期间受试者的取药方式进行分析发现,直接取药占比为36%,其他形式取药如家属带领(36%)、快递寄送(21%)等占比之和已超过直接取药的占比。对无法来院取药的受试者(占比7%),在保障其用药安全的前提下,尽量考虑不让其因为无法继续用药而导致脱落。
3.3 机构质控
机构办需及时了解疫情期间项目进度,对于受试者访视较多的项目,应安排必要的机构质控[6]。质控人员提前通知PI质控时间,到科室质控时需佩戴医用外科口罩、帽子,必要情况下穿隔离衣、戴护目镜。除常规质控内容以外,要重点检查研究者、受试者、CRC及CRA等来院人员情况记录,研究者与受试者的沟通记录,受试者访视、检查、发药的特殊安排,伦理委员会报备情况等,在确保防疫安全工作的基础上,有序开展临床试验各项工作。
3.4 严重不良事件(SAE)处理
对于疫情期间发生SAE而又无法到院就诊的受试者,应告知其及时就近就医,若需转诊,尽量就近转诊,与研究者及时联系并接受转诊建议。SAE按照非工作日的上报流程上报,相关资料以邮件形式发送至机构/伦理相关人员,并在研究者文件夹中保留原件材料。对于涉及出现发烧、咳嗽、呼吸困难等与新冠肺炎症状类似的受试者,应到医院发热门诊进行检查判断是否为疑似病例,再由研究者根据地域情况判定。一般来说,居家隔离不视作SAE,但需要在医院隔离观察的受试者应视作SAE,并在24 h内上报。相关流程详见图4。

图4 新冠肺炎疑似受试者SAE报告流程
4 改进临床试验流程管理
立项资料提交:临床试验新项目立项材料可通过电子邮件形式发送至机构办邮箱,审核结果或修改内容也将以电子邮件形式反馈。立项材料审核通过后,纸质版递交时间另行通知。
项目启动和入组:目前未启动的项目暂不启动,在研项目未涉及危及生命的情况,不建议筛选入组新的受试者。
项目各阶段资料审查:项目合同审查、人类遗传办公室批件审查、启动会资料审查、分中心小结、中心关闭均通过线上系统进行。
5 完善药物临床试验信息系统
为减少人员聚集,避免受试者随访困难,可利用互联网平台和信息技术手段实现远程办公和远程访视[7]。我院采用We Trial临床研究一体化云服务平台,可在线对临床试验各个环节进行监管。药房和资料室的温控系统设置手机用户端,超温设有微信报警,保障试验药物的安全性。研究者和受试者可通过医疗专用设备进行高清视频对话,研究者可在系统平台随时查看病历数据、影像资料并提供在线诊治。
6 结语
临床试验机构管理涉及人员培训、质量控制、数据采集与管理、保护受试者权益等各个方面[8],在疫情特殊时期更考验临床试验机构的管理能力和水平。因此,临床试验机构既要做好疫情防控,保障临床试验受试者、从业人员的健康安全,又要保证临床试验项目有序开展,在规定时间内保质保量的完成。
