基于不同激素组合的紫丁香成熟种子组培诱导研究
2020-04-09王爱芝王清君刘运伟沈海龙
王爱芝 王清君 刘运伟 沈海龙
摘要: 以紫丁香成熟种子为外植体,采用不同激素组合培养基进行组培诱导试验的结果表明:采用中间切割方式的种子萌发率较高,最高可达59.72%;NAA与BA组合诱导丁香种子效果较好,NAA0.1 mg/L+BA1.0 mg/L的诱导率可达88.89%,MS+BA3.0 mg/L为顶芽和带芽茎段的最适增殖继代培养基;茎芽在试管内、外生根时间分别为20天和4~ 6周,生根率均为100%,紫丁香成熟种子组织培养试验取得成功。
关键词: 紫丁香; 成熟种子; 生长激素; 组织培养
中图分类号: S 685. 26, S 723. 1 + 32. 6 文献标识码: A 文章编号:1001 - 9499(2020)01 - 0001 - 05
紫丁香(Syringa oblata),木犀科丁香属,落叶灌木或小乔木,树高可达4~5 m,花期为4~5月,花冠紫色,蒴果扁形[ 1 - 2 ]。紫丁香具有花繁、叶茂、香浓、适应性强的特点,特别耐寒、耐旱,亦稍耐荫,是一种优良的观花树种,也是一种良好的蜜源植物[ 3 - 5 ],具有很高的景观价值、经济价值和生态价值。紫丁香有多种繁殖方法,包括播种、扦插、嫁接、分株、压条、组培等,其中,组织培养技术在丁香繁殖中广泛采用[ 6 - 22 ]。当前,丁香属植物组培研究的外植体材料主要采用根尖、茎段、茎尖、休眠芽、幼叶、叶柄、幼花序轴等,但以种子作为外植体的研究尚未见报道。本研究利用紫丁香成熟种子为外植体,利用离体扩繁的手段,实现了紫丁香树木改良,为进一步优化丁香属育苗方式、完善丁香属良种快繁技术体系提供理论依据,进而推动丁香属良种快繁产业化发展。
1 试验材料与方法
1. 1 试验材料
试验材料采用紫丁香成熟种子,采自位于哈尔滨市的东北林业大学(地理坐标:126°63′E,45°72′N)校园逸夫实验楼对面,文管楼东侧1株20年生紫丁香树。该树生长状况良好,其花色与校园内其它紫丁香树相比,花色更为纯正。2018年10月种子成熟时,从树冠上部、中部、下部随机采集成熟紫丁香蒴果,搓掉果皮,去掉干秕粒,将600粒干净种子装入塑料夹链袋,封口存放于实验室4 ℃冰箱中,供试验使用。试验试剂为H2O2溶液、吐温20、萘乙酸(NAA)、吲哚丁酸(IBA)、细胞分裂素BA、蔗糖、琼脂等。
1. 2 试验方法
1. 2. 1 种子质量检验
发芽率是检验种子播种品质重要指标,为保证试验所用的紫丁香成熟种子质量,首先对种子进行发芽率检验。2019年3月,随机取90粒种子,用清水浸泡3天,取3个培养皿,皿中均匀平铺薄层脱脂棉,剪与培养皿等大的圆形吸水纸,平铺在脱脂棉上。将泡好的种子均匀摆放在吸水纸上,每个培养皿随机放30粒种子,3次重复。种子用蒸馏水润湿后,将培养皿放入培养箱内。培养条件为:光照16 h/黑暗8 h,光强2 000~3 000 lx,温度25±2 ℃,湿度70%~80%。每天观察发芽情况,计算种子发芽率。
1. 2. 2 种子初代诱导培养
初代诱导培养基采用MS基本培养基,激素采用生长素NAA,IBA和细胞分裂素BA。NAA,IBA均采用0,0.1,0.5,1.0 mg/L 4个浓度水平,BA采用0,1.0,3.0,5.0 mg/L 4个浓度水平,添加蔗糖20 g/L、琼脂6 g/L,使pH=5.8。从冰箱中取出紫丁香种子,清水浸泡3天后接种。接种前,用75 %酒精表面灭菌30~60 s,然后在10 %的H2O2溶液中滴加2~ 3滴吐温20,搅拌消毒10 min,然后在超净工作台下用无菌水冲洗干净。接种采用完整种子、两端切和中间切3种切割方式,每种方式接种100粒,水平接种于成熟种子的初代诱导培养基上,调查不同切割方式下的种子萌发时间、萌发率及生长情况,选择最优切割方式,做初代诱导培养试验,确定最适激素组合。
1. 2. 3 种子继代增殖培养
继代增殖培养基采用MS基本培养基,激素采用NAA和BA。NAA采用0和0.1 mg/L 2个浓度水平,BA采用1.0和3.0 mg/L 2个浓度水平,添加蔗糖20 g/L,琼脂7 g/L,使pH=5.8。取初代培养诱导得到的无根茎芽,剪取其顶芽和1 cm长的茎段,分别以垂直和水平的方式,接种于继代增殖培养基上,每个处理接种20个外植体。调查不同激素组合下成熟种子不定芽诱导率、增殖系数和生长情况,以及顶芽和带芽茎段的培养生长情况,选择继代增殖培养最适激素组合。
1. 2. 4 茎芽生根调查
生根率试验分为试管内、外生根2项试验,每项试验分别处理200个无根茎芽。(1)试管内生根。本试验的生根培养基采用1/2MS+IBA 1.0 mg/L +2%蔗糖+0.6 %琼脂,使pH=5.8。将增殖培养得到的紫丁香茎芽(高2 cm以上)切下,垂直转接于生根培养基上培养。(2)试管外生根。将紫丁香组培茎芽(高2~5 cm)扦插到纯草炭:珍珠岩=1:1的基质中,叶面喷水,在组培苗驯化室内培养。分别调查试管内、外生根时间和生根率。
2 结果与分析
2. 1 种子质量检验
按照试验设计进行发芽率试验,观测1周后,发现种子表面有发霉现象,用75 %的酒精擦洗种皮,换床培养。经观察,发芽试验开始后的第5天,第1粒种子发芽,之后每天均有種子发芽。通过整理发芽试验记录表,得到种子发芽试验结果。3组重复的种子发芽率分别为90.00%,93.33%和86.67%,平均发芽率达到90%,可见试验所用种子质量较好,可以进行下一步试验。
2. 2 不同切割方式对种子萌发的影响
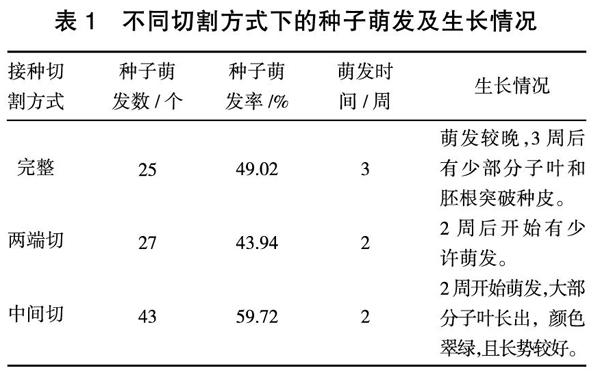
本试验采用完整种子、两端切和中间切3种切割方式进行水平接种,由不同切割方式下的种子萌发及生长情况(表1)可以看出,切割方式对种子萌发影响较大。完整种子自接种后3周内,除了种皮膨胀外无其它变化,3周后才开始发芽;两端切割的种子2周后就可萌发,中间切割的种子也是2周开始萌发,但萌发率更高,且长出了绿色子叶,长势良好。从种子最终萌发率可以看出,中间切割的种子萌发率最高,达到59.72%;两端切割的种子萌发率最低,只有43.94%;完整种子介于两者之间,但更接近于两端切割的种子。
表1 不同切割方式下的种子萌发及生长情况
2. 3 不同激素组合对种子初代诱导的影响
2. 3. 1 不同激素组合对不定芽诱导率的影响
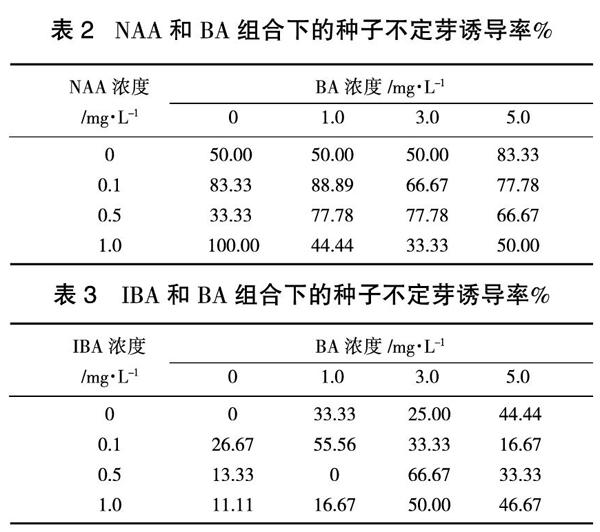
由NAA和BA组合对紫丁香成熟种子不定芽诱导率的影响(表2)可以看出,当培养基中不添加NAA时,BA浓度在0~3.0 mg/L,二者组合仅有50 %的种子诱导出不定芽;当BA浓度达到5.0 mg/L时,不定芽诱导率达83.33 %。NAA浓度为0.1 mg/L时,紫丁香种子不定芽的平均诱导率最高,为71.43 %。当NAA浓度为1 mg/L时,BA浓度为0时,不定芽的诱导率最高,出芽率达到了100 %。
由IBA和BA组合下的种子不定芽诱导率(表3)可以看出,IBA0.5 mg/L+BA3.0 g/L时,种子不定芽诱导率最高,为66.67 %。与NAA和BA组合相比,IBA和BA组合的初代培养基对紫丁香种子不定芽的诱导率效果较差。
表2 NAA和BA组合下的种子不定芽诱导率%
表3 IBA和BA组合下的种子不定芽诱导率%
2. 3. 2 不同激素组合对种子初代增殖及生长情况的影响
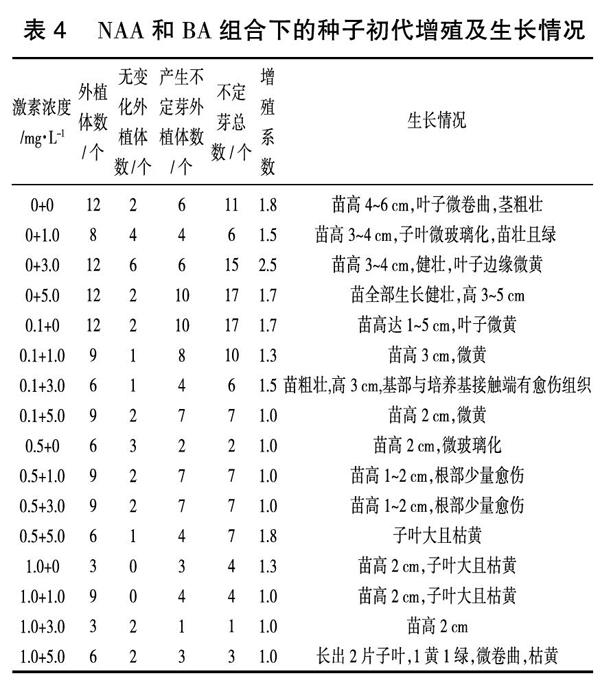
培养基内激素组合对紫丁香不定芽诱导的影响不仅表现在种子诱导率上,而且还表现在增殖系数及诱导出的不定芽本身的生长状态上。由NAA,IBA和BA组合下的种子初代增殖及生长情况(表4,表5)可以看出,添加了NAA与BA组合的初代诱导培养基诱导不定芽的效果优于IBA与BA组合,NAA与BA组合诱导紫丁香种子不定芽的增殖系数则不如IBA与BA组合,甚至当IBA0.1 mg/L +BA5.0 mg/L时,一个种子最多可增殖7个芽。但从整体情况来看,添加了IBA和BA组合的培养基诱导出的不定芽生长情况不良,部分叶片卷曲,子叶枯黄。综上可知,紫丁香种子不定芽诱导最适激素组合为NAA0.1 mg/L+BA1.0 mg/L,平均增殖系数为2.5。
2. 4 不同激素组合对继代增殖培养的影响
2. 4. 1 顶芽外植体继代增殖培养
在继代增殖培养阶段,将初代诱导产生不定芽的顶芽垂直接种在继代培养基上。由顶芽继代增殖培养生长情况(表6)可以看出,在继代培养基上的紫丁香顶芽基部均可产生块状愈伤组织,甚至包围整个外植体,愈伤组织主要表现为绿色、疏松,当激素浓度高时,变得致密。诱导出的不定芽的高度可达2~4 cm,经过继代增殖培养,一个芽最多可增殖5个芽。
2. 4. 2 茎段外植体继代增殖培养
在继代增殖培养阶段,将初代诱导产生不定芽的带芽茎段(长1 cm)水平接种在继代培养基上。由茎段继代增殖培养生长情况(表7)可以看出,在继代培养基上的紫丁香茎段基部均产生块状愈伤组织,甚至包围外植体,诱导的愈伤组织多数出现黄化,当激素浓度高时,叶片与培养基接触部位也诱导出愈伤组织,且愈伤组织变得更加致密;诱导出的不定芽最高为2 cm,经过继代增殖培养,一个芽最多可增殖3个芽,随着激素浓度的增加诱导出的不定芽出现轻微的玻璃化现象。综合不定芽的生长状态和增殖系数可知,对于顶芽和茎段继代培养而言,最佳的增殖培养基均为MS+BA3.0 mg/L,增值系数可达到5。
表7 茎段继代增殖培养生长情况
2. 5 紫丁香组培茎芽生根
丁香属树种在试管内生根相对容易,生根率很高。在本试验中,组培10 天后茎芽开始生根;20 天后,每个茎芽长出3~6条具有须根的发达根系,生根率达100 %,最长根长约2 cm,平均根长1 cm。由于试管苗通常在无菌、恒温、弱光的培养条件下生长发育,幼苗移栽后由异养转入自养,对外界环境条件需要经过一段逐渐驯化的适应过程。所以,一般来说组培茎芽试管外生根前要进行炼苗。但是紫丁香经增殖培养或壮苗培养后的小苗长得较为健壮,木质化程度较高,因此,一直以来有关壮苗培养基和移栽前的预处理还没有建立系统技术。在试管外生根方面,扦插4~6周后100%生根,紫丁香在增殖过程中部分茎芽基部會生根,数量不多,但较为粗壮发达。扦插时可不用去根,扦插时是否去根对其成活没有显著影响。由于紫丁香茎芽本身木质化程度高,叶片较厚,不易腐烂,所以紫丁香试管外生根对水分要求不严格,只需保持基质湿润即可(含水率50%~70%)。扦插期间,根据基质情况,每天进行叶面喷水或浇水以保持基质湿润,逐渐通风透光即可成苗。
3 结论与讨论
本研究筛选质量较好的紫丁香成熟种子作为外植体,以不同切割方式和不同激素组合进行了组培试验,研究结果表明,与完整种子和两端切相比,中间切割的种子萌发率更高,达到了59.72%。NAA与BA组合诱导紫丁香种子不定芽效果优于IBA与BA组合,最佳激素组合为NAA0.1 mg/L+ BA1.0 mg/L,最高诱导率达88.89 %。平均增殖系数达2.5。经过初代诱导产生的不定芽,以顶芽和茎段为外植体接种在继代培养基上,在不同激素组合下,生长状态和增殖系数均有所不同,而最佳增殖继代培养激素为BA3.0 mg/L。培养出的茎芽经过试管内、外生根试验,其生根率均可达到100%,紫丁香成熟种子组培快繁试验取得成功,该项技术可作为丁香属良种快繁技术进行熟化和推广。
参考文献
[1] 陈有民. 园林树木学[M]. 北京: 中国林业出版社, 1990.
[2] 藏淑英, 刘更喜. 丁香[M]. 北京: 中国林业出版社, 1990.
[3] 姬君兆, 黄玲燕. 花卉栽培学讲义[M]. 北京: 中国林业出版社, 1985.
[4] Hilderbrandt. V, P M Harney.In vitro propagation of Syringa vulgaris 'Vesper'[J].Hort Science, 1983, 18(4): 432 - 434.
[5] 李容群. 丁香雜交胚的组织培养[J]. 植物生理学通讯, 1991, 7(4): 291.
[6] Marks, T.R. Simpson, S.E. Rhizogenesis in Forsythia ⅹintermedia and Syringa vulgaris; application of a simple internode experimental system[J]. Plant Cell Reports, 2000(19): 1 171 - 1 176.
[7] 栾春梅, 舒钰. 洋丁香组织培养的研究[J]. 林业科技情报, 2014, 46(1): 84 - 86.
[8] 刘华英, 沈海龙. 暴马丁香下胚轴的离体培养和植株再生[J]. 植物生理学通讯, 2003, 39(1): 351.
[9] 栾春梅, 舒钰. 洋丁香组织培养的研究[J]. 林业科技情报,2014, 46(01): 84 - 86.
[10] 吴鸣建. 小叶丁香的悬浮细胞培养研究[J]. 郑州大学学报(工学版), 2004, 25(3): 22 - 25.
[11] 王贞, 刘燕. 小叶丁香的组织培养及植株再生[J]. 植物生理学通讯, 2006, 42(3): 487.
[12] 武术杰. 小叶丁香的再生体系建立[J]. 东北林业大学学报, 2009, 37(8): 17 - 18.
[13] 王兴安. 白丁香的器官克隆和快速繁育[J]. 国土与自然资源研究, 2006(3): 96.
[14] 孟昕, 陈春玲, 代兴华. 白丁香胚离体培养及快繁的研究[J]. 北京园林, 2013(4): 25 - 28.
[15] 崔楠, 石凤翎, 伊风艳, 等. 白丁香叶色变异及组培繁殖技术初步研究[J]. 种子, 2015, 34(6): 122 - 126.
[16] 程明, 李厚华, 和子森, 等. 濒危植物羽叶丁香组织培养[J].北方园艺, 2016(12): 92 - 96.
[17] 任辉丽, 邱景宝, 曹君迈, 等. 不同因素对贺兰山丁香愈伤组织诱导的影响[J]. 北方园艺, 2008(8): 181 - 183.
[18] 温瑀. 裂叶朝鲜丁香(Syringa dilatata Nakai. 'Lacera')组织培养体系的建立[D]. 哈尔滨: 东北林业大学, 2009.
[19] 刘建斌, 赵祥云, 王俊娟, 等. 紫丁香的组织培养[J]. 北京农学院学报, 2001, 16(4): 42 - 45.
[20] 杨晓红, 逯文亭, 冷平生, 等. 不同种源华北紫丁香组培研究[J]. 北京农学院学报, 2015, 30(3): 67 - 72.
[21] 周莉, 代力民, 苏宝玲, 等.利用正交法研究丁香幼胚离体培养的影响因素[J]. 安徽农业大学学报, 2003, 30(3): 304 - 307.
[22] 周莉, 罗凤霞, 代力民. 丁香种间杂交幼胚离体培养研究[J].应用生态学报, 2003, 14(3): 382 - 386.
第1作者简介: 王爱芝(1975-), 女, 博士, 助理研究员, 主要从事种苗培育原理与技术的研究工作。
通訊作者: 沈海龙(1962-), 男, 博士, 教授, 博士生导师, 主要从事森林培育学的教学和科研工作。
收稿日期: 2019 - 11 - 28
(责任编辑: 王 岩)
Study on Tissue Culture Induction of Syringa oblata Mature
Seeds Base on Different Hormone Treatments
WANG Aizhi
(Yichun Academy of Forestry Science, Heilongjiang Yichun 153000)
Abstract Using Syringa oblata mature seeds as explants, different hormone combination media were used for tissue culture induction experiments.The results showed that the germination rate of seeds was highest with intermediate cutting method (up to 59.72%). The highest induction rate was 88.89% with the combination of 0.1 mg/L NAA and 1.0 mg/L BA. The optimum culture medium for terminal bud and stem with buds was MS + BA 3.0 mg/L. The rooting time of shoot was 20 days in vitro and 4-6 weeks ex vitro, respectively, with 100% of the rooting rate. Our results suggested that the tissue culture of S. oblata was successful using mature seed as explants.
Key words Syringa oblata; Mature seed; Growth hormone; Tissue culture
