吉西他滨联合替吡法尼治疗胰腺癌的有效性和安全性的meta分析
2020-04-09王灵芝唐松云涂剑谢伟全
王灵芝 唐松云 涂剑 谢伟全



摘 要 目的:评价吉西他滨联合替吡法尼治疗胰腺癌的有效性和安全性。方法:通过计算机检索Cochrane Library、PubMed、中国生物医学文献数据库、中国知网和万方等数据库,收集吉西他滨联合替吡法尼治疗胰腺癌的临床随机对照试验(RCT),对吉西他滨联合替吡法尼治疗胰腺癌的有效性和安全性进行meta分析。结果:最终纳入2项RCT,共计932例患者。meta分析结果显示:吉西他滨联合替吡法尼治疗胰腺癌,对延长胰腺癌患者生存期无明显优势(P>0.05),且会提高患者中性粒细胞减少和周围神经病变的发生率,但可以降低患者呼吸困难的发生率。结论:吉西他滨与替吡法尼联合用药与吉西他滨单药治疗胰腺癌相比没有显著的优越性。
关键词 吉西他滨 替吡法尼 胰腺癌 meta分析
中图分类号:R979.19; R735.9 文献标志码:A 文章编号:1006-1533(2020)05-0034-06
Meta-analysis of the efficacy and safety of gemcitaine combined with tipifarnib in the treatment of pancreatic cancer*
WANG Lingzhi1**, TANG Songyun2, TU Jian1,3, XIE Weiquan1,3***
(1. the Cooperative Innovation Center for Molecular Targeting New Drug Study, University of South China, Hunan Hengyang 421001, China; 2. Hengyang Central Hospital, Hunan Hengyang 421001, China; 3. Institute of Pharmacy & Pharmacology, University of South China, Hunan Hengyang 421001, China)
ABSTRACT Objective: To assess the efficacy and safety of gemcitabine plus tipifarnib for the treatment of pancreatic cancer by meta-analysis. Methods: The data from some randomized controlled trials (RCT) of gemcitabine plus teprefini in the treatment of pancreatic cancer were collected by searching for Cochrane Library, PubMed, CBM, CNKI, and Wanfang database and their efficacy and safety were analyzed using RevMan 5.3 software. Results: A total of 2 studies and 932 patients were included. The results of meta-analysis indicated that the combination chemotherapy of gemcitabine and teprefini in the treatment of pancreatic cancer had no significant advantage in prolonging the survival of patients with pancreatic cancer compared with the single-agent chemotherapy (P>0.05), and would increase the incidence of neutropenia and peripheral neuropathy but could reduce the incidence of dyspnea in patients. Conclusion: The combination medication has no significant advantages compared with gemcitabine monotherapy for pancreatic cancer.
KEY WORDS gemcitabine; tipifarnib; pancreatic cancer; meta-analysis
近年,胰腺癌已成為最致命的疾病之一,其5年生存率仅4%,在所有类型癌症中最低[1-2]。值得注意的是,近年来我国恶性肿瘤的发病率呈明显上升的趋势[3]。其中,胰腺癌的发病率增长了4倍[4-6]。因此,开发更有效的治疗方法是提高患者生存率的关键。尽管近年来吉西他滨已被公认为治疗晚期胰腺癌的一线化疗药物,但接受吉西他滨治疗的患者的中位生存期也只有5.65个月,其中,耐药的发生是导致吉西他滨单药治疗失败的主要原因[7-8]。近年,医疗领域发现以吉西他滨为基础的一些联合化疗在生存率等方面显示出明显的优越性,且基于吉西他滨的联合治疗在晚期胰腺癌患者中显示出了良好的疗效[9-11]。替吡法尼是一种特异性法尼基转移酶抑制剂。法尼基转移酶的抑制干扰了Ras的翻译后修饰,因此,替吡法尼在多个临床前研究中被证明可以抑制肿瘤细胞的生长,可以增强细胞毒性治疗药物的抗肿瘤效果[12-13]。本研究通过meta分析综合评价吉西他滨联合替吡法尼治疗胰腺癌的有效性和安全性。
1 材料与方法
1.1 检索策略
以中国生物医学文献数据库、中国知网、万方数据库、Cochrane Library和PubMed为来源,查找截至2018年3月国内外已经发表的治疗胰腺癌的相关文献。英文检索词为:“tipifarnib”,“gemcitabine”和“pancreatic cancer”。中文检索词为:“替吡法尼”、“吉西他滨”和“胰腺癌”。
1.2 入选标准
①经病理确诊为胰腺癌的患者;②前瞻性随机对照试验(RCT);③实验组为替吡法尼联合吉西他滨,对照组为吉西他滨单药或吉西他滨联合安慰剂;④结局指标包含无进展生存期(PFS)、总生存期(OS)、1年生存率、不良反应事件这四项中至少一项。
1.3 排除标准
①患者既往接受过化学治疗或放射治疗的研究;②患者未经过病理学诊断的研究;③重复发表的研究。
1.4 资料提取与质量评价
由两名评价者严格地按照上述的入选标准和排除标准对检索所得的文献进行筛选后,从纳入研究的文献中提取出相关的数据,根据随机序列的产生是否正确,是否随机化隐藏及隐藏的是否正确,是否采用了盲法,是否描述了撤退或退出的数目及理由等四项修改后的Jadad评分标准[14]。对纳入研究的文献进行方法学质量评价。评分系统为7分制,得到的Jadad分数越高,则说明其风险越小;反之,得到的Jadad分数越低,则说明其风险越大。为了更直观地体现出风险的大小,采用<4分视为低质量文献,≥4分视为高质量文献的惯例。
1.5 统计学处理
所有提取的数据均是采用RevMan 5.3软件进行数据分析。评价的指标包括无进展生存期(PFS)、总生存期(OS)和化疗药物产生的不良反应。无进展生存期和总生存期采用合并的风险比(HR)及95%置信区间(CI)作为结果报告。药物产生的不良反应用治疗优势比(RD)作为结果报告。研究结果的异质性检验采用I2检验。当I2<50%时,将其视为同质性,采用固定效应模型分析;反之,当I2>50%时,将其视为异质性,则采用随机效应模型分析。根据漏斗图,进行发表偏倚的大小判断。
2 结果
2.1 文献检索与质量评价
根据检索策略对中国生物医学文献数据库、中国知网、万方数据库、Cochrane Library和PubMed进行检索,共28篇涉及吉西他滨、替吡法尼以及胰腺癌三个检索词的研究。随后,根据纳入排除标准并对28篇研究的标题与摘要进行逐一阅读后,26篇研究由于综述、重复以及缺乏完整有用的结局指标數据而被排除。最终纳入文献2篇[15-16],共计932名胰腺癌患者,其中吉西他滨与替吡法尼联合化疗组有465人,吉西他滨联合安慰剂化疗组有467人。
两位评价者经阅读文献标题和摘要之后,去除了不符合要求的文献,再逐篇进行阅读后,经过分析与评价,最终纳入符合标准的两篇前瞻性的随机对照试验皆为英文文献。共932例患者,其中吉西他滨联合替吡法尼化疗组465例,吉西他滨联合安慰剂化疗组467例。两项研究的一般资料见表1。两项研究根据改良的Jadad量表评分都大于4分,即所纳入的两项研究均为高质量研究。采用漏斗图进行发表偏倚分析。
2.2 meta分析
2.2.1 无进展生存期
根据纳入的2项研究[15-16]中提供的无进展生存期(PFS)的数据进行meta分析,异质性分析结果得到P=0.59,I2=0%,所以两项研究被视为同质性,数据分析模型采用固定效应模型。结果显示吉西他滨联合替吡法尼化疗组与吉西他滨联合安慰剂化疗组治疗胰腺癌的无进展生存期相比,两组差异无统计学意义(表2)[OR=1.05, 95%CI(0.91, 1.22),P=0.48]。

2.2.2 总生存期
根据纳入的2项研究[15-16]中提供的总生存期(OS)的数据进行meta分析,异质性分析结果得到P=0.83,I2=0%,所以两项研究被视为同质性,数据分析模型采用固定效应模型。结果显示吉西他滨联合替吡法尼化疗组与吉西他滨联合安慰剂化疗组治疗胰腺癌的总生存期相比,两组差异无统计学意义(表3)[OR=1.04, 95%CI(0.89, 1.21),P=0.61]。
2.2.3 周围神经病变
根据纳入的2项研究中提供的周围神经病变的数据进行meta分析,异质性分析结果得到P=0.87,I2=0%,所以两项研究被视为同质性,数据分析模型采用固定效应模型。结果显示吉西他滨联合替吡法尼化疗与吉西他滨联合安慰剂治疗胰腺癌相比,吉西他滨联合替吡法尼组提高了周围神经病变的发生率(表4)[OR=1.98, 95%CI(1.33, 2.94),P=0.000 8]。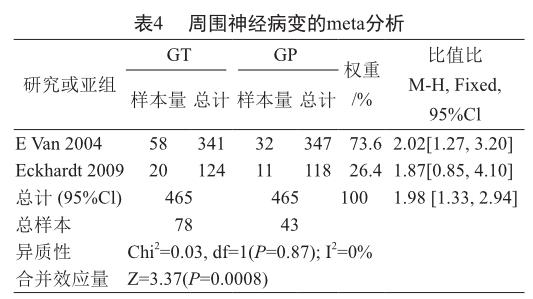
2.2.4 呼吸困难
根据纳入的2项研究中提供的呼吸困难的数据进行meta分析,异质性分析结果得到P=0.38,I2=0%,所以两项研究被视为同质性,数据分析模型采用固定效应模型。结果显示吉西他滨联合替吡法尼化疗与吉西他滨联合安慰剂治疗胰腺癌相比,吉西他滨联合替吡法尼组降低了呼吸困难的发生率(表5)[OR=0.65, 95%CI(0.46, 0.91),P=0.01]。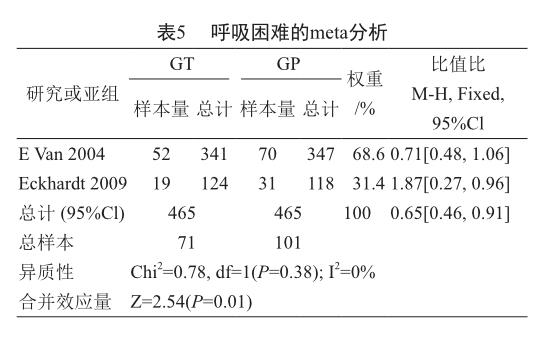
2.2.5 中性粒细胞减少
根据纳入的2项研究中提供的中性粒细胞减少的发生率的数据进行meta分析,异质性分析结果得到P=0.99,I2=0%,所以两项研究被视为同质性,数据分析模型采用固定效应模型。结果显示吉西他滨联合替吡法尼化疗比吉西他滨联合安慰剂治疗胰腺癌显著提高了中性粒细胞减少的发生率(表6)[OR=1.58, 95%CI(1.19, 2.10),P=0.001]。
2.2.6 血小板减少
根据纳入的2项研究中提供的血小板减少的发生率的数据进行meta分析,异质性分析结果得到P=0.003,I2=89%,所以两项研究被视为异质性,数据分析模型采用随机效应模型。结果显示吉西他滨联合替吡法尼化疗组与吉西他滨联合安慰剂化疗组治疗胰腺癌的血小板减少的发生率相比,两组差异无统计学意义(表7)[OR=1.11, 95%CI(0.39, 3.13),P=0.84]。
2.2.7 贫血
根据纳入的2项研究中提供的贫血的发生率的数据进行meta分析,异质性分析结果得到P=0.22,I2=33%,所以两项研究被视为同质性,数据分析模型采用固定效应模型。结果显示吉西他滨联合替吡法尼化疗组与吉西他滨联合安慰剂化疗组治疗胰腺癌的贫血的发生率相比,两组差异无统计学意义(表8)[OR=0.77, 95%CI(0.34, 1.74),P=0.53]。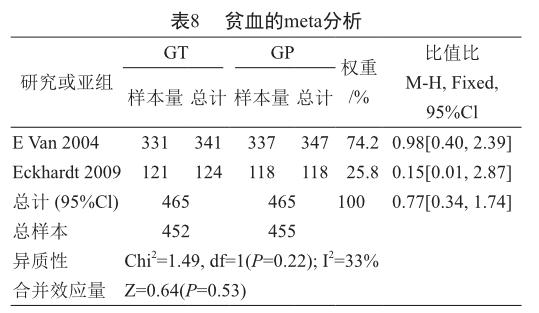
2.2.8 肌酐升高
根据纳入的2项研究中提供的肌酐升高的发生率的数据进行meta分析,异质性分析结果得到P=0.80,I2=0%,所以两项研究被视为同质性,数据分析模型采用固定效应模型。结果显示吉西他滨联合替吡法尼化疗组与吉西他滨联合安慰剂化疗组治疗胰腺癌的肌酐升高的发生率相比,两组差异无统计学意义(表9)[OR=0.77, 95%CI(0.53, 1.14),P=0.19]。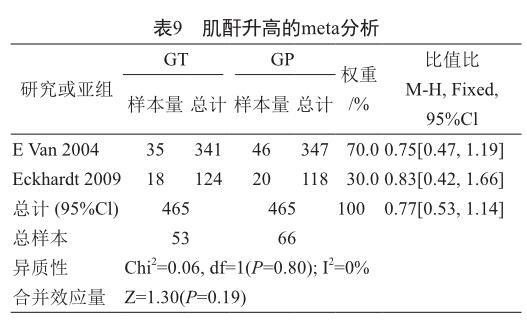
2.3 发表偏倚
周围神经病变(图1A)、呼吸困难(图1B)、中性粒细胞减少(图1C)的漏斗图均呈下宽上窄、左右对称的图形,采用RevMan 5.3软件进行偏倚分析,检验统计量分别为:周围神经病变(P=0.87)、呼吸困难(P=0.38)、中性粒细胞减少(P=0.99),P>0.05,故认为此meta分析的发表偏倚较小。
3 讨论
这项meta分析旨在通过与吉西他滨单药化疗组在无进展生存期、总生存期、一年生存率、不良反应发生率等结局指标的对比,确定吉西他滨联合替吡法尼对胰腺癌的治疗效果。结果显示:在治疗胰腺癌的疗效方面,吉西他滨联合替吡法尼治疗胰腺癌和吉西他滨联合安慰剂相比,联合替吡法尼对胰腺癌治疗的无进展生存期和总生存期均无明显提高(P>0.05),并对患者服药后的一些不良反应,如血小板减少、贫血和肌酐升高,均无明显改善(P>0.05)。甚至吉西他滨联合替吡法尼会提高患者中性粒细胞减少的发生率以及周围神经病变的发生率。值得一提的是,吉西他滨联合替吡法尼可以降低患者的呼吸困难的发生率,两组差异具有统计学意义(P<0.05)。
虽然近年来在胰腺癌分子机制的认识和靶向药物的开发方面取得了很大进展,但胰腺癌药物治疗的预后仍不尽如人意。联合用药可以提供相加或协同效应来阻断异常信号,因此是胰腺癌的一种治疗选择[17-19]。不少研究也发现并证实了,相较于单用吉西他滨的药物治疗,基于吉西他滨的联合用药对于胰腺癌的治疗具有较为显著的优势[20-23]。替吡法尼作為一种特异性法尼基转移酶抑制剂,通过多个I期临床试验已被证明在实体瘤中具有抗肿瘤作用。近年,开始有研究者将替吡法尼与一些抗肿瘤药物联合用药,且发现对于某些肿瘤的治疗,与替吡法尼联合用药的耐受性良好[24-25]。这提示替吡法尼或许可以与抗肿瘤药物联合用药治疗某些实体瘤。在本项meta分析中,吉西他滨联合替吡法尼治疗胰腺癌的效果与吉西他滨联合安慰剂相比,并没有明显优势。
此次研究有以下几点局限:①纳入的研究较少,仅两篇随机对照试验,且都是外文文献,无中文文献;②纳入的试验部分存在基本特征不全;③未对患者的生存质量进行分析(生存质量分析,用于评价癌症的临床治疗效果的重要指标之一)。综合考虑以上分析过程中的几项局限性,此次meta分析的结果仍有待纳入更多的相关RCT来进一步分析吉西他滨联合替吡法尼治疗胰腺癌的效果。
参考文献
[1] Welsch T, Kleeff J, Seitz HK, et al. Update on pancreatic cancer and alcohol-associated risk[J]. J Gastroenterol Hepatol, 2006, 21(Suppl 3): S69-S75.
[2] Heinemann V. Gemcitabine in the treatment of advanced pancreatic cancer: a comparative analysis of randomized trials[J]. Semin Oncol, 2002, 29(6 Suppl 20): 9-16.
[3] 孙可欣, 郑荣寿, 张思维, 等. 2015年中国分地区恶性肿瘤发病和死亡分析[J]. 中国肿瘤, 2019, 28(1): 1-11.
[4] 陈万青, 孙可欣, 郑荣寿, 等. 2014年中国分地区恶性肿瘤发病和死亡分析[J]. 中国肿瘤, 2018, 27(1): 1-14.
[5] 陈万青, 郑荣寿, 张思维, 等. 2013年中国恶性肿瘤发病和死亡分析[J]. 中国肿瘤, 2017, 26(1): 1-7.
[6] 陈万青, 郑荣寿, 张思维, 等. 2012年中国恶性肿瘤发病和死亡分析[J]. 中国肿瘤, 2016, 25(1): 1-8.
[7] Kleeff J, Korc M, Apte M, et al. Pancreatic cancer[J]. Nat Rev Dis Primers, 2016, 2: 16022.
[8] Jin SF, Fan ZK, Pan L, et al. Gemcitabine-based combination therapy compared with gemcitabine alone for advanced pancreatic cancer: a meta-analysis of nine randomized controlled trials[J]. Hepatobiliary Pancreat Dis Int, 2017, 16(3): 236-244.
[9] 周超锋, 臧宾宾, 郭志忠. 奥沙利铂与吉西他滨联合治疗胰腺癌的临床分析[J]. 世界最新医学信息文摘, 2016, 16(22): 69-70.
[10] Reni M, Zanon S, Balzano G, et al. A randomised phase 2 trial of nab-paclitaxel plus gemcitabine with or without capecitabine and cisplatin in locally advanced or borderline resectable pancreatic adenocarcinoma[J]. Eur J Cancer, 2018, 102: 95-102.
[11] Blomstrand H, Scheibling U, Bratth?ll C, et al. Real world evidence on gemcitabine and nab-paclitaxel combination chemotherapy in advanced pancreatic cancer[J/OL]. BMC Cancer, 2019, 19(1): 40. doi: 10.1186/s12885-018-5244-2.
[12] 项金峰, 施思, 梁丁孔, 等. 2015年胰腺癌研究及诊疗前沿进展[J]. 中国癌症杂志, 2016, 26(4): 281-289.
[13] 徐露娟, 钱晓萍, 刘宝瑞. 吉西他滨个体化治疗疗效相关预测分子的研究进展[J]. 现代肿瘤医学, 2012, 20(3): 630-633.
[14] Jadad AR, Moore RA, Carroll D, et al. Assessing the quality of reports of randomized clinical trials: is blinding necessary?[J]. Control Clin Trials, 1996, 17(1): 1-12.
[15] Van Cutsem E, van de Velde H, Karasek P, et al. Phase III trial of gemcitabine plus tipifarnib compared with gemcitabine plus placebo in advanced pancreatic cancer[J]. J Clin Oncol, 2004, 22(8): 1430-1438.
[16] Patnaik A, Eckhardt SG, Izbicka E, et al. A phase I, pharmacokinetic, and biological study of the farnesyltransferase inhibitor tipifarnib in combination with gemcitabine in patients with advanced malignancies[J]. Clin Cancer Res, 2003, 9(13): 4761-4771.
[17] 黃欣昊, 柳千帆, 宋春灼, 等. 吉西他滨联合厄洛替尼抑制胰腺癌细胞增殖[J]. 贵州医科大学学报, 2019, 44(8): 903-907.
[18] 刘艳杰, 陆翰杰. 白蛋白结合紫杉醇联合替吉奥治疗晚期胰腺癌的疗效及安全性观察[J]. 中国临床新医学, 2019(9): 1-4.
[19] 林素丽. 替吉奥联合吉西他滨治疗晚期胰腺癌的临床效果[J]. 河南医学研究, 2019, 28(16): 2970-2971.
[20] 董猛, 卿毅. 吉西他滨联合顺铂治疗非小细胞肺癌的效果评析[J]. 当代医药论丛, 2019, 17(13): 134-135.
[21] 江森, 郑希, 何燕, 等. 乌苏酸联合吉西他滨对胰腺癌PANC-1细胞增殖和凋亡的影响[J]. 中国肿瘤生物治疗杂志, 2018, 25(3): 252-257.
[22] 王婧, 赵磊, 车娟娟, 等. 大黄素联合吉西他滨抑制胰腺癌细胞系PANC-1细胞增殖能力的研究[J]. 肿瘤预防与治疗, 2016, 29(3): 139-143.
[23] 周天义, 贺小会, 谭志辉, 等. 吉西他滨和顺铂联合用药治疗晚期胰腺癌患者利弊的meta分析[J]. 现代肿瘤医学, 2019, 27(14): 2546-2552.
[24] Jazieh K, Molina J, Allred J, et al. A phase I study of the farnesyltransferase inhibitor tipifarnib in combination with the epidermal growth factor tyrosine kinase inhibitor erlotinib in patients with advanced solid tumors[J]. Invest New Drugs, 2019, 37(2): 307-314.
[25] Yam C, Murthy RK, Valero V, et al. A phase II study of tipifarnib and gemcitabine in metastatic breast cancer[J]. Invest New Drugs, 2018, 36(2): 299-306.
