POEMS 综合征伴弥漫性增生性肾小球肾炎1 例并文献复习
2020-04-09路晴晴曹仕琼
路晴晴,姜 阳,曹仕琼
1 华中科技大学同济医学院附属梨园医院 消化内科,湖北武汉 430000;2 中南大学湘雅医学院,湖南长沙 410000
POEMS 综合征(polyneuropathy,organomegaly,endocrinopathy,M protein elevation,and skin changes syndrome)是一种罕见的、与浆细胞异常增殖相关的多系统受累的副肿瘤综合征,发病率为0.3/100 000[1-2]。其主要表现为多发性周围神经病变(P)、脏器肿大(O)、内分泌病变(E)、单克隆性浆细胞疾病(M)和皮肤改变(S),合并弥漫性增生性肾小球肾炎者少见,且表现为双M 蛋白血症者更为罕见。故将本院收治的1 例POEMS 综合征患者整理报道如下,提高临床医师对POEMS 综合征系统损害、尤其是肾损害的认识,提高诊断准确性。
病例资料
1 入院情况 患者男,70 岁,2018 年5 月无明显诱因于长时间步行后出现双下肢水肿,可自行消退,未予重视。起病以来,患者上述症状反复出现伴血压升高,2018 年10 月2 号收治于华中科技大学同济医学院附属梨园医院。既往糖尿病病史4 年,自诉曾被诊断为“糖尿病周围神经病变”,长期口服降糖药物,血糖控制良好。入院查体:血压180/85 mmHg(1 mmHg=0.133 kPa),双眼睑轻度水肿,胸背部多发红色瘤样物。双侧颈部、腹股沟及腋窝均可触及多发肿大淋巴结,黄豆大小,质硬,无压痛,活动度可。双下肺呼吸音低,腹膨隆,移动性浊音(+),肝脾肋下可及,双下肢轻度凹陷性水肿伴局部皮肤色素沉着,余无异常。
2 实验室检查 尿检示血尿(红细胞15 000/ml,以异型为主,变异型红细胞60%),蛋白尿(尿蛋白++,24 h 尿蛋白总量1 902.39 mg/d ↑,尿本周蛋白κ 链0.49 g/L ↑,λ 链<0.05 g/L)。血液检查示红细胞5.13×1012/L(正常水平),血小板394×109/L ↑,尿素氮8.74 mmol/L ↑,肌酐81.2μmol/L(正常水平),血清总蛋白61.6 g/L ↓,白蛋白31.6 g/L↓,免疫球蛋白IgA 6.01 g/L ↑。血尿免疫固定蛋白电泳示IgA-KAP+IgG-LAM 双M 蛋白血症,糖化血红蛋白5.8%(正常水平)。抗中性粒细胞胞质抗体、抗肾小球基底膜抗体、抗核抗体、抗可溶性抗原抗体、抗双链DNA 抗体、甲状腺激素、黄体生成素、催乳素均为阴性。
3 影像学检查 SPECT 示:左骶髂关节骨代谢活跃,考虑多发性骨髓瘤可能;头颅、胸腰椎及骨盆X 线示:头颅骨、胸腰椎体及双侧髋骨多处骨质异常,以成骨为主,符合多发性骨髓瘤,不除外转移瘤。浅表淋巴结超声示:双颈部、腋窝、腹股沟等多个浅表淋巴结肿大。胸部CT 显示:左肺下叶胸膜下小结节,纵隔、腋窝淋巴结轻度肿大,胸腔积液。18F-FDG PET-CT 示:肝脾大(图1A);双侧颌下、腋窝、双肺门、纵隔、腹膜后、双侧盆壁、双侧腹股沟区多发淋巴结肿大伴糖代谢增高(图1B);多浆膜腔积液(腹腔、盆腔、双侧胸腔及右侧睾丸鞘膜腔积液)(图1B、C、D);多椎体(C1-7、T1-12、L1-5)、胸骨、双侧肩胛骨、多处肋骨、骨盆诸骨、双侧股骨多发点片状高密度影,未见糖代谢增高,考虑多发性骨硬化(图2);双肾肾实质轮廓模糊,周围脂肪间隙明显增粗伴糖代谢增高,考虑为炎性病变。
4 组织病理学检查 骨髓活检示:骨髓增生活跃(图3A);骨髓细胞学示:浆细胞浸润(占4.5%),可见双核、三核等异型浆细胞(图3B)。肾穿活检:(光镜)肾小球系膜细胞及系膜基质弥漫性轻中度增生,部分以节段系膜增生为主,内皮细胞弥漫性增生、堵塞毛细血管袢,系膜区、个别内皮下及上皮侧可见嗜复红物沉积,基底膜节段性僵硬、增厚,部分节段可见“双轨征”形成,毛细血管腔开放不良,系膜区及袢腔内可见单个核细胞浸润。(免疫荧光)IgG 沉积于毛细血管袢,IgA(-),IgM(-),LAM 轻链沉积于毛细血管袢,κ 链(-)。(电镜)肾小球毛细血管脏层上皮细胞减少,局灶空泡变及微绒毛样变,足突部分融合;系膜区增宽,系膜基质增生,纤维增生、插入,毛细血管腔狭窄、闭塞,局灶性系膜细胞轻度增多,散在巨噬细胞;多节段内皮下增宽、疏松化,基底膜节段厚;少数内皮细胞轻微肿胀,多个管腔内有单个核细胞,单个管腔内可见成团血小板;球囊壁部分增厚;未见明显电子致密物。诊断为:弥漫性增生性肾小球肾炎(图3C)。右侧腹股沟淋巴结活检示:淋巴结结构紊乱,大部分淋巴滤泡萎缩,窦组织细胞反应性增生,T、B 细胞混合,CD4 T 细胞增生,浆细胞和免疫母细胞很少。滤泡间区和滤泡内灶性毛细血管壁增厚,淀粉样变,考虑血管滤泡性淋巴结增生(Castleman 病)透明血管型(图3D)。
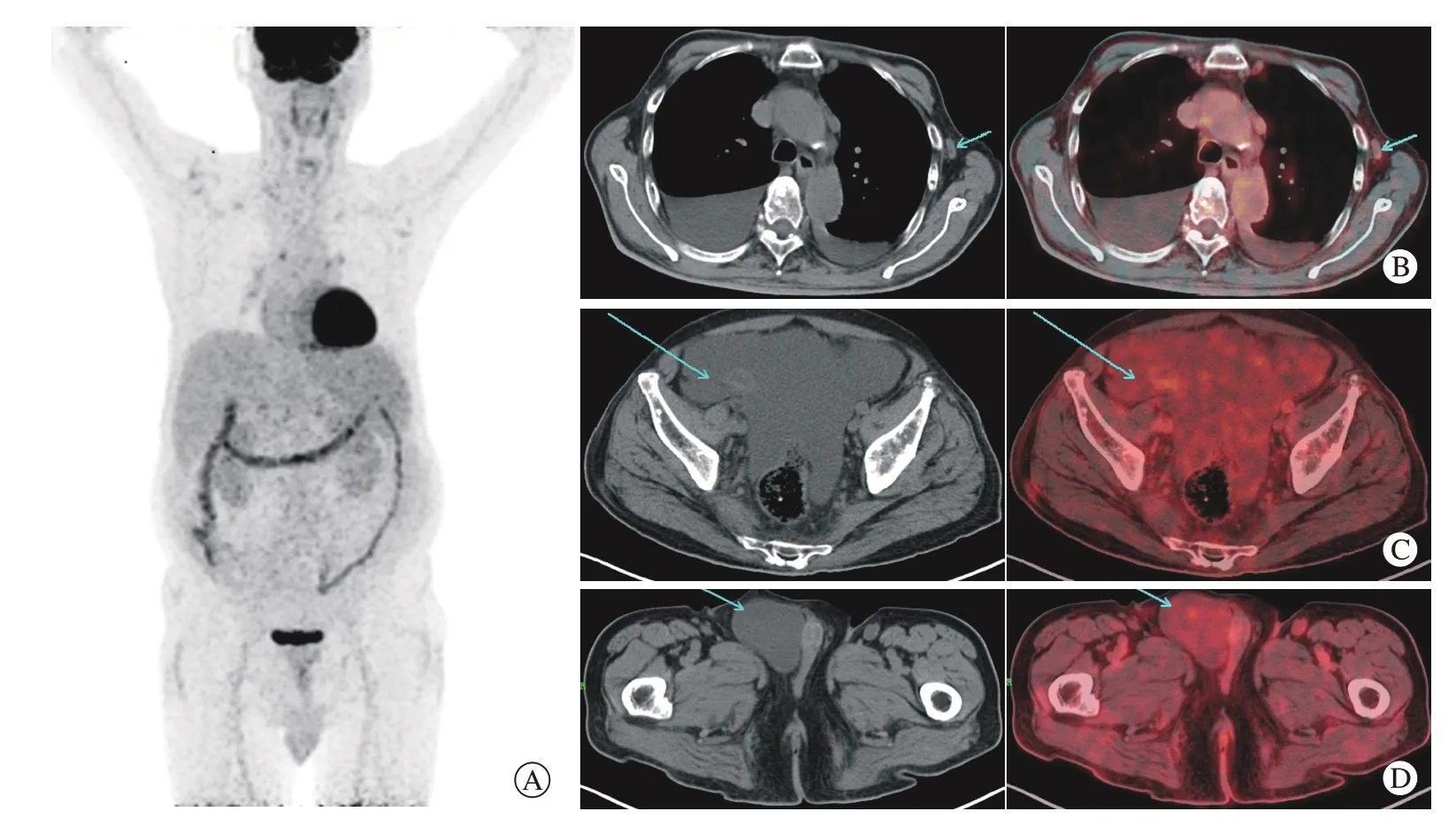
图 1 患者的1 8F-F D G PET-CT图 A: 最大密度投影图,可见肝脾大; B、C、D:轴位CT 图及PET-CT 融合图[B 可见双侧胸腔积液,右侧腋窝淋巴结肿大伴18F-FDG 摄取轻度增高(箭头所示),SUVmax 为2.2; C 可见大量盆腔积液(箭头所示); D可见右侧睾丸鞘膜积液(箭头所示)]
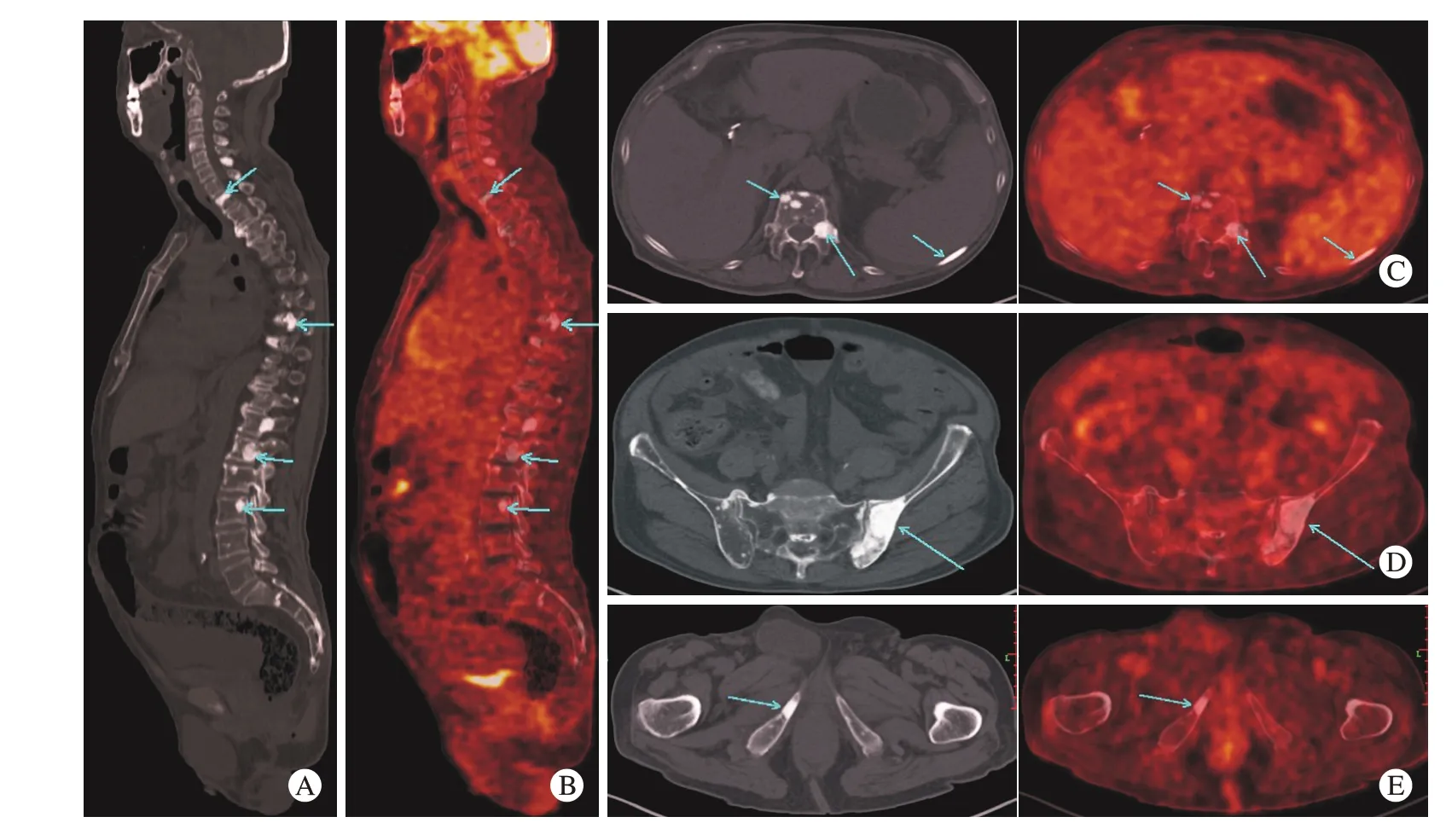
图 2 患者的骨骼18F-FDG PET-CT图 A、B:脊柱矢状位CT 图和PET-CT 融合图,可见多椎体结节状、片状骨质密度增高(箭头所示),未见糖代谢摄取异常; C、D、E: 骨骼轴位CT 图及PET-CT融合图,可见胸椎、左侧肋骨、左侧髂骨、右侧坐骨呈结节状、小片状、大片状骨质密度增高(箭头所示),均未见糖代谢摄取异常
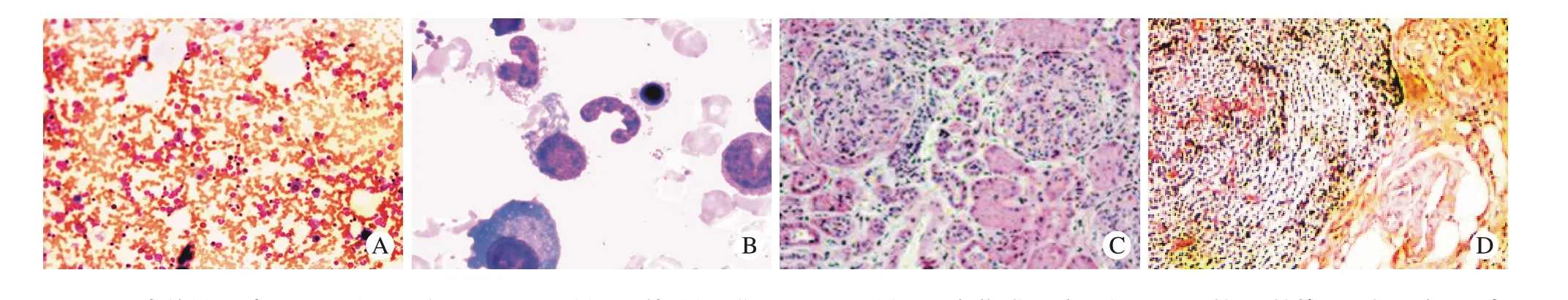
图 3 患者的骨髓、肾及淋巴结组织病理图 A: 骨髓活检:骨髓增生活跃; B: 骨髓细胞学:浆细胞浸润,可见双核、三核等异型浆细胞; C:肾穿刺病理:提示弥漫性增生性肾小球肾炎; D: 右侧腹股沟淋巴结活检:淋巴结结构紊乱,淋巴滤泡萎缩,窦组织细胞反应性增生,CD4 T细胞增生,滤泡间区和滤泡内灶性毛细血管壁增厚,符合血管滤泡性淋巴结增生(Castleman病)透明血管型Fig. 3 Histopathological findings of marrow (A, B), kidney (C) and lymph nodes (D)
5 诊断及治疗 患者初始诊断为Castleman 病,使用沙利度胺联合降压护肾治疗4 个月,淋巴结较前缩小,但尿蛋白持续存在,同时患者新发心包积液、双下肢乏力,考虑POEMS 综合征可能。行血管内皮生长因子(VEGF)检测示:1 423.08 pg/ml ↑,肌电图示周围神经病变。综合该患者的临床表现:周围神经病变+单克隆性浆细胞增殖异常(满足2条强制标准)、Castleman 病+多发硬化性骨病变+血管内皮生长因子水平升高(满足3 条主要标准)、脏器肿大+多浆膜腔积液(满足2 条次要标准),POEMS 综合征诊断明确。予以RCOP(利妥昔单抗+环磷酰胺+长春瑞滨+泼尼松)化疗方案联合胸腹腔穿刺引流及改善肾功能、纠正低蛋白血症等对症支持治疗。半年后患者多浆膜腔积液明显改善,水肿消退,血尿蛋白尿消失,VEGF 水平下降,达临床缓解。
讨 论
POEMS 综合征由Bardwick 等[3]根据其临床表现而命名,其病因及发病机制尚未明确,目前认为可能与单克隆性浆细胞增生、血管内皮生长因子过表达、前炎症性细胞因子失衡、基质金属蛋白酶过度生成、人类疱疹病毒8 感染及细胞遗传学异常等有关[4-5]。其诊断主要依据临床表现和实验室检查,最新的诊断标准由Dispenzieri[1]于2015年进行更新,需符合2 条强制标准+1 条主要标准+1 条次要标准(表1)。POEMS 综合征同时合并Castleman 病、弥漫性增生性肾小球肾炎及双M 蛋白血症者国内尚未见报道。
Castleman 病是一种罕见的淋巴细胞增生性疾病,病因和发病机制尚不明确,多认为是一种由自身免疫功能紊乱、副肿瘤综合征等引起的细胞因子风暴驱动的系统性炎症反应[6-7]。根据病灶分布可将其分为单中心和多中心型;根据组织学特征可分为透明血管型、浆细胞型及混合型[8]。POEMS综合征合并Castleman 病并不常见,临床中仅11% ~30%的POEMS 综合征患者伴有Castleman 病,其中以多中心型和透明血管型最为常见[9]。研究表明合并Castleman 病者较单纯POEMS 综合征者预后差。除Castleman 病外,有研究报道POEMS 综合征也可合并滤泡型淋巴瘤[10]。因此当患者存在淋巴结肿大时,应行淋巴结活检。Castleman 病是POEMS 综合征诊断的主要标准之一,在确诊Castleman 病的基础上,不应忽视存在POEMS 综合征的可能性。方芳等[11]曾报道过伴Castleman病的血液学检查阴性的POEMS 综合征1 例,该患者血清、尿液及骨髓检测均未发现单克隆浆细胞疾病的证据,确诊困难,最终在PET-CT 引导下再次进行骨髓活检术,明确了POEMS 综合征的诊断。因此,对具有多发病灶者,多部位活检,必要时PET-CT 指导下活检是协助诊断的重要手段。除活检定位外,PET-CT 作为融功能与形态为一体的全身成像方式,在识别脏器肿大、多浆膜腔积液、硬化性骨病变及病情判断、疗效评价、鉴别诊断等方面较常规影像学检查更有优势[12]。
POEMS 综合征合并肾损害者少见,发生率约2%,且更易发生在POEMS 综合征合并Castleman 病的患者中[13]。POEMS 综合征肾损害多表现为轻中度蛋白尿,可合并肾功能不全。有研究指出肾功能不全是导致POEMS 综合征患者不良预后的独立危险因素,若缺乏及时诊治,4%的患者最终因肾功能衰竭而死亡[13-14]。临床中大多数POEMS综合征患者肌酐水平正常,有学者指出对于这类患者可将血清胱抑素C 作为反映肾功能的替代指标[15]。本例患者肾损害表现为中度蛋白尿,肌酐水平正常,胱抑素C 水平升高,和文献报道相符。POEMS 综合征患者的肾组织学表现多样,主要累及肾小球,以膜增生性病变和内皮损伤最常见[16-17]。光镜和电镜下主要表现为系膜扩张、毛细血管管腔狭窄、基底膜增厚、内膜下复合物沉积、内皮下间隙扩大、内皮细胞肿胀形成空泡、毛细血管溶解。与原发性膜性增生性肾小球炎不同的是,肾脏组织学标准免疫荧光为阴性,很少见浆细胞巢或Castleman 样淋巴瘤浸润。治疗方面以去除病因,诊治原发病为主,可联合降压、利尿、护肾等对症支持治疗。本例采用RCOP 化疗方案联合对症支持治疗,肾损害改善明显。

表1 POEMS 综合征的诊断标准[1]
单克隆浆细胞增殖性异常是两项强制性诊断标准之一。POEMS 综合征血清M 蛋白阳性即为单克隆浆细胞异常增殖存在的证据。既往研究表明,不同于其他浆细胞病,POEMS 综合征M 蛋白的游离轻链几乎均为λ 链,κ 链极为罕见[18]。与文献报道不同,本例患者游离轻链检测显示κ 链、λ 链同时存在,且为IgA+IgG 双M 蛋白血症,尤为罕见。M 蛋白的类型及轻链性质在POEMS 患者病程中的作用及与临床特征的关系尚不明确,需要研究进一步阐明。值得一提的是,本例POEMS综合征患者从初次就诊至明确诊断间隔数月,除患者神经损害出现晚,症状不典型外,其中一个重要原因是将神经损害与糖尿病的周围神经病变相混淆,因而忽视了神经病变的早期识别。除糖尿病周围神经病变外,Nasu 等[19]研究表明,约87.5%的POEMS 综合征患者符合慢性炎性脱髓鞘性多发性神经病(CIDP)诊断的电生理标准。临床上其极易与CIDP 混淆,但两者神经传导的特点迥异,POEMS 综合征表现为:1)神经中部传导速度的减慢较神经末端更突出;2)肌张力下降、深感觉减退、复合肌肉动作电位衰减等均以下肢为重;3)与CIDP 相比,传导阻滞较少见。同时,POEMS综合征的神经病变往往具有对称性,且伴有疼痛。总之,POEMS 综合征神经损害的发生率高但特异性低,易被首诊医师忽视及误诊,因此需要根据其神经传导的特征性改变及多系统受累的证据排除CIDP 及糖尿病[20]。任何对治疗出现显著抵抗的CIDP 病人,都不应该忽视POEMS 综合征的可能。 POEMS 综合征作为一种全身多系统受累的综合征,临床罕见,病变广泛,尽管诊断标准日趋完善,提高了诊断的特异性和敏感性,但由于缺乏对本病的全面认识及早期表现的识别,临床中误诊、漏诊病例仍存在。因此,针对疑似POEMS综合征者需进行全面系统的检查及细致的鉴别诊断。确诊Castleman 病者,不应忽视POEMS 综合征的可能性,应积极寻找POEMS 综合征特征性系统损害的证据,对具有多发病灶者,多部位活检是协助诊断的重要手段。肌酐水平正常者,可将血清胱抑素C 作为反映肾功能的替代指标,以期早期识别肾损害。对于合并糖尿病者,尤其既往存在“糖尿病周围神经病变”者,应重视神经系统查体,必要时完善神经电生理检查。总而言之,POEMS 综合征成功治疗的关键是准确识别、快速诊断、早期干预、系统治疗,以防不可逆性神经障碍的出现,减少致残率。
