定量遗传毒性风险评估研究进展
2020-04-09朱雪娇刘运杰陈锦瑶张立实
霍 娇,朱雪娇,曾 珠,刘运杰,陈锦瑶*,张立实*
(四川大学华西公共卫生学院,四川省食品安全监测与风险评估重点实验室,四川 成都 610041)
早在20世纪70~80年代,北美、日本和欧洲就开始使用标准遗传毒性试验组合来评价外源化学物的遗传毒性从而对其进行管理[1-2]。标准遗传毒性试验通常包括一项体外基因突变试验、一项体外染色体损伤试验和一项体内染色体损伤试验。管理毒理学通常根据标准试验组合的结果,将物质分为两种,即“具有遗传毒性”和“不具有遗传毒性”,并且这一评价模式也持续应用至今[3-5]。此种定性评价物质遗传毒性的理论基础主要为“一次打击”(one-hit)模型,也就是只要存在一个具有遗传毒性的外源化学物分子与DNA 发生交互作用,即可导致DNA损伤,从而引起突变,乃至肿瘤的发生。基于“一次打击”模型理论,化学物的遗传毒性剂量-反应关系是一条直线,不存在类似于一般毒性剂量-反应关系曲线中的“阈值”。
近年来,随着高通量试验技术的发展,越来越多的研究表明化学物在低剂量下的剂量-反应关系也应为曲线。最初发现并确认这一剂量-反应关系的一类物质是非整倍体诱导剂(如秋水仙素)[6],而后研究发现诱导基因突变的物质(如甲基磺酸乙酯、甲基磺酸甲酯和N-乙基-N亚硝基脲等)也具有类似的低剂量曲线效应[7-9]。关于遗传毒性非直线剂效关系的证实促进了一系列实验技术和研究理论的迅速发展,并为遗传毒性定量评估提供了理论和实践基础。遗传毒性低剂量的非直线效应提示遗传毒性物质也可能存在一个不导致遗传毒性产生的阈值,并可将其视为一个更为实际的指导值(与致癌性不一样的保护性指标),用于物质的安全性评价和风险评估工作。
2013 年,国际遗传毒性试验工作组(International Workshop on Genotoxicity Testing,IWGT)和国际生命科学学会健康与环境科学研究所(Health and Environmental Science Institute of the International Life Science Institute,ILSI-HESI)均成立了专门的工作组对定量遗传毒性风险评估的系列问题进行了讨论,并拟定将持续关注这一问题[10-11]。2007 年罗氏公司药品奈非那韦(viracept)的甲基磺酸乙酯(ethyl methanesulfonate,EMS)污染事件,也成功将定量遗传毒性风险评估方法应用于人体实际暴露后的遗传毒性风险评估[12-13]。本文将针对定量遗传毒性的分子理论基础、定量评估方法、其在管理毒理学中的意义等内容进行介绍和总结。
1 定量遗传毒性风险评估对试验方案/方法的要求
定量遗传毒性风险评估的关键在于确定外源化学物的剂量-反应关系曲线,从而获得可作为起始点(point of departure,PoD)使用的遗传毒性阈值。PoD 是风险评估特征描述中的一个重要数值,作为外推参考剂量或是安全范围的参考点[10]。获得可靠PoD 数值需要较传统遗传毒性试验更高通量、高涵盖面、高准确度的试验,例如使用流式细胞术和自动图像分析系统等试验方法,也正是由于这些试验技术的发展才促使了定量遗传毒性风险评估的发展[14]。
1.1 高通量
在检测低剂量效应时,需要更高的统计学效能来区别更微小的差异,因此需要计数比传统方法高百倍、甚至几万倍单位数量的细胞或分子。若使用传统分析方法要耗费极大的人力和物力,此时若使用分析量更高效的方法,如流式细胞术、液相色谱-质谱联用等技术即可达到理想的统计学效能[14-15]。
1.2 高涵盖面
外源化学物的低剂量非直线效应通常在体内试验中观测,且由于遗传毒性终点较多,涉及有害终点的关键分子事件也较多,因此需要更多动物进行实验。在基于“3R”的原则上,为减少实验动物的使用,需要一个内容涵盖度更广,即可检测更多遗传学终点、具有较强整合性的试验方案。具有高兼容能力的遗传毒性试验方法,如外周血微核计数、Pig-a 基因突变试验等是满足这一条件的理想试验方法。
1.3 高准确度
试验在低剂量时具有较高的准确度和精密度是高检验效能的保证。使用客观的分析方法,如使用图像分析软件,可提高试验的准确度和精密度。
2 剂量-反应关系的定量分析方法
定量遗传评估的最终目的是确定适宜用于外推至人类健康风险评估的PoD,对于可作为PoD 使用的遗传毒性阈值仍处于讨论中[15]。目前,3 个认可度较高的推导方案为:无可见遗传毒性作用水平(no observed genotoxic effect level,NOGEL)、断点剂量(breakpoint dose,BPD)和基准剂量(benchmark dose,BMD),这3 个方案所得阈值也是IWGT 所推荐的适宜作为PoD外推的遗传毒性阈值[10]。
2.1 无可见遗传毒性作用水平
NOGEL 来源于一般毒性试验中无可见有害作用水平(no observed adverse effect level,NOAEL)的定义。NOGEL 在遗传毒性中概念和计算方法类似与NOAEL,即与对照组相比不引起相应遗传毒性终点具有统计学意义升高的最高剂量水平,低于该剂量可能存在不具有统计学意义的水平改变。NOAEL在管理毒理学中的应用十分广泛,而NOGEL 的推导方法和应用也与NOAEL 类似,是将遗传毒性视为一般毒性中的有害作用而制定。可使用Dunnett’s、Dunn’s、Dunnett’s T3检验来计算NOGEL[16]。在对数据进行差异性检验时,建议可同时进行趋势性检验[17]。特别是在具有较多剂量组的时候,趋势性检验可增加NOGEL的参考价值。
2.2 断点剂量
根据遗传毒性作用模式(modes of action,MoA),某些外源化学物(如氧化物)在低剂量下的剂效关系可能为一个曲棍形态,也就是双直线模型(图1A)。BPD即是针对这一遗传毒性作用特征,基于双线性模型(bi-linear)所推算的遗传毒性阈值。在这一模型当中,剂量-反应关系为两条直线交汇,低剂量时的直线斜率为0,较高剂量时为具有一定斜率的另一条直线。Lutz 等[18]和Muggeo 等[19]最初对双线性模型及其计算方法进行了详细描述,且该模型已成功应用于药品奈非那韦(viracept)的EMS污染事件中人类遗传毒性风险评估[12]。在实际应用时,通常选用BPD 的95%可信区间下限(the lower bound of breakpoint dose,BPDL)作为PoD。
BPD 在应用于计算PoD 时具有一定的缺陷。BPD 将化学物的剂量-反应关系拟合为两条简单的直线,而Crump[20]的研究发现大多数假设的剂量-反应关系曲线类型均可与双线性模型良好拟合,且由BPD 推算出的BPDL 常包括0 值,不能用作PoD的推算。此外BPD 在剂量拟合时较BMD 更依赖于剂量组的数量、剂量设计间距和统计学效力[21],因此IWGT 建议应在充分考虑化学物MoA的基础上使用BPD作为PoD,且若最终选择该方法推算人类健康风险时应更为慎重[10]。目前BPD可通过R软件中的drsmooth 软件包计算,使用的模型为Segmented Hockey Stick Test。
2.3 基准剂量
BMD是基于特定软件和模型推算出的,相对于背景发生的特定反应水平改变的剂量(图1B)。BMD方法是将所有实验数据纳入模型进行拟合,由最适宜的模型推算出发生特定反应水平改变时的一系列剂量。试验前确定的特定反应水平称为基准反应水平(benchmark response,BMR),由此计算出的具有统计学可信区间下限称为基准剂量下限(the lower bound of benchmark dose,BMDL)[22]。根据数据类型的不同(分类或连续型变量)、预设BMR 的不同(例如可设为5%或10%)、以及可信区间的不同(例如可为90%或95%),BMDL可包括一系列数值。因此在推算BMDL 时需要充分考虑数据类型、有害作用的生物学意义和研究目的等因素。BMD 在一般毒性评估中的应用已经较成熟[23-24],而在近年来定量遗传毒性风险评估中也开始使用这一方法计算PoD[25-26]。
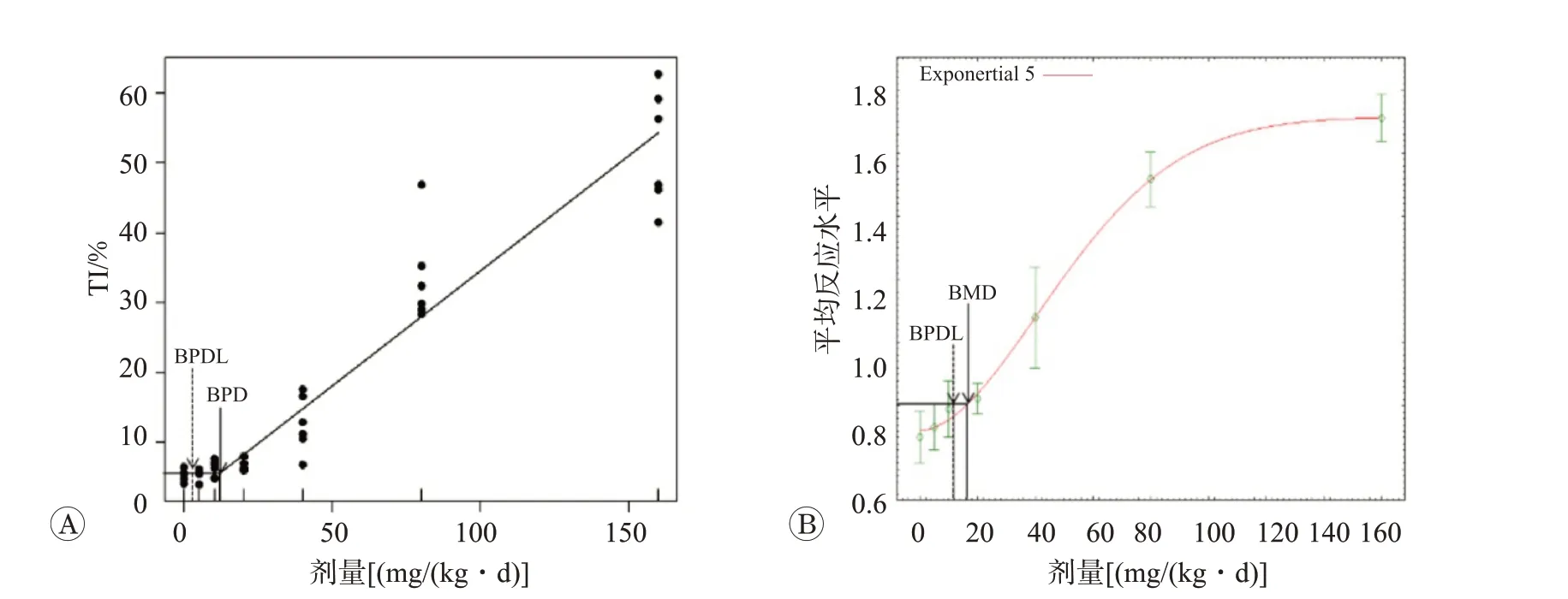
图1 EMS肝细胞彗星试验BPD和BMD模型拟合图
BMD 是一个较稳健的推算PoD 的方法,较NOAEL 和BPD而言,BMD受剂量设计间距的影响最小,且仅需要3个剂量组即可进行拟合。若BMDL 来源于拟合优度最好的模型时,BMDL 的数值较BPDL 和NOAEL 而言应是最保守的数值[10]。目前可用于计算BMD 的软件为荷兰国家公共卫生与环境研究所(the Dutch National Institute for Public Health and the Environment,RIVM)开发的PROAST[27]和美国环境保护局(U.S.Environmental Protection Agency, U.S. EPA) 开 发 的BMDS software[28]。
IWGT 和ILSI-HESI 推 荐 的PoD 采 纳 顺 序 为:BMDL>NOGEL>BPDL。由于BMD 模型充分考虑了所有数据和剂量组且较为保守,因此被推荐作为计算PoD 的首选方法[10]。用于推算PoD的3种方法的优劣总结于表1。
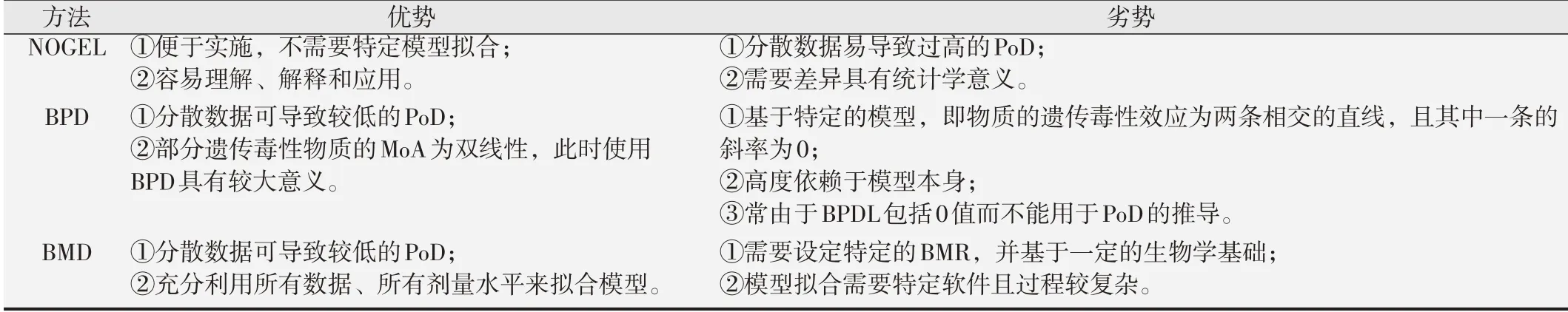
表1 NOGEL、BMD和BPD方法比较
3 定量遗传毒性风险评估在管理毒理学中的意义
相对于以往的定性评估,定量遗传毒性风险评估具有更显著的实际意义。在传统评价模式上,食品、药品中若存在遗传毒性污染物,主要风险管理策略为将暴露降至可能性的最低(reduce exposure to as low as reasonably achievable,ALARA)[29]。使用这一方法不仅大大加重了各方的负担,也使管理者无法区分风险的大小。IWGT、ILSI-HESI采用加拿大卫生部对遗传毒性的解释,认为在管理毒理学上遗传毒性更应视为一个“善意”(bona fide)的保护性终点,而非在传统意义上来说类似于致癌性的有害结局终点[10,14,30]。基于该理论,使用定量遗传毒性风险评估方法确定物质的遗传毒性剂量-反应关系曲线,可用于推算人类健康风险的暴露范围(margin of exposure,MOE)。若将遗传毒性视为一个具有保护性的终点,甚至可用于建立类似于一般毒性的暴露限值的遗传毒性参考剂量[14,31]。MOE的计算和参考剂量的建立有利于风险管理者对遗传毒性风险较高的物质进行优先评估和管理,也有助于公众和管理者在风险交流时对于不同情况下人群遗传毒性风险大小的理解。
另一方面,定量外推人类致癌性风险需要动物致癌性研究或流行病学研究数据[29],而这两类研究则需要耗费大量的时间和资源,且大部分物质的研究数据并不充分。此外,由于遗传毒性物质在环境中广泛存在,污染的发生常难以避免和预测。而当实际污染发生时,使用定性评价方法难以评估实际暴露后的风险大小,而所需定量体内致癌性数据通常难以获得。由于基于物质遗传毒性剂量-反应关系曲线所得的PoD 可用于人体健康风险的外推和MOE的计算,使用定量遗传毒性风险评估可有效解决上述两项问题。2007年罗氏公司发生药物EMS污染事件则是定量遗传毒性风险评估实际应用的成功事例。该年罗氏公司提供的艾滋病病毒蛋白酶抑制剂奈非那韦发生了EMS 污染,导致病人长达3个月暴露于低剂量的EMS。欧盟药品管理局使用定量评估方法对此次事件的实际暴露进行了评估,得出了暴露剂量不会对人体产生危害的结论[32]。
需要注意的是,不论是从生物学意义上或是从统计学意义上,目前还没有关于遗传毒性背景水平升高的明确界定[10]。从生物学上来说,很难说明超过自发突变水平的微小改变对人类遗传毒性风险和致癌性风险的影响;从统计学角度,几乎所有的生物学数据在统计学上都存在一个可计算的阈值。因此关于遗传毒性阈值的理解和应用还需要更进一步的研究和讨论。然而,IWGT和ILSI-HESI仍认为遗传毒性阈值的确立和定量遗传毒性风险评估具有重要的实际意义[31,33]。定量遗传毒性风险评估可通过获得遗传毒性剂量-反应关系曲线外推人类的健康风险,最终可为避免人类遗传毒性和致癌性风险升高采取切实可行的保护措施。
4 小结和展望
定量遗传毒性风险评估的理念近年来得到了迅速的发展,其得益于一系列高通量、高涵盖面、高准确度的自动化试验方法的建立,也反向促进了这些试验方法的迅速发展。定量遗传毒性风险评估是在实际暴露情况的基础上对人类的采取的保护性措施,相对于传统遗传毒性评价和管理模式具有更强的现实意义和保护性。尽管目前国际上还未建立关于遗传毒性剂量-反应关系的定量评估指南,也还没有建立将定量遗传风险毒性评估如何用于管理毒理学决策的指南,但定量遗传毒性风险评估策略和其伴随的新兴试验方法可能将会对外源化学物遗传毒性的评估和管理带来较大影响。
