低水平铅暴露损伤小鼠糖耐量及视网膜血管渗透性促进糖尿病视网膜病变发生
2020-04-09王晓会赵和平柳怀湘刘洁仪赵志强
王晓会,肖 琛,赵和平,吴 赛,夏 冬,柳怀湘,刘洁仪,赵志强,何 云*
(中山大学公共卫生学院,广州市环境污染与健康风险评价重点实验室,广东 广州 510080)
铅是自然界、工业及生活环境中容易接触到的一种有毒重金属。孕妇、儿童等是铅暴露与吸收的高危人群。近年,大量研究表明铅暴露并没有安全阈值[1],长期铅暴露具有心血管毒性[2]。视网膜血管是反映心血管毒物毒性的良好窗口,视网膜血管内皮细胞、周细胞以及其间的紧密连接等构成了血-视网膜屏障,维持视网膜微环境稳态。糖尿病视网膜病变是糖尿病的一种常见微血管并发症,成人失明的首要原因。血糖调节紊乱,糖耐量损害以及化学污染物等是促进糖尿病视网膜病变发生的风险因子。人群研究提示,糖尿病人群存在铅暴露水平升高现象[3],并且在职业性铅暴露人群中发现血清中血管生成因子水平升高[4]。本课题组之前的研究提示,醋酸铅暴露可以在小鼠体内破坏血脑屏障,体外内皮细胞暴露于铅,紧密连接蛋白2(zona occludens protein-2)、闭合蛋白(occludin)与密封蛋白(claudin-5)等紧密连接相关分子表达水平显著下降[5]。在我国,尽管铅污染的关注与控制水平不断加强,但持续性低水平铅暴露仍是儿童等高危人群健康危险因子。因此,本研究建立了低剂量铅暴露C57BL/6J小鼠模型,探讨从孕期开始到子代成年早期与中期持续性的低水平铅暴露对于小鼠糖耐量及视网膜血管通透性的影响,研究结果有助于解释铅暴露与糖尿病视网膜血管病变的关系及其机制,防治糖尿病视网膜病变。
1 材料与方法
1.1 实验动物及分组
实验所用48只SPF 级C57BL6J小鼠购于山东省实验动物中心,许可证号SCXK(鲁)20140007。本动物研究计划获得中山大学公共卫生学院动物伦理委员会审批(批准号2018-011)。36 只雌性小鼠和12 只雄性小鼠,于6周龄时购入,并在屏障环境中饲养检疫适应1周。小鼠铅染毒暴露的分组设计如图1 所示。用去离子水分别配制含0、10、100、500 mg/L醋酸铅的饮用水,7 周龄小鼠随机分为4 组,每组均为9 只雌鼠和3只雄鼠,采用容积为250 mL 小鼠饮水瓶供水,每日定时更换,保持每笼小鼠饮水量一致。8 周龄时,将同组雌雄鼠按3∶1的比例随机合笼。每日检查雌鼠有无阴道栓,一旦确认怀孕,分笼喂养,并记为孕0.5天。仔鼠于断奶后在其母鼠暴露水平下继续给予醋酸铅饮用水。每个醋酸铅暴露剂量水平,子代小鼠成长到8周龄时分为8周组与20周组,每组12只,均雌雄各半。8 周组在此时收集样品,利用石墨炉火焰原子吸收法检测血铅,小鼠腹腔葡萄糖耐量实验检测糖耐量水平,眼底静脉荧光造影与小动物视网膜眼底成像技术检测眼底血管渗透性以及实时荧光定量聚合酶链式反应检测视网膜血管紧密连接相关分子转录水平改变;20周组继续用醋酸铅饮用水喂养至20周龄收取样品检测。
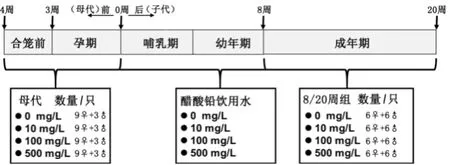
图1 小鼠铅染毒暴露的分组设计
1.2 主要试剂
FITC-Dextran,相对分子质量为70 000,三水合乙酸铅,购于美国Sigma公司;EDTA抗凝采血管购于美国BD 公司;氯仿、葡萄糖、Tris-HCL、无水乙醇、戊巴比妥钠、优级纯硝酸、异丙醇购于广州化学;mRNA 引物购于广州天一辉远公司;逆转录试剂盒购于日本TaKaRa 公司;羟丙基甲基纤维素购于沈阳兴齐眼药公司;SYBR Premix TaqTM试剂盒购于日本TOYOBO公司;Trizol购于美国Life公司;托吡卡胺购于参天制药公司;血糖试纸购于北京怡成公司。
1.3 石墨炉原子吸收光谱法检测血铅水平
首先配制铅标准溶液,使用5%硝酸稀释,得到铅标准梯度浓度为0、5、10、25、50 μg/L。每只小鼠取50 μL 的肝素抗凝血,加入5%的硝酸950 μL,振荡混匀,室温下放置15 min 后,15 000 r/min 离心10 min。最后,取铅标准梯度和800 μL 处理血样用石墨炉原子吸收光谱法测定,获得铅标准曲线并计算样本血铅含量。
1.4 腹腔葡萄糖耐量试验检测糖耐量
采用怡成5D-1 血糖仪及专用试纸检测小鼠尾静脉血糖水平。收样前3 d,对8 周组和20 周组小鼠实施糖耐量试验,提前禁食12 h,称重并检测空腹血糖水平后小鼠适应30 min;然后,小鼠按2 g/kg腹腔注射葡萄糖生理盐水溶液,分别在15、30、60、90 和120 min 后检测血糖水平,计算血糖随时间变化的曲线下面积积分(aera under curve,AUC)。
1.5 小鼠眼底视网膜血管荧光造影检测视网膜血管渗透性
使用2%的戊巴比妥钠预先麻醉小鼠,使用托吡卡胺滴眼液促进并维持瞳孔开放,羟丙基甲基纤维素保持小鼠眼睛眼睛湿润。经眼后内眦静脉丛[6]按0.25 g/kg 注入荧光素异硫氰酸酯-葡聚糖(FITC-Dextran)后,立即用小动物视网膜活体成像系统拍摄视网膜血管网明场及荧光视野的视频及照片。
1.6 实时定量聚合酶链式反应(qPCR)检测紧密连接相关分子蛋白转录
紧密连接是血视网膜屏障的主要组成部分,因此我们检测了紧密连接蛋白-1(Zona occludens protein-1,ZO-1),Occludin与Claudin-1、3、5等紧密连接相关分子,并以GAPDH 为内参。剥离小鼠视网膜,在预冷的PBS 中漂洗,使用Trizol 抽提视网膜总RNA,再逆转录成cDNA,各基因的引物序列如表1所示。各基因转录水平按照SYBR Premix TaqTM试剂盒说明书进行qPCR反应体系配制,最后使用2-ΔΔCT法对其相对定量并进行组间比较。

表1 qPCR引物序列表
1.7 统计分析
采用SPSS 20.0 统计学分析,计量数据采用xˉ±s表示,组间两两比较采用t检验,3组或以上样本采用单因素方差分析(ANOVA),线性回归分析分析醋酸铅外暴露与血铅水平的关系,以a=0.05为检验水准。
2 结 果
2.1 不同醋酸铅暴露水平对小鼠血铅水平的影响
醋酸铅染毒8 和20 周组小鼠的血铅水平如图2 所示,随着饮水中醋酸铅浓度的升高,小鼠血铅浓度与对照小鼠相比显著升高,存在剂量反应关系(r8周组=0.887,r20周组=0.972,P 均<0.05)。值得注意的是,在100 mg/L 剂量以下,染毒8 周组小鼠的血铅浓度高于染毒20 周组(P<0.05);在500 mg/L 剂量下,染毒8 周组小鼠的血铅浓度低于染毒20周组(P<0.01)。
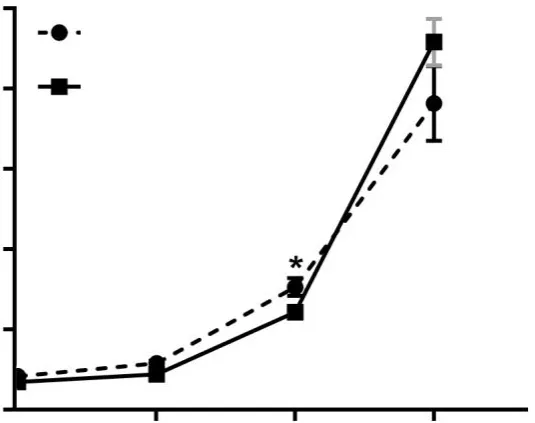
图2 不同浓度醋酸铅染毒8和20周的小鼠血铅浓度的变化
2.2 不同醋酸铅暴露水平对小鼠糖耐量的影响
染毒8和20周小鼠空腹腹腔注射葡萄糖后,血糖变化及其血糖随时间变化曲线下面积积分AUC 比较,如图3 所示,铅暴露小鼠2 h 血糖值高于对照组小鼠。铅暴露小鼠AUC 高于对照组小鼠(P<0.05 或P<0.01)。在染毒8 周组,小鼠血糖及AUC 在10 mg/L 醋酸铅染毒时与对照组差异最明显,而在染毒20周组小鼠在100 mg/L醋酸铅染毒时与对照组差异最明显。
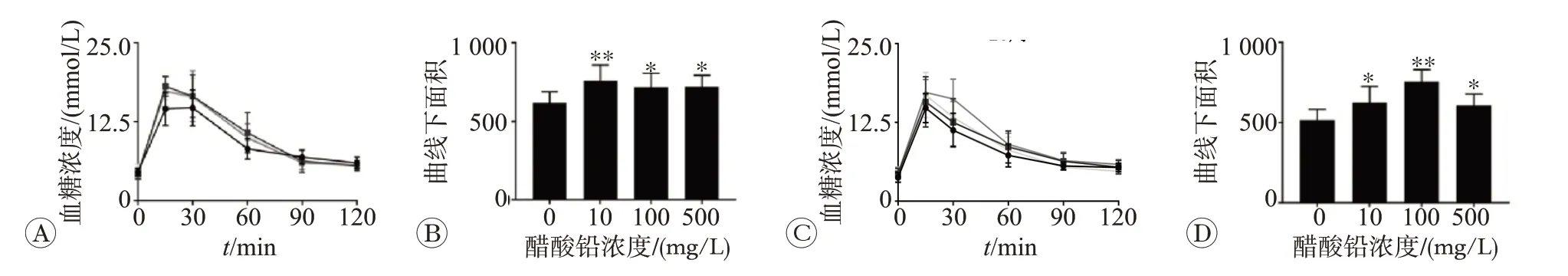
图3 不同浓度醋酸铅染毒8和20周的小鼠糖耐量的变化
2.3 不同醋酸铅暴露水平对小鼠视网膜血管渗透性的影响
相对分子质量为70 000的FITC-Dextran与血清白蛋白相对分子质量相近,已应用于评估血管渗漏性。如图4A~D所示,在染毒8周组,小鼠暂未出现明显视网膜血管渗漏病灶。图4E~H 所示,在染毒20 周组,100 与500 mg/L 醋酸铅染毒剂量下,小鼠视网膜出现明显的渗漏病灶。
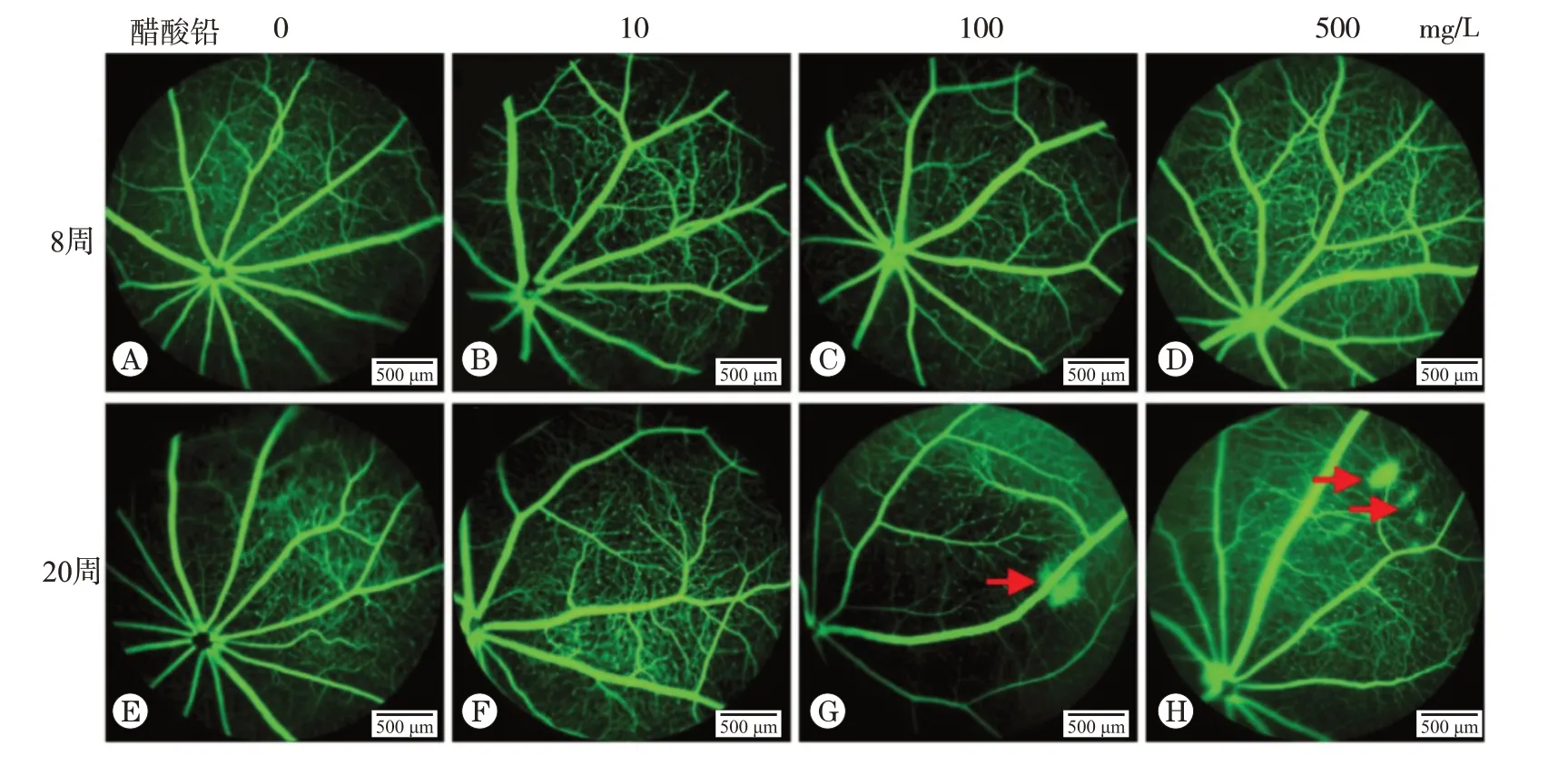
图4 不同浓度醋酸铅染毒8和20周的小鼠视网膜血管渗漏情况
2.4 不同醋酸铅暴露水平对小鼠视网膜血管内皮细胞间紧密连接的影响
紧密连接是血视网膜屏障的主要组成部分,紧密连接组成组分分子的表达改变会严重影响紧密连接功能,进而改变血管渗透性。因此我们检测了ZO-1,Occludin与Claudin-1、3、5等紧密连接相关分子,采用qPCR 技术检测了视网膜组织中ZO-1,Occludin 和Claudin-1、3、5等蛋白分子的mRNA转录水平,结果如图5 所示。在染毒8 周组,随着醋酸铅浓度升高,ZO-1 与Claudin-1、3、5 蛋白分子转录水平呈现先增后减的趋势,而Occludin 蛋白分子的mRNA 转录水平受到抑制,与对照组小鼠相比差异显著(P<0.05 或P<0.01)。在染毒20周组,随着醋酸铅浓度的升高,ZO-1,Occludin 和Claudin-1、3、5 蛋白分子的mRNA 转录被广泛抑制,与对照组小鼠相比差异显著(P<0.05或P<0.01)。
3 讨 论
铅作为一种化学污染物,其显著毒性在神经系统与血液系统,近年来,慢性铅中毒引起的代谢毒性与心血管毒性受到关注[2-3,7-8]。铅经过生活饮用水、空气、食品和工业品等介质进入人体,饮用水是主要途径之一。我国多次出现工厂违规排污导致地表水受含铅等重金属污染事件[9];另一方面,供水管道内易发生铅溶出导致家庭饮用水等受到铅污染[10-11]。胎儿和儿童是环境铅暴露高危人群[8,12]。早期研究提示,100 mg/L铅暴露即可导致视觉功能受损及视网膜结构损害[13-14]。500 mg/L 醋酸铅成年期暴露ZDF 肥胖大鼠空腹血糖出现升高,糖耐量受损[15]。本研究结果显示,幼年期或成年期小鼠暴露于500 mg/L醋酸铅均可破坏小鼠血脑屏障,导致脑组织渗透性显著升高。体外研究提示,脑内皮细胞暴露于铅,会导致紧密连接相关蛋白分子ZO-2,Occludin 与Claudin-5 表达水平显著下降[5]。近年体内研究提示,成年期SD大鼠暴露于200 mg/L醋酸铅可能导致血视网膜屏障被破坏,外源示踪剂Evans Blue 渗漏增加,其Occludin 与Claudin-5等紧密连接蛋白表达受到抑制[16]。而幼年期铅暴露对于视网膜血管与糖代谢的影响却缺乏证据,因此,研究幼年期饮水铅暴露更具有重要公共卫生意义。
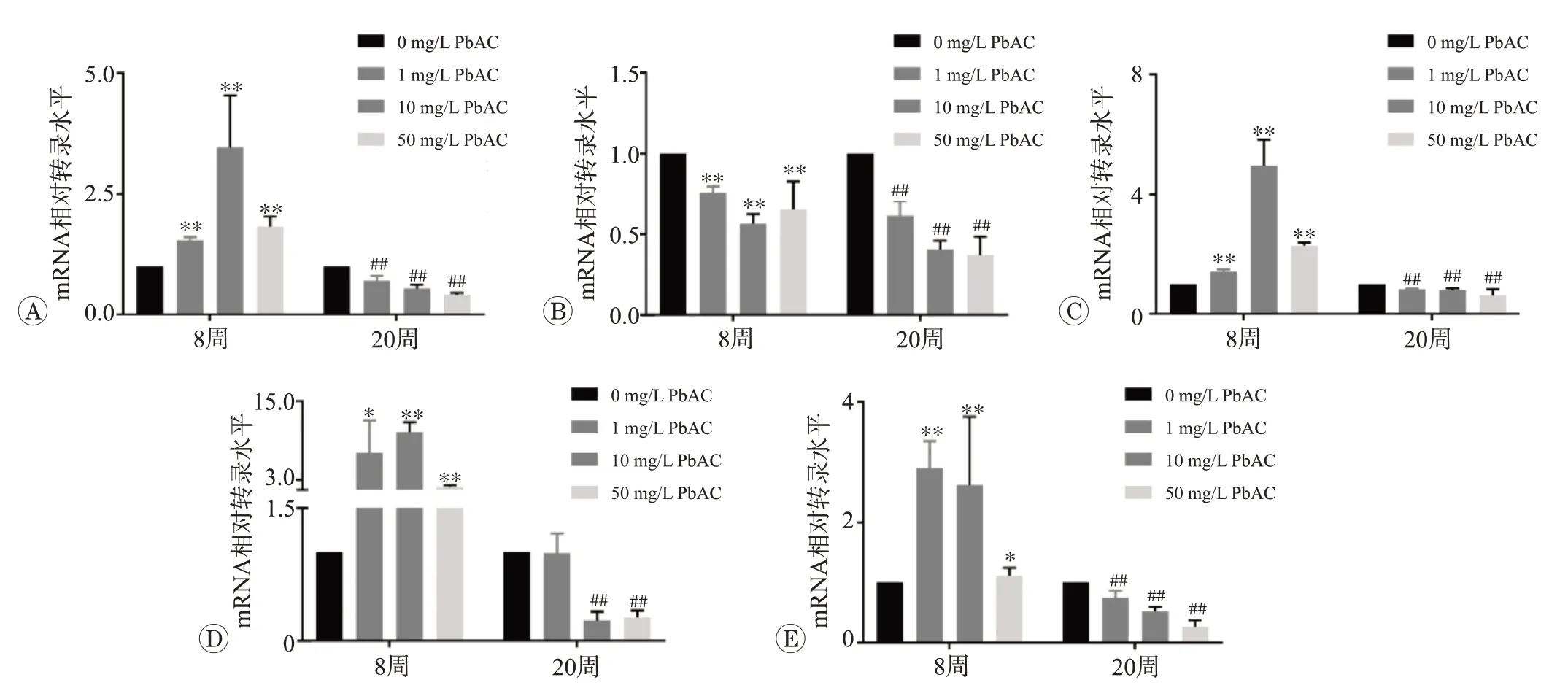
图5 不同浓度醋酸铅染毒8周和20周的小鼠视网膜紧密连接相关蛋白分子的mRNA转录水平的变化
血铅能较好地反映近期铅暴露水平,染毒8 周组反映了幼年期小鼠对铅暴露更敏感,吸收度高而排泄能力不足。进入成年期后,小鼠对铅暴露敏感度下降而排泄能力更强。结果显示,在0~100 mg/L范围内成年期小鼠血铅更低,而较高的500 mg/L暴露水平呈现了逆转,反映了铅排泄的失代偿。
糖尿病视网膜病变是糖尿病的主要并发症类型。高血糖,糖耐量损伤及化学污染物等是其主要危险因素[7,17]。整体上,从染毒8 周与20 周两组小鼠对照水平比较提示,成年小鼠空腹注射葡萄糖后血糖及AUC更低,AUC越低,对血糖的调节能力越强。小鼠在幼年期,糖耐量试验中与对照组相比,醋酸铅染毒小鼠血糖更高,AUC更高,反映了血糖调节能力更低。在染毒8 周组,小鼠血糖调节能力在10 mg/L 醋酸铅浓度下改变最明显,其并不简单的表现为线性剂量反应关系。进入成年期后,小鼠本身的糖耐量能力是增强的,在0~100 mg/L 剂量范围内呈现剂量-反应关系,小鼠血糖调节能力在100 mg/L醋酸铅浓度下改变最明显。总体上,铅暴露会一定程度上破坏小鼠的血糖调节能力。幼年期极低剂量的铅暴露即可导致糖耐量的损害。进入成年期,铅暴露仍然会导致血糖调节能力下降,但其对铅暴露的敏感剂量提高,但其损害程度相较幼年期无显著地差异。这提示,幼年期极低剂量的铅暴露对机体糖代谢的损害更为危险。也再次提示铅暴露没有“安全剂量”。铅暴露导致的血糖调节能力下降,间接可能促进糖尿病视网膜病变的发生。
本研究进一步直接观察了铅暴露对于视网膜血管渗透性的影响。在染毒8 周组幼年期阶段,紧密连接相关分子ZO-1,Occludin 与Claudin-1、3、5 等在铅暴露的刺激下,呈现转录先增加后减少的表现,体现了血管应对外界刺激的一种应激代偿反应,血管间的紧密连接并未失代偿,血视网膜屏障保持其功能完整良好。在染毒20周组,进一步在成年期铅暴露导致了紧密连接的破坏,功能失代偿,血管出现渗漏表现。提示,铅暴露可直接损伤血视网膜屏障,并引起渗漏,其部分机制可能涉及紧密连接的破坏。这些结果与先前在成年期SD大鼠的结果相印证[16],这表明铅暴露对于血视网膜屏障的破坏是进展性的,幼年期虽然已经存在分子水平变化,但并不敏感。持续的铅暴露,在成年期后会直接损害血视网膜屏障,导致糖尿病视网膜血管病变等疾病的发生。
综上所述,在本次研究中我们发现极低的铅暴露剂量仍然存在健康风险,幼年期的铅暴露在极低剂量条件下就能导致小鼠血糖调节能力下降。长期铅暴露可以直接诱导视网膜血管损伤,其机制可能涉及紧密连接的破坏。
