柠檬酸转运体SLC25A1对食管鳞癌细胞体外放射敏感性的影响及其分子机制
2020-04-09林重华舒易方瞿家权宋淑亮
师 盼,林重华,舒易方,瞿家权,宋淑亮*
(1.山东大学海洋学院,山东 威海 264209;2.陆军军医大学第一附属医院消化内科胆汁淤积肝病中心,重庆 400038;3.吉首大学医学院医学影像技术系,湖南 吉首 416000;4.陆军军医大学第一附属医院肿瘤科放疗中心,重庆400038)
食管癌是全球第七大常见癌症,也是第六大癌症死因,遗传、烟草、酒精、热饮、机械损伤、胃食管反流疾病、巴雷特食管、肥胖等因素是其高危因素[1]。与欧美国家比较,我国食管癌组织学类型[2]中食管鳞癌(esophageal squamous cell carcinoma,ESCC)的比例高,而食管腺癌(esophageal adenocarcinoma,EAC)的比例低。放射治疗(radiotherapy)[3]是不可手术的中晚期食管癌综合治疗的重要策略,然而即便采取包括根治性同步放化疗、姑息性手术等综合治疗,局部晚期食管癌局控失败率和远处转移率仍很高,5 年总的生存率约为20%,总体预后不良[4]。获得性放疗抵抗(radiotherapy resistance)[5]是指肿瘤初期对放疗敏感但分割放疗后短时间内发生复发和进展的临床现象,也被认为是局部食管癌复发或治疗失败重要原因之一,并成为制约食管癌预后和疗效改善的障碍。目前,大量研究提示[6],乏氧、线粒体能量代谢状态、线粒体膜通透性及电位改变、活性氧(reactive oxygen species,ROS)水平和肿瘤干细胞特征与获得性放射抵抗密切相关,但放射抵抗的确切机制仍不清楚。
线粒体溶质载体家族25A1(solute carrier family 25 member 1,SLC25A1)[7]又称为柠檬酸转运蛋白或三羧酸盐转运体,其缺失突变与人类疾病羟基戊二酸尿症和肌无力综合征相关。SLC25A1蛋白细胞亚定位于线粒体内膜[7],其主要功能是柠檬酸盐转运的主要载体,参与线粒体氧化磷酸化及能量代谢。近年研究证实[8],SLC25A1在多种肿瘤存在高表达,是p53突变体一个新的转录靶点,具有调控肿瘤细胞乏氧耐受,可作为肿瘤预后不良的生物标志物。因此,本研究采用TCGA 肿瘤组织数据库比较食管腺癌、食管鳞癌与癌旁组织的SLC25A1 基因表达差异,通过构建放射抵抗和放射敏感食管鳞癌细胞系并证实放射抵抗食管鳞癌细胞存在SLC25A1 表达上调,采用体外放射模型评估SLC25A1 敲低对食管癌细胞系放射敏感性的影响,并初步探讨SLC25A1 参与放射抵抗的分子机制,为筛选放射增敏靶点提供依据。
1 材料与方法
1.1 材料
1.1.1 细胞人食管鳞癌细胞系KYSE150 由中南大学高等研究中心细胞保藏室购买,10%胎牛血清RPMI-1640 完全培养基,置于CO2体积分数为5%、37 ℃的细胞培养箱,常规胰酶消化,对数生长期细胞备用。放射抵抗的食管鳞癌细胞株[9]采用X 射线多次亚致死剂量暴露法建立。本研究采用的放射抵抗KYSE150-R 和对照组放射敏感KYSE150 细胞株均为多轮亚致死剂量的X射线照射后传至第4~15代,并用体外放射克隆存活法鉴定。
1.1.2 试剂RPMI-1640 培养基为Gibco 公司产品;胎牛血清为以色列Biological Industries 生物有限公司产品;胰蛋白酶、NP-40 细胞裂解液、Hoechst33258荧光染料溶液、0.5%结晶紫染料、ROS染色流式检测试剂盒购于碧云天生物技术有限公司;蛋白酶和磷酸化酶抑制剂为美国Roche 公司产品;转染试剂Lipofectamin 2000 脂质体为美国Thermo Fisher 公司产品;β-actin和SLC25A1单克隆抗体以及抗兔和抗鼠二抗均为美国Proteintech 公司产品,Phospho-Histone H2A.X(Ser139) 位点磷酸化和Phospho-DNA-PKcs(Ser2056)位点磷酸化及Histone H2AX 和DNA-PKcs 单克隆抗体均为美国CST公司产品。
1.1.3 质粒及引物SLC25A1-shRNA 质粒购于山东维真生物公司,参考SCL25A1 的基因编号NM_005984;产品编号SH874543,提供4个不同干扰位点的shRNA质粒及对照组Scramble shRNA,载体名称为pLent-U6-GFP,大小约1 000 bp,具有U6,CMV,eGFP 元件及嘌呤霉素抗性,质粒序列见表1。SLC25A1及GAPDH上下游引物见表2。
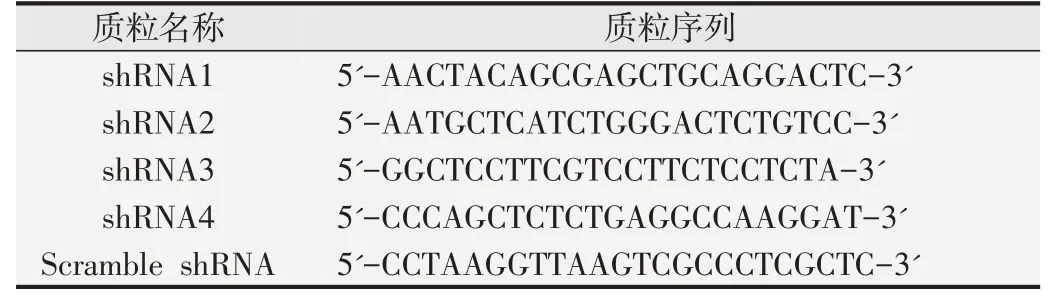
表1 SLC25A1 shRNA质粒及对照Scramble shRNA质粒序列

表2 SLC25A1和GAPDH基因上下游引物序列
1.1.4 仪器双目倒置相差显微镜,产自日本奥林巴斯公司,CKX31 型;CO2细胞培养箱,产自美国赛默飞公司;双目倒置荧光显微镜,产自德国莱卡公司,DM-IL 型;流式细胞仪,产自美国BD 公司,FACSVerse 型;医用直线加速器,产自美国瓦里安公司,Clinac 2300 C/D 型,小型垂直电泳和转膜系统,产自美国伯乐公司,Bio-Rad Mini-PROTEAN型。
1.2 方法
1.2.1 TCGA数据库差异表达基因分析通过癌症基因组图谱(The Cancer Genome Atlas,TCGA)数据库官方网站(https://www.cancer.gov/about-nci/organization/ccg/research/structural-genomics/tcga)及由阿拉巴马大学伯明翰分校UALCAN 交互式网络工具(http://ualcan.path.uab.edu/index.html)[10]分析TCGA 肿瘤组学数据。简要步骤如下:①通过TCGA 数据库选择“Esophageal carcinoma”全部下载所有可比的mRNA 表达谱、RNAseq 或基因表达谱芯片的数据并进行手工筛选;②采用UALCAN 交互式网络工具选择“Esophageal carcinoma”数据库集并与TCGA 数据库下载文档进行比对,包括食管组织(包括巴雷特食管)组织及癌旁正常食管组织、食管腺癌、食管鳞癌3 种mRNA 表达谱、RNAseq 或基因表达谱芯片数据纳入的分析,并比对两个数据库所获得组织的差异,最终确定纳入研究的组织队列;③在UALCAN 网站界面的Enter gene symbol(s)框中输入SCL25A1,以及在TCGA dataset 下拉菜单输入“Esophageal carcinoma”,选择表达谱“Expression” 比 较, 获 得Normal-vs-Primary 队 列SLC25A1 的表达差异分布图,包括纳入样本量、极值、中位数、四分位数及P 值,在下拉菜单的亚组分析选择“Histology type”比较,获得Normal-vs-Adenocarcinoma 和Normal-vs-Squamous-cell-carcinoma的表达差异分布图、样本量、极值、中位数、四分位数及P值。
1.2.2 放射克隆存活法分析细胞放射敏感性放射敏感细胞和放射抵抗细胞株常规6 孔培养板按3 种细胞密度接种(分别为500、1 000、2 000 个/孔),待细胞贴壁后,培养板上层覆盖1.0 cm 补偿胶,皮源距100 cm,等中心照射,深度d=2.5 cm,吸收率为200 cGy/min,分别暴露于灯光野假照射(Sham-radiation),1.0、2.0、4.0、6.0、8.0 Gy 的梯度剂量的X-射线下(6 MeV),照射后继续培养14~18 d,结晶紫染色,50个细胞以上克隆计数。按公式计算克隆效率和生存分数:
以未经X-射线照射细胞为对照。采用GraphPad Prism 5.0 软件,按照线性二次方程模型S=e-aD-BD2拟合剂量反应曲线,其中S 为生存分数,a 和b 为常数,D 为剂量,按积分法计算存活曲线下面积(area under the curve,AUC)和放射增敏比(sensitization enhancement ratio,SER)。
1.2.3 稳定敲低SLC25A1 表达食管癌细胞系构建取对数生长期KYSE150-R 细胞,每孔10 000 个细胞接种于6 孔板中,完全培基细胞接种过夜后,RPMI-1640 培 养 基 洗 涤 六 孔 板5 次, 采 用250 μL Lipofectamin 2000 包被2.0 μg pLent-U6-GFP-SLC25A1 shRNA质粒及对照组Scramble shRNA质粒,分别转染细胞,8 h后更换完全培养基,24 h后依照TRIZOL法提取RNA,检测4 种质粒敲低SLC25A1 的效率,选择敲低效率超过80%以上的两个质粒作为后续慢病毒感染质粒。按照试剂说明书中慢病毒感染试剂操作步骤感染KYSE150-R 细胞,用于筛选的嘌呤霉素浓度为1.6 μg/mL,选取耐药和表达绿色荧光的单克隆继续筛选完全培基中加入0.8 μg/mL 嘌呤霉素进行培养,并鉴定上述耐药具有荧光的克隆,最终获得2~3 株经免疫印迹法鉴定的稳定敲低SLC25A1 表达的KYSE150-R细胞。
1.2.4 Hoechst 染色检测细胞凋亡取对数生长期KYSE150和KYSE150-R细胞,以每孔5 000个细胞接种于6 孔板中,完全培基细胞接种过夜后,次日开始给予常规分割放射(总剂量6 Gy,1.2 Gy/次,1 次/d×5 d)处理细胞,对照组细胞给予假照射处理,继续培养24 h,收集贴壁细胞,多聚甲醛冰上固定20 min,5 μg/mL Hoechst 33258 溶液重悬细胞避光孵育10 min,荧光显微镜下观察典型的凋亡细胞在形态学上可出现染色质固缩,核碎裂以及核发泡等改变。凋亡细胞百分比计算方法为:在5 个随机显微镜视野下选取200个细胞计算其中的凋亡细胞数目,重复3次。
1.2.5 流式细胞术ROS 检测法取对数生长期KYSE150和KYSE150-R细胞,以每孔5 000个细胞接种于6 孔板中,完全培基细胞接种过夜后,次日开始常规分割放射(总剂量6 Gy,1.2 Gy/次,1次/d×5 d)处理细胞,对照组细胞给予假照射处理,继续培养24 h,收集贴壁细胞,按碧云天公司ROS 流式检测试剂盒操作说明,简要步骤如下按照1∶1 000稀释加入的二 氯 双 氢 荧 光 素 二 乙 酸 酯 (2',7'-dichlorodihydrofluorescein diacetate,DCFH-DA)染 色液,终浓度为10.0 μmol/L,避光孵育15 min,随后采用无血清1 640 培养基洗涤3 次,上机流式细胞仪检测荧光强度,激发光488 nm,发射光525 nm,实验重复3次。
1.2.6 免疫印迹法加蛋白酶和磷酸化酶抑制剂的NP-40 细胞裂解液处理待检测细胞,于冰上裂解45 min,常规细胞刮取细胞;4 ℃,50 W 功率超声2 s,125 000 g离心30 min,吸取上清,BCA法蛋白定量,常规煮沸变性5 min,样品蛋白上样量为每泳道60 μg,10% SDS-PAGE变性凝胶电泳,电泳条件:积层胶50 V,分离胶120 V恒定电压电泳分离,全湿三明治法电转条件:恒定电流100 mA,电转移时间1.5 h,印迹膜为0.22 μm的PVDF膜。5%BSA室温下封闭1 h,随后分别加入下列不同稀释比例的一抗4℃冰箱孵育过夜(β-actin一抗按1∶5 000稀释;SLC25A1一抗按1∶500 稀释;磷酸化H2A.X(Ser139)和磷酸化DNAPKcs(Ser2056)、H2AX、DNA-PKcs 均按1∶1 000 稀释),室温下加入二抗孵育1.5 h(均按1∶5 000 稀释),加发光剂后压片5~10 min,显影定影3~5 min,采用300 dpi对胶片扫描导入条带分析软件分析。
1.3 统计学方法
计数资料采用均数±标准差表示,计量资料采用频数表示,均数两两比较采用SPSS 15.0 软件行t 检验,体外放射克隆存活曲线采用线性二次方程模型拟合;以α=0.05为检验水准。
2 结 果
2.1 TCGA 数据库食管癌与正常组织SLC25A1 基因表达的差异
通过阿拉巴马大学伯明翰分校UALCAN交互式网络工具分析TCGA 数据库中食管癌组织与正常组织的SLC25A1基因表达水平的差异(图1)。结果显示,纳入食管癌组织184例,正常食管组织11例。与正常食管组织比较,食管癌组织(不分组织类型)中SLC25A1 基因表达升高1.65 倍(P=1.64×10-4);其中,食管腺癌升高1.63倍,食管鳞癌升高1.72倍(P均<0.05)。

图1 TCGA数据库食管癌组织与正常组织SLC25A1基因表达水平差异
2.2 放射抵抗和放射敏感食管鳞癌细胞系SLC25A1基因差异表达
采用6 MeV X射线多轮亚致死剂量暴露法筛选并建立放射抵抗和放射敏感的食管鳞癌KYSE150-R 和KYSE150细胞株,并采用放射克隆存活实验线性二次方程靶模型验证细胞系放射敏感性。结果显示,KYSE150-R 细胞株LQ 模型克隆存活曲线下面积(AUC=1.834)与对照组比较(AUC=1.536)上调(P<0.05;SER2Gy=0.84)(图2A、B),提示成功构建放射抵抗食管鳞癌细胞株及对照放射敏感细胞株。免疫印迹和qPCR 法对两株细胞检测结果证实,与对照组KYSE150 比 较, 放 射 抵 抗KYSE150-R 细 胞 株SLC25A1 蛋白和mRNA 水平表达均上调(P<0.05)(图2C、D)。

图2 放射抵抗食管癌细胞株与放射敏感细胞株SLC25A1基因表达水平差异
2.3 SLC25A1 稳定敲低对放射抵抗食管鳞癌细胞凋亡的影响
首先构建SLC25A1 稳定改变的放射抵抗食管鳞癌细胞,采用4 种SLC25A1 shRNA 质粒及对照组Scramble shRNA 分别转染KYSE150-R 细胞,qPCR 法检测SLC25A1 mRNA 表达改变,结果证实SLC25A1 shRNA1 和SLC25A1 shRNA3 干扰效率超过70%,可作为有效干扰质粒(图3A);采用SLC25A1-shRNA1 和SLC25A1 shRNA3 质粒包装慢病毒并感染细胞,成功构建并免疫印迹法验证2 株稳定敲低SLC25A1 的KYSE150-R细胞(图3B)。
为了分析SLC25A1 基因在食管癌放射抵抗中的作用机制,采用多分割放射X-射线(总剂量6 Gy,1.2 Gy/次,1 次/d×5 d)照射KYSE150-R/SLC25A1 KD 细胞株及对照KYSE150-R/Scramble shRNA-NC 细胞株,Hoechst染色凋亡形态学检测分析结果证实,与对照组[(17.94±5.20)%]比较,KYSE150-R/SLC25A1 KD细胞株凋亡率[(28.35±6.30)%]显著增加1.58 倍(P<0.05)(图3C)。同时,放射克隆存活实验线性二次方程靶模型证实,与对照组比较(AUC=1.96),KYSE150-R/SLC25A1 KD 细胞株LQ 模型克隆存活曲线下面积(AUC=1.61)显著降低(P<0.05;SER2Gy=1.22)(图3D)。
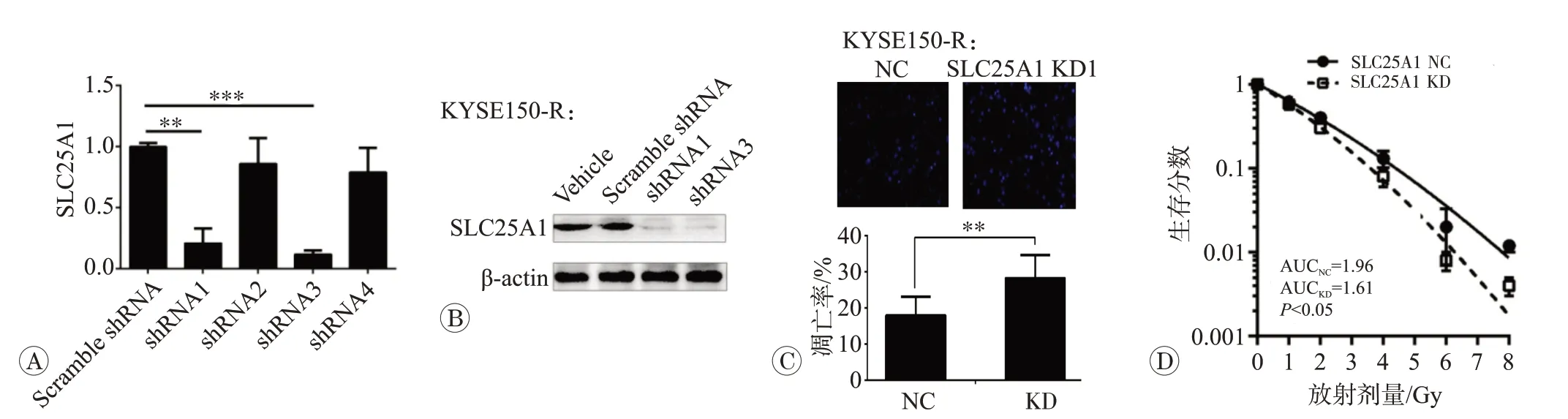
图3 SLC25A1基因稳定敲低诱导食管癌细胞株凋亡增强放射敏感性
2.4 SLC25A1通过抑制DNA损伤修复诱导放射增敏
为了分析SLC25A1 基因是否通过调控ROS 水平诱导放射增敏的作用,采用多分割放射X-射线(总剂量6 Gy,1.2 Gy/次,1 次/d×5 d)照 射KYSE150-R/SLC25A1 KD 细胞株及对照KYSE150-R/Scramble shRNA-NC 细胞株,流式细胞术检测ROS 水平结果显示,与对照组比较,KYSE150-R/SLC25A1 KD细胞株ROS 水平降低了(65.3±14.3)%(P=0.007)(图4A~B)。随后,采用免疫印迹法分析敲低SLC25A1对放射诱导的DNA 损伤修复关键分子信号传导的影响,结果证实,与对照组比较,KYSE150-R/SLC25A1 KD细胞株的磷酸化H2AX(Ser139)和磷酸化DNA-PKcs(Ser2056)水平显著降低(图4C)。
3 讨 论
食管鳞癌是放化疗敏感的恶性肿瘤,同步放化疗是目前局部晚期不可手术切除的食管癌标准治疗方案[3]。然而,放疗靶病灶内残留生存的肿瘤细胞发生局灶复发和远处转移,导致肿瘤治疗失败,影响肿瘤患者预后,已成为临床上肿瘤治疗的棘手问题[2-3]。目前,放疗靶区内肿瘤复发的分子机制仍不清楚,而获得性放射抵抗被认为是其关键影响因素。溶质转运体SLC25A1[7-8,11]通过调控柠檬酸的跨线粒体转运,具有保护线粒体损伤和通过自噬途径抑制线粒体损耗的作用,在代谢活跃和高增殖的组织中参与维持线粒体内稳态和生物能量生产,并参与调控ROS水平。本研究以我国发病率较高且放疗作为主要治疗方法瘤种——食管鳞癌为研究对象,以获得性放射抵抗模型为切入点,采用国际通用的TCGA 肿瘤组织数据库分析证实食管癌与正常组织存在SLC25A1表达上调,放射抵抗食管鳞癌细胞存在SLC25A1表达上调,并采用体外放射模型初步证实下调SLC25A1表达通过抑制DNA损伤修复机制,进而诱导食管癌细胞凋亡的分子机制,为进一步筛选食管癌放射增敏分子靶点和临床转化提供实验依据。
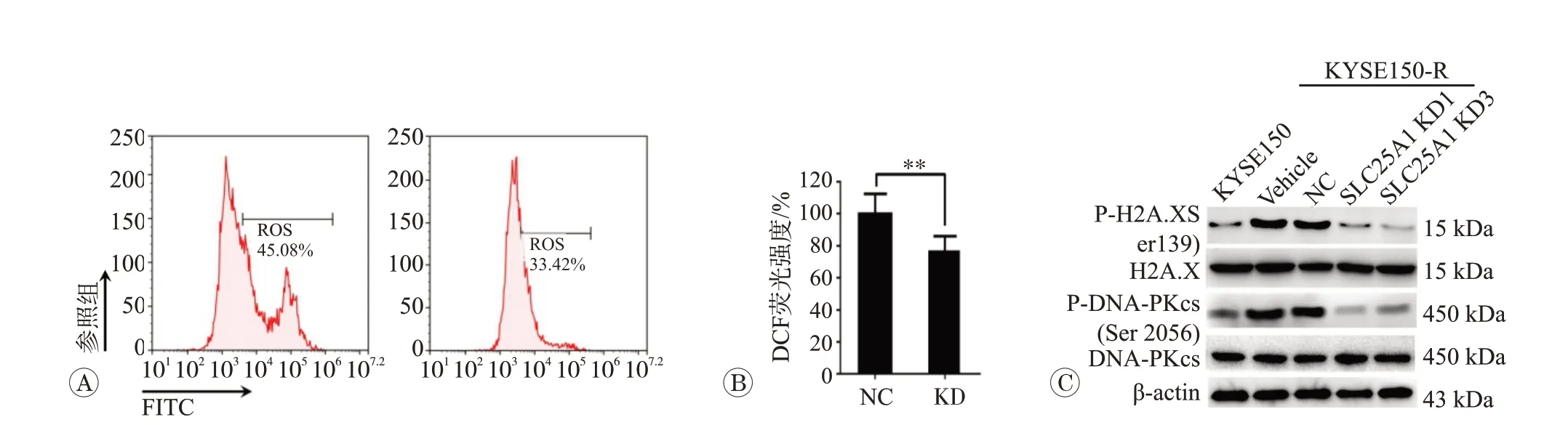
图4 稳定敲低SLC25A1通过抑制DNA损伤修复诱导放射增敏
首先,本研究采用UALCAN交互式网络工具分析TCGA 数据库中食管癌组织与正常组织的SLC25A1 表达差异,结果证实,与正常食管组织比较,食管癌组织、食管鳞癌组织、食管腺癌组织SLC25A1 基因mRNA 水平表达均显著升高。随后,我们采用多轮亚致死剂量暴露法成功建立放射抵抗和放射敏感对照组食管鳞癌细胞株(KYSE150-R 和KYSE150 细胞)。随后进一步证实,放射抵抗食管鳞癌细胞株存在SLC25A1蛋白表达水平和mRNA 表达水平显著上调。与SLC25A1 在乳腺癌、肺癌、结肠癌等肿瘤组织的报道类似[7-8],SLC25A1 在多种肿瘤中可能作为一种潜在癌基因参与肿瘤发生、恶性表型维持以及化疗耐药。结合本研究结果提示,SLC25A1 基因可能作为一种致癌基因参与食管癌发病和放射抵抗等恶性表型。在生理学功能方面溶质转运体SLC25A1 主要通过调控柠檬酸的跨线粒体转运维持线粒体内稳态并参与氧化磷酸化过程[12],而在光子放射诱导的氧化应激和放射抵抗条件下SLC25A1 发挥何种功能仍未充分研究。为了进一步分析SLC25A1 是否参与食管鳞癌放射抵抗,本研究成功构建SLC25A1 敲低的放射抵抗食管鳞癌细胞株(KYSE150-R/SLC25A1 KD1 和KYSE150-R/SLC25A1 KD3)及对照组细胞株。通过稳定敲低SLC25A1 表达分析放射诱导的细胞凋亡以及对食管鳞癌体外放射敏感性的影响,结果证实,敲低SLC25A1 表达可增加放射诱导的细胞凋亡,并部分逆转食管癌细胞体外放射抵抗而诱导放射增敏。一般而言[13],放射线及其诱导产生过量的ROS 损伤DNA 等生物大分子,诱导肿瘤细胞凋亡,发挥放射治疗作用。为了分析SLC25A1 是否通过ROS水平调控参与放射抵抗过程,本研究采用流式细胞术检测多分割亚致死剂量下放射抵抗细胞株中ROS水平。然而与预期相反,在多分割放射条件下,放射抵抗食管鳞癌细胞株敲低SLC25A1 基因表达并未如预期ROS水平升高而是出现ROS水平具有统计学意义的轻微降低(P<0.05)(图4)。我们推测出现这种差异性现象的原因,ROS水平在不同条件下对细胞的作用存在争议[14]。一方面,模型选择上放射抵抗食管鳞癌细胞株在基线水平具有耐受多分割光子射线能力,反映出放射抵抗细胞株耐受高水平ROS所诱导的细胞凋亡作用;另一方面亚致死剂量照射可激活细胞DNA损伤修复能力具有抵抗凋亡的作用。随后,采用免疫印迹法分析SLC25A1敲低对放射诱导的DNA损伤修复关键分子信号的影响,结果进一步证实,敲低SLC25A1 基因表达通过抑制DNA损伤修复能力诱导放射抵抗食管鳞癌细胞株。值得注意的,大量研究证实[15-16],ROS 水平对细胞的作用存在差异,亚致死剂量放射线诱导适度的ROS水平参与肿瘤放射抵抗而过量的ROS水平通过细胞死亡配体信号途径诱导细胞凋亡,而低水平的ROS 具有维持适度氧化应激作用发挥相应的生理功能。人类SLC25A1 的同源果蝇scheggia(sea)编码Sea 蛋白的突变,通过影响柠檬酸盐从线粒体向细胞质的运输,敲低Sea 可诱导细胞周期阻滞,而通过短干扰RNA(siRNA)处理的人类原代成纤维细胞,SLC25A1 表达敲低导致染色体断裂和组蛋白乙酰化缺陷,提示SLC25A1具有维护染色体完整性方面具有进化保守作用[17]。本研究发现通过在放射抵抗食管癌细胞株敲低SLC25A1表达联合X-放射线暴露处理,可诱导细胞凋亡增加。我们推测敲低SLC25A1 通过诱导细胞周期阻滞、诱导染色体断裂和组蛋白乙酰基化缺失和抑制DNA 损伤修复等方面,破坏染色体完整性,增强X-射线诱导的食管癌细胞死亡,具有逆转放疗抵抗的潜力。因此,本研究提示SLC25A1 在亚致死剂量X 射线暴露下通过维持细胞ROS水平,增强DNA损伤修复能力,诱导细胞抗凋亡作用,而下调SLC25A1 表达具有克服放射抵抗的作用的潜力,但需要评估氧化磷酸化和氧耗率差异并采用裸鼠移植瘤放射动物体内模型进一步验证。
综上所述,TCGA 数据库比较食管癌与正常组织差异比较证实食管癌组织存在SLC25A1 表达上调;多轮亚致死剂量暴露法构建的放射抵抗食管鳞癌细胞株也存在SLC25A1 表达上调;SLC25A1 可能作为一种参与放射抵抗和肿瘤发病的候选癌基因。放射抵抗食管癌细胞系敲低SLC25A1表达,通过下调ROS水平抑制DNA 损伤修复诱导细胞凋亡,发挥放射增敏作用。SLC25A1 可作为一种潜在的食管鳞癌放射增敏分子靶点。
