NaCl浓度对SBBR同步脱氮及N2O释放的影响
2020-04-09巩有奎任丽芳罗佩云彭永臻
巩有奎,任丽芳,罗佩云,彭永臻
NaCl浓度对SBBR同步脱氮及N2O释放的影响
巩有奎1,2,任丽芳1,罗佩云1,彭永臻2
(1. 烟台职业学院建筑工程系,烟台 264670; 2. 北京工业大学城镇污水深度处理与资源化利用技术国家工程实验室,北京 100124)
盐度是影响生物脱氮过程的重要因素。盐度增加会导致生物硝化和反硝化过程中N2O的产生并释放。该文以添加NaCl的生活污水为研究对象,采用固定填料序批式生物膜反应器(sequencing batch biofilm reactor,SBBR),考察了不同NaCl浓度(0、5、10、15和20 g/L)对SBBR脱氮性能及N2O释放的影响。结果表明,试验NaCl浓度范围内,SBBR出水COD稳定在40~60 mg/L。硝化过程NO2-/NO3-随NaCl浓度增加而增加。NaCl浓度≤10 g/L时,NH4+-N去除率大于95%,N2O产率由4.08%(NaCl浓度为0)增至6.72%(NaCl浓度为10 g/L)。NaCl浓度为20 g/L时,驯化后SBBR内平均NH4+-N去除率为70%,平均N2O产率为13.60%。无添加NaCl时,N2O主要产生于硝化阶段的AOB好氧反硝化过程,SBBR内缺氧区有助于减少N2O释放;高NaCl浓度条件下,N2O主要产生于AOB好氧反硝化过程和内源同步反硝化过程,高盐度加剧内源反硝化阶段NO2-和N2O之间电子竞争,抑制N2O还原,其活性抑制性能与电子受体和初始C/N有关。与硝态氮还原速率和亚硝态氮还原速率相比,氧化亚氮还原速率受NaCl抑制最为明显,是导致高盐度条件下N2O释放量增加的重要因素。
污水;氮;盐分;氧化亚氮;好氧反硝化;内源反硝化
0 引 言
采用分散处理的方式,对分散性、处理量小且变化系数大的农村生活污水进行营养素的去除,是解决中国农村生活污水环境污染的重要途径[1-2]。农村生活污水中含有大量有机质、氮磷营养物质、悬浮物及病菌等成分,经生物处理后,其COD浓度能够满足排放要求,而氮的去除则相对复杂,涉及多个生物降解过程,且不同过程对环境要求不尽相同[3]。此外,乡、镇生产企业的快速发展也可能导致部分无机盐废水混入污水处理厂,从而对生物处理过程产生抑制[4-5]。
目前,应用较为广泛的脱氮方法主要包括缺氧/好氧、氧化沟、序批式生物反应器等,其工艺较为成熟,但也存在固有缺陷[1]。与传统处理工艺相比,序批式生物膜反应器(sequencing batch biofilm reactor,SBBR)内部同时存在好氧和缺氧区,其表面生长的异养菌可为其内部硝化菌提供屏障,削弱盐度冲击负荷对硝化菌的抑制作用,在含盐污水处理过程中具有明显优势[6],可用于低碳氮比含盐农村生活污水脱氮处理过程。
氧化亚氮(N2O)被认为是21世纪臭氧层最严重的威胁之一。其全球增温效应约为CO2的200~300倍[7]。人为活动导致N2O排放约占全球N2O总排放量的40%[8],其中,污水生物脱氮过程是重要的N2O人为排放源之一。Kampschreur等总结后得出:城镇污水处理厂脱氮处理过程中,约有0~14.6%的氮转化为N2O释放[9]。2005-2020年,全世界污水厂排放的N2O将增加13%[10]。生物脱氮过程是包含硝化/反硝化在内的生化反应。硝化过程中,氨氧化菌(ammonia-oxidizing bacteria,AOB)的好氧反硝化过程和NH4+/NH2OH氧化过程均会产生N2O;反硝化过程中,环境条件变化(C/N、DO、pH值、生物膜厚度),也会导致其中间产物N2O的积累[11-13]。SBBR内,由膜外到膜内,可分为好氧区、低氧/缺氧过渡区和缺氧区3部分,同步脱氮过程中,好氧和低氧区产生的N2O扩散至内部缺氧区,完成其还原过程,可降低脱氮过程N2O释放量[13]。
目前,大量研究集中在考察NaCl浓度对活性污泥系统脱氮过程的影响,而对不同NaCl添加SBBR系统脱氮及N2O释放特性研究尚不多见。本文利用SBBR反应器,以添加NaCl生活污水为研究对象,考察不同初始NaCl添加浓度(0、5、10、15和20 g/L)下,SBBR系统生物脱氮过程及N2O释放特性,分析含盐生活污水处理过程中不同微生物活性变化特点,以期为SBBR系统处理含盐污水并降低N2O释放提供参考。
1 材料与方法
1.1 试验装置及运行
试验用SBBR工作容积12.0 L,以瑞琪生物填料(RCP-5325S,北京神州瑞琪)作为碳纤维膜的支撑,碳纤维膜平均比表面积1 150 m2/g,悬挂碳纤维膜后,SBBR反应器内填料填充率为35%。反应器底部均匀分布3个曝气头,以温控磁力搅拌器进行搅拌。试验装置以密闭方式运行,反应器顶部设有带水封的U型管平衡系统内外压力,以气体流量计控制曝气量为30 L/h(图1)[14]。反应器每天运行2个周期,体积充水比为2:3。SBBR反应器采用进水(10 min)-缺氧(N2曝气50 min)-好氧(空气曝气380 min)-排水(10 min)-闲置(270 min)共计5个进程,以PLC装置在线控制SBBR运行。试验共分为5个阶段,以反应器连续稳定运行2 d(即4个周期)作为改变反应器内初始NaCl浓度的依据。整个试验过程中,通过调节进水时反应器内粗盐添加量,控制各阶段反应初始SBBR内NaCl浓度分别为0、5、10、15和20 g/L。

图1 序批式生物膜反应器示意图
1.2 试验接种污泥及水质
试验用接种污泥取自实验室内具有良好脱氮性能的活性污泥。挂膜结束后,SBBR系统NH4+-N去除率大于95%,硝化阶段亚硝态氮积累率(nitrite accumulation rate,NAR)NO2--N/NOx--N小于20%。试验原水取自北方某社区化粪池出水,属于典型低C/N实际生活污水,其COD浓度为165~225 mg/L,NH4+-N浓度为45.1~67.5 mg/L,NOx--N浓度小于1 mg/L,pH值为7.25~8.15。各反应阶段分别添加不同质量粗盐NaCl,调节进水使NaCl浓度至各设定值。
1.3 微生物活性测定试验
不同运行阶段末期,于SBBR内部随机取3处不同位置部分碳纤维填料(占总填料的2%~5%),经无菌水冲洗后,置于0.5 L生理盐水内,利用振筛震荡30 min,脱落污泥分别置于3个有效容积为0.75 L的锥形瓶内,挥发性悬浮固体(MLVSS)浓度控制为1 200± 200 mg/L,分别测定污泥氨氮氧化速率(ammoniam oxidation rate,AOR)、亚硝态氮氧化速率(nitrite oxidation rate,NIOR)、硝态氮还原速率(nitrate denitrification rate,DNAR)亚硝态氮还原速率(nitrite denitrification rate,DNIR)和氧化亚氮还原速率(nitrous oxide denitrification rate,DN2OR),试验方案如表1所示。

表1 微生物活性测试试验方案
注:AOR为氨氮氧化速率,mg∙L-1;NIOR为亚硝态氮氧化速率,mg∙L-1;DNAR为硝态氮还原速率,mg∙L-1;DNIR为亚硝态氮还原速率,mg∙L-1;DN2OR为氧化亚氮还原速率,mg∙L-1;E-DNAR为硝态氮内源反硝化速率,mg∙L-1;E-DNIR为亚硝态氮内源反硝化速率,mg∙L-1;E-DN2OR为氧化亚氮内源反硝化速率,mg∙L-1。NH4Cl、NaNO2、NaNO3、N2O浓度以氮计,CH3COONa浓度以化学需氧量(COD)计。
Note: AOR is ammoniam oxidation rate, mg∙L-1; NIOR is nirite oxidation rate, mg∙L-1; DNAR is nitrate denitrification rate, mg∙L-1; DNIR is nitrite denitrification rate, mg∙L-1; DN2OR is nitrous oxide denitrification rate, mg∙L-1; E-DNAR is NO3--N endogenous denitrification rate, mg∙L-1; E-DN2OR is N2O-N endogenous denitrification rate, mg∙L-1. NH4Cl, NaNO2, NaNO3and N2O concentrations are calculated as nitrogen, CH3COONaconcentration is calculated as COD.
以活性系数(active coefficient,AC)表示不同NaCl浓度下微生物活性变化情况。AC=/0×100%,其中为不同NaCl浓度下含氮污染物氧化(还原)速率,mg/(g∙h),0为NaCl浓度为0时反应速率,mg/(g∙h)。
1.4 测试及分析方法
1)水质测试方法:以德国WTW公司Multi340i型便携式DO和pH值测定仪测定反应器中DO和pH值。COD、NO3--N、NO2--N和MLVSS均采用标准方法分析[15]。
2)N2O测试方法:所有试验阶段内,隔天对SBBR系统取样测试。取样期间,气体均经干燥器后进入顶部设置的气体采样袋,每间隔0.5 h更换一次采样袋,直至反应结束。整个过程中,利用湿式流量计测定每个采样袋内收集气体体积,采用Agilent 公司6890N型气相色谱仪测定气相N2O,其中,所用色谱柱为HP-Plot分子筛柱(长度×外径=30 m×0.53 mm,膜厚25m)。色谱测定条件:进样口温度110 ℃;炉温180 ℃;ECD检测器300 ℃。SBBR系统运行过程中,顶部空气法确定溶解态N2O浓度[11]。微生物活性测试批次试验中,N2O还原过程以UNISENSE Picoammeter PA2000测试,检测下限为0.01mol/L[16]。
3)内源物测试方法:聚--羟基丁酸(poly-- hydroxybutyrate,PHB)和聚--羟基戊酸(poly-- hydroxyvalerate,PHV)采用内标法进行气相色谱分析[17],两者之和为聚--羟基脂肪酸脂(poly--hydroxyalkanoates,PHA);糖原(glycogen,Gly)以蒽酮法测定[18]。
2 结果与分析
2.1 NaCl浓度变化对SBBR系统长期影响
SBBR挂膜完成后,进水中添加NaCl模拟含盐生活污水处理过程,各阶段反应初始SBBR内NaCl浓度分别为0、5、10、15和20 g/L。盐度增加对SBBR内COD去除率无明显影响,整个试验阶段,反应器出水COD为40~60 mg/L。图2所示为系统运行期间无机氮去除、内碳源(PHA和Gly)变化及N2O释放特性。SBBR生物膜表面附着生物量远大于活性污泥絮体,缓解了NaCl浓度增加对亚硝化过程的抑制。初始NaCl浓度增加导致AOB活性下降,经NaCl梯度驯化,AOB可通过调节自身渗透压来适应环境条件变化[19]。NaCl浓度在10 g/L以下,稳定运行阶段NH4+去除率可达95%以上。在NaCl浓度为15和20 g/L冲击负荷下,AOB活性受到较强抑制,NH4+去除率分别降至63.1%±5.6%和50.7%±4.9%。高盐度可能会破坏部分AOB的生物膜和菌体的活性酶,影响微生物的正常生理功能[20-21]。经初始NaCl浓度为20 g/L高盐度污水驯化30 d(80~110 d),生物膜内耐盐微生物增殖并成为AOB内优势菌种,其NH4+去除率逐渐增至77.6%±3.6%和70.6%±2.9%。经NaCl浓度为20 g/L生活污水驯化30 d后,SBBR内可获得较高NH4+去除率,其主要原因可能是本研究以实际生活污水作为进水,与人工单一配水水质相比较,其驯化的微生物种类更多,其适应环境变化的能力更强。
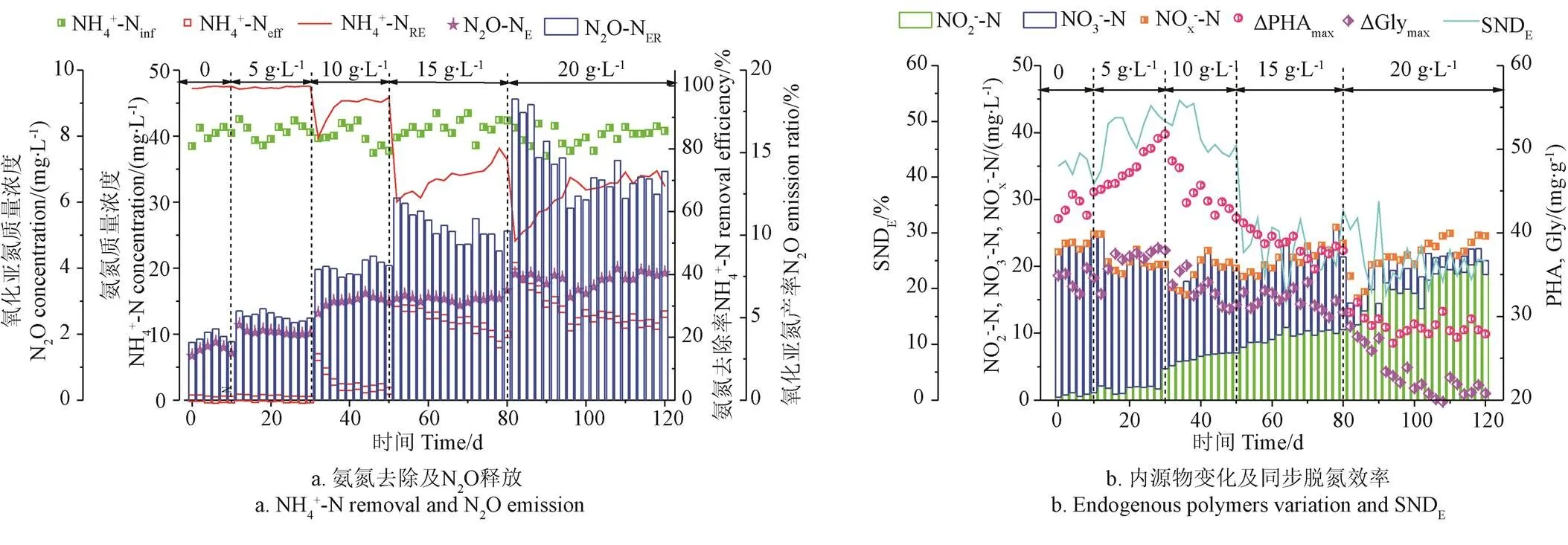
注:NH4+-Ninf:进水氨氮,mg∙L-1; NH4+-Neff:出水氨氮,mg∙L-1;NH4+-NRE:氨氮去除率,%;N2O-NE:N2O-N释放量,mg∙L-1;N2O-NER:氧化亚氮产率,%; NO2--N:亚硝态氮浓度,mg∙L-1; NO3--N:硝态氮浓度,mg∙L-1;NOx--N:氮氧化物浓度,mg∙L-1;ΔPHAmax:聚-β-脂肪酸酯增量,mg∙g-1;ΔGlymax:糖原增量,mg∙g-1;SNDE:同步硝化反硝化脱氮效率,%。
生物脱氮过程中,低氧条件下AOB的好氧反硝化和异养菌的反硝化过程均会导致N2O的产生和释放。NaCl浓度增加引起生物膜内部NO2-含量增加,以N2O为终产物的AOB好氧反硝化过程增强。NaCl浓度增至10 g/L,平均N2O释放量(以氮计)由1.56 mg/L增至2.87 mg/L,产率由4.08 %增至6.72 %。NaCl浓度增至20 g/L冲击负荷下,N2O产率(N2O释放量/总氮去除量,以氮计,下同)迅速增至18.25%,经30 d驯化后,平均N2O产率为13.60%。随NaCl浓度由0增至20.0 g/L,SBBR内平均NO2-积累(以氮计,下同)由1.12增至18.87 mg/L,NO3-(以氮计,下同)由22.36降至2.08 mg/L,NO2-/NO3-随盐度增加而增加(图2b)。这可能是导致试验第80~120 d反应器内N2O产率增加的主要因素[22]。一方面,高浓度的NO2-的可能会促进亚硝酸盐还原酶基因()和一氧化氮还原酶基因()mRNA的显著表达,刺激AOB好氧反硝化过程的发生,导致N2O产量增加[23];另一方面,与其他还原酶相比较,氧化亚氮还原酶(nitrous oxide redcutase,Nos)受环境因素(DO、pH值、碳源、有毒物质)影响较大[24-25],NaCl的盐度刺激会导致反硝化途径产生大量N2O[26],同时,高浓度NO2-/HNO2抑制Nos的活性,N2O释放量增加[24]。
初期“饱食”条件下,原水中COD 吸附于生物膜表面并以PHA和Gly的形式储存在微生物体内。低NaCl浓度条件下,微生物利用细胞内合成内碳源含量增加来抵抗NaCl浓度的增加,从而促进其体内PHA合成[27],NaCl浓度为5 g/L,微生物体内合成Gly增量(ΔGly)由34.5 mg/g(以每克挥发性悬浮固体化学需氧量计,下同)增至36.9 mg/g,PHA增量(ΔPHA)由43.6 mg/g增至46.9 mg/g。受低浓度NaCl冲击后,菌群合成更多PHA以抵御逆境[28]。该部分积累的PHA和Gly可作为后续同步反硝化过程的内碳源,ΔPHA和ΔGly越大,曝气阶段所消耗的无效COD越少,同步脱氮效率越高(图2b)。高NaCl浓度则会破坏微生物细胞膜和菌体的活性酶,抑制微生物正常生理功能至其活性完全被抑制,降低微生物储存碳源能力,ΔPHA和ΔGly迅速降低[29],初始NaCl浓度为20 g/L,其ΔPHA和ΔGly则分别降至28.2和22.7 mg/g(图2b)。
与ΔPHA和ΔGly变化类似,SBBR内同步硝化反硝化(simultaeous nitrification and denitrification,SND)脱氮效率随NaCl增加亦呈先增加后减少的趋势。NaCl浓度为10 g/L,其SND效率达最大值53.8%。一方面,SBBR内部沿生物膜方向形成了好氧-低氧-缺氧环境,硝化阶段产生的NOx-以扩散形式进入生物膜内部缺氧区域,以外源COD或内碳源为电子供体,完成反硝化过程;另一方面,相较于AOB,亚硝态氮氧化菌(nirite oxidizing bacteria,NOB)对NaCl浓度变化更敏感,NaCl浓度增加,部分硝化过程止步于NO2-,其反硝化过程可节约40%碳源,碳源有限时,SND效率增加。除此之外,与硝化细菌相比,异养反硝化菌对NaCl浓度的耐受能力较强,也导致低NaCl浓度下SBBR系统硝化性能下降而反硝化性能增加[30]。
2.2 不同盐度下SBBR典型周期运行特性
2.2.1 无NaCl添加时SBBR运行特性
图3为无NaCl添加时,SBBR稳定运行阶段典型周期内含氮污染物、内碳源(PHA和Gly)变化及N2O释放特性。初始缺氧阶段,原水中部分COD作为电子供体,还原上一周期残留NOx-,部分经异养微生物吸收后以PHA形式储存在体内。好氧开始30 min内,少量NH4+用于异养微生物的增殖,内碳源(PHA、Gly)继续增加。此后,有机物含量降低,异养菌竞争DO能力减弱,膜内AOB获得DO能力增强,系统进行NH4+氧化过程。硝化初始阶段,存在外源COD,其提供电子速率较高,SBBR生物膜内可发生同步反硝化过程,无NOx-积累。同时,微生物体内PHA和Gly逐渐增加,为硝化过程后期同步发生的反硝化过程提供内碳源。180 min后,PHA达171.2 mg/g,此后(180~360 min),PHA逐渐降至115.4 mg/g。生物膜内异养反硝化菌以PHA作为电子供体,TN仍呈降低趋势,但是其提供电子速率下降,SBBR内NOx-积累增加。原水C/N较低,碳源不足导致微生物体内储存内碳源有限,无法提供充足的电子以完成反硝化过程;另一方面,有机物降低导致液相DO浓度增加,其扩散进入生物膜能力增强,降低了SBBR内部缺氧区范围,削弱了反硝化过程。至反应结束时,其出水NOx-达19.3 mg/L,同步脱氮效率为43.2%。
以外源COD为电子供体,初始缺氧阶段无N2O释放。这与Yang等的研究结果一致[11]。好氧伊始,系统内存在部分外源有机物,硝化阶段产生的N2O以扩散形式进入SBBR内缺氧区域,外源COD为N2O还原提供电子供体,无N2O释放。180 min后,外碳源消耗殆尽,同步发生的反硝化过程以PHA作为电子供体,TN曲线下降放缓(图3),其N2O-N释放量由0.24 mg/L迅速增至1.56 mg/L,占脱氮过程N2O总释放量的84.6%。主要原因有:1)DO浓度增加,其扩散进入生物膜内能力增强,AOR增加,NH4+/NH2OH氧化过程释放电子能力增强,同时存在的高浓度NH4+和NO2-促进了好氧反硝化过程的发生,N2O产量增加[12];2)反硝化过程中,以PHA作为电子供体,提供电子能力较弱,与硝态氮还原酶(nitrate reductase,Nar)和亚硝态氮还原酶(nitrite oxide reductase,Nir)相比,Nos争夺电子能力较弱,当多种电子受体共存时,反硝化过程止步于N2O[31];3)DO对Nos活性具有明显抑制作用,低氧条件下异养菌反硝化过程中N2O的释放[32]。

注:TN:总氮,mg∙L-1;COD:化学需氧量,mg∙L-1;N2O-Nd:溶解态氧化亚氮,mg∙L-1。
2.2.2 NaCl浓度为20.0 g/L时SBBR运行特性
高NaCl浓度下(20 g/L),SBBR典型周期运行性能如图4所示。高NaCl耦合高NO2-,初始缺氧反硝化过程即出现溶解态N2O积累。高NaCl条件下,NO3-和NO2-还原过程中均会出现N2O的积累,且以NO2-为电子受体,其N2O释放量激增[33]。反硝化过程中,Nos的合成速度小于Nar和Nir,高NaCl浓度抑制Nos的合成,都会导致N2O积累。随反硝化过程进行,NO2-降低,Nos活性恢复,溶解态N2O降至0.05 mg/L。

图4 高NaCl浓度(20.0 g·L-1)下SBBR典型周期指标变化
好氧阶段,NaCl浓度增加导致COD和NH4+降解速率降低。长时间处于高NaCl环境下,异养菌活性均降低,微生物“饱食”时间由150 min增至270 min。NaCl浓度对硝化过程影响更明显,至反应结束时,其NH4+去除率仅为70%。NaCl为20 g/L,微生物体内ΔPHA和ΔGly分别降至28.2和22.7 mg/g。低浓度NaCl(5~9 g/L)可以促进细菌PHA合成能力,而NaCl增加,其PHA合成能力则会受到抑制[34]。高盐度环境下导致微生物细胞质壁分离,抑制菌群活性,从而引起ΔPHA下降[35]。
好氧初始阶段,系统内进行有机物降解和氨氮氧化过程。同步发生的反硝化过程以外碳源作为电子供体,高NaCl抑制了Nos的活性,AOB好氧反硝化过程和异养菌缺氧反硝化过程产生的N2O无法被充分还原,与NaCl=0相比较,其N2O释放量略有增加。180 min后,同步反硝化过程电子供体减少,而高NaCl浓度加剧了反硝化性能受抑制程度,至反应结束时,SBBR内NO2--N达18.45 mg/L,N2O-N释放量增至3.65 mg/L,产率达14.46%。内源反硝化过程中,PHA和Gly氧化速率有限,当反硝化过程存在多种电子受体(NOx-、NO和N2O)时,微生物无法通过提高内碳源氧化速率为所有受体提供电子,这就导致在Nar,Nir,Nor和Nos之间存在电子竞争。其中,Nir和Nos均从细胞色素氧化体系c550的电子传递过程中获得电子,以完成其还原过程。作为反硝化反应的最末端,Nos获得电子能力最弱,且高NaCl浓度对Nos活性具有明显抑制作用,N2O还原在整个反硝化过程中处于劣势,从而导致N2O的积累并释放[36],这是高盐度下N2O释放增加的重要原因。
2.3 不同盐度下典型周期的SBBR系统内氧化亚氮变化特性
图5为不同初始NaCl浓度下SBBR脱氮过程的N2O变化曲线。反硝化阶段,以原水中COD作为电子供体,无盐度投加时,仅在反硝化初期出现溶解态N2O积累,此后迅速降至接近0。N2O积累原因可能是反硝化过程中Nos的合成速率远小于Nar和Nir。盐度增加,反硝化阶段溶解态N2O积累逐渐增强,达0.29 mg/L。高NaCl以Na+取代Nos内Cu2+,从而实现其对Nos活性抑制[33],导致反硝化过程N2O的积累(图5a)。提供充足外碳源,反硝化结束时,其溶解态N2O均降至0.10 mg/L以下。
SBBR填料表面生物膜内存在好氧区、低氧/缺氧过渡区和缺氧区。大部分AOB位于膜内低氧区域,其好氧反硝化过程产生的N2O 可扩散至内部缺氧区还域,完成原过程[6],有助于N2O减量。低NaCl浓度(0~10 g/L),硝化过程结束,溶解态N2O即降至0,N2O释放量趋于稳定(图5),表明AOB好氧反硝化过程是导致N2O释放的主要因素。SBBR内部存在的缺氧微环境的存在降低了N2O产率,硝化过程初期未发现N2O大量释放。仅在硝化过程后期,DO浓度增加,缺氧区域降低,N2O还原过程受抑制,N2O释放速率增加(图5b)。

图5 不同NaCl浓度下SBBR脱氮过程的N2O变化
高NaCl浓度条件下(15~20 g/L),好氧曝气伊始N2O释放量即迅速增加,溶解态N2O亦呈逐渐增加趋势。表明硝化初始阶段产生的N2O并不能通过生物膜内的同步反硝化过程还原。盐度增加,适应高NaCl浓度的菌群种类减少,硝化过程止步于NO2-,反应结束时,系统内仍残留有10 mg/L以上NH4+-N。高浓度NO2-和NH4+共存,促进了低氧区好氧反硝化过程发生;另一方面,SBBR内部以PHA和Gly作为电子供体,反硝化过程受阻,高盐度和高NO2-导致生物膜内部反硝化过程止步于N2O;除此之外,高NaCl浓度下,微生物代谢受阻,其生长速率下降,产率系数降低,其表面Zeta电位随盐度增加而趋于更负[37],污泥絮凝性降低,且水体密度增加,加剧了污泥流失[38],碳纤维膜表面附着的微生物聚集性降低,DO进入生物膜内部的能力增强,底部缺氧区减少,低氧条件下发生的反硝化过程则会止步于N2O。因此,高盐度条件所导致的NO2-积累、内碳源合成量减少以及DO扩散进入生物膜内部能力增强,是导致N2O大量释放的主要原因。
2.4 不同NaCl浓度下SBBR微生物硝化及反硝化活性
表2为不同盐度条件下SBBR生物膜内微生物活性变化情况。无NaCl添加,AOR约是NIOR的1.5倍。SBBR反应器内,生物膜表面附着异养菌,其内部为硝化菌群。低NaCl浓度刺激(5 g/L),AOR和NIOR均略有增加。高NaCl浓度条件(20 g/L),AOR和NIOR活性系数别降至56.56%±4.65%和23.55%±1.98%,降幅远小于活性污泥系统内盐度冲击负荷下AOB和NOB的减少幅度[2],其主要原因是:SBBR内生物膜表面异养菌形成保护层,降低了盐度对其内部硝化菌的抑制;另一方面,与活性污泥系统相比,填料表面的截留作用有利于黏附大量微生物,可驯化出增值速率较低的硝化菌,AOB和NOB内驯化出了部分耐盐菌种,其活性有所增加,这也是SBBR抗盐性能增强的重要因素之一。
以CH3COONa为电子供体,无NaCl投加,DN2OR远大于DNAR和DNIR,即:保持良好缺氧条件并提供充足外碳源,反硝化过程无N2O积累。其中,DN2OR受NaCl影响最为明显,NaCl浓度增加可导致反硝化过程中N2O的积累(图5);内源反硝化过程,仅存在N2O时,E-DN2OR远大于E-DNAR和E-DNIR,表明无盐条件下,内源反硝化过程N2OR积累的主要原因可能是多种电子共存时,不同电子受体之间存在电子竞争,而Nos竞争电子能力较弱,从而导致N2O的积累;盐度增加,E-DN2OR活性系数降至5.32±0.12%,远小于E-DNAR(13.79±1.12%)和E-DNIR(31.94±2.32%),盐度对Nos的抑制更大。因此,SBBR系统内,高NaCl浓度条件下,内源反硝化阶段中,N2O大量积累并释放。

表2 NaCl 浓度对微生物活性及活性系数影响
为保证试验更接近农村污水处理过程,本研究以添加不同NaCl浓度的北方某社区实际生活污水作为研究对象,确定了NaCl浓度梯度变化对SBBR脱氮性能和N2O释放影响。与人工配水相比较,实际生活污水成分复杂,系统内培养驯化微生物种类多,更有利于嗜盐微生物的增殖驯化,且实际农村污水处理过程中,无机盐成分变化复杂,因此,本研究中并未考虑粗盐中杂质对脱氮系统的影响。同时,以缺氧/好氧运行的SBBR反应器,缺氧阶段充分利用原水中碳源进行反硝化过程,且占地面积小,运行费用低,管理方便,适用于分散且处理量小的农村生活污水。SBBR生物膜表面异养菌形成了屏障,降低了高NaCl浓度对其内部硝化菌的毒性,经驯化后,SBBR脱氮脱氮性能明显增加。
3 结 论
本研究利用SBBR反应器处理含盐生活污水,系统分析了反应器初始NaCl浓度对脱氮性能、内源物积累和N2O释放的影响。研究结果如下:
1)NaCl浓度增加,反应器脱氮性能降低,N2O产率增加。NaCl浓度≤10 g/L,NH4+去除率达95%以上;NaCl浓度为20 g/L, NH4+去除率降至70.6%左右。NaCl浓度由0增大至20 g/L,PHA合成增量由43.6 mg/g 降至28.2 mg/g,Gly合成增量由34.5 mg/g降至22.7 mg/g,SBBR内NO2-积累由1.12 mg/L增至18.87 mg/L,平均N2O产率由4.08 %增至13.60%。
2)不同NaCl浓度下,N2O产生过程不同。低NaCl浓度下,N2O主要产生于AOB好氧反硝化过程;高NaCl浓度下,硝化过程止步于NO2-,高浓度NH4+和NO2-促进了AOB好氧反硝化过程发生,N2O释放量增加;SBBR内源反硝化过程中,Nir和Nos之间电子竞争导致高盐度下N2O还原减弱;同时,高盐度导致生物聚集性降低,DO扩散能力增强,降低生物膜内部缺氧区域范围,抑制了N2O还原过程。
3)SBBR内各含氮物质转化速率总体趋势是随NaCl浓度增加而降低。各NaCl浓度下,N2O还原速率的活性系数均小于NO3-和NO2-还原速率活性系数,Nos活性受NaCl浓度抑制更强,高NaCl更易导致N2O释放量增加。
[1] 段增强,段婧婧,耿晨光,等. 园林地慢速渗滤系统处理农村分散式生活污水[J]. 农业工程学报,2013,28(23):192-199.
Duan Zengqiang, Duan Jingjing, Geng Chenguang, et al. Garden slow percolation system for processing rural distributed wastewater[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2013, 28(23): 192-199. (in Chinese with English abstract)
[2] Dubber D, Gray N F. The effect of anoxia and anaerobia on ciliate community in biological nutrient removal systems using laboratory-scale sequencing batch reactors (SBRs)[J]. Water Research, 2011, 45(6): 2213-2226.
[3] 潘碌亭,谢欣迁,王九成,等. 脱氮除磷生物滤池填料制备及其对农村生活污水的处理效果[J]. 农业工程学报,2017,33(9):230-236.
Pan Luting, Xie Xinqian, Wang Jiucheng, et al. Preparation of denitrification and dephosphorization biological fillers and its effect on treatment of rural domestic sewage[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2017, 33(9): 230-236. (in Chinese with English abstract)
[4] Tsuneda S, Mikami M, Kimochi Y. et al. Effect of salinity on nitrous oxide emission in the biological nitrogen removal process for industrial wastewater[J]. Journal of Hazardous Materials, 2005, 119(1/2/3): 93-98
[5] 王淑莹,唐冰,叶柳,等. NaCl盐度对活性污泥系统脱氮性能的影响[J]. 北京工业大学学报,2008,34(6):631-635.
Wang Shuying, Tang Bing, Ye Liu, et al. Influence of NaCl salinity on nitrogen removal of activated sludge system[J]. Journal of Beijing University of Technology, 2008, 34(6): 631-635. (in Chinese with English abstract)
[6] Sabba F, Terada A, Wells G, et al. Nitrous oxide emissions from biofilm processes for wastewater treatment[J]. Applied Microbiology and Biotechnology, 2018, 102(22): 9815-9829.
[7] Ravishankara A R, Daniel J S, Portmann R W. Nitrous oxide: The dominant ozone-depleting substance emitted in the 21st century[J]. Science, 2009, 326(5949): 123-125.
[8] Denman K L, Brasseur G, Chidthaisong A, et al. In Climate Change 2007: The Physical Science Basis[M]. Cambridge: Cambridge University Press, 2013: 501-588.
[9] Kampschreur M J, Temmink H, Kleerebezem R, et al. Nitrous oxide emission during wastewater treatment[J]. Water Research, 2009, 43(17): 4093-4103.
[10] Law Y, Ye L, Pan Y, et al.Nitrous oxide emissions from wastewater treatment processes[J]. Philosophical Transactions of the Royal Society B: Biological Sciences, 2012, 367(1593): 1265-1277.
[11] Yang Q, Liu X H, Peng C Y, et al. N2O production during nitrogen removal via nitrite from domestic wastewater: Main sources and control method[J]. Environmental Science & Technology, 2009, 43(24): 9400-9406.
[12] Chen X,Yuan Z G,Ni B J. Nitrite accumulation inside sludge flocs significantly influencing nitrous oxide production by ammonium-oxidizing bacteria[J]. Water Research, 2018, 143(15): 99-108.
[13] Zhao J, Feng L, Yang G, et alDevelopment of simultaneous nitrification-denitrification (SND) in biofilm reactors with partially coupled a novel biodegradable carrier for nitrogen-rich water purification[J]. Bioresource Technology, 2017, 243: 800-809.
[14] 巩有奎,任丽芳,彭永臻. 不同 DO下SBBR亚硝酸型同步脱氮及N2O释放特性[J]. 化工学报,2019,70(4):1550-1558.
Gong Youkui, Ren Lifang Peng Yongzhen. Characterics of simultaneous nitrification and denitrification via nitrite and N2O emissionin in SBBR under different DO concentrations[J]. CIESC Journal, 2019, 70(4): 1550-1558. (in Chinese with English abstract)
[15] APHA(American Public Health Association). Standard Methods for the Examination of Water and Wastewater[M]. Baltimore: Port City Press, 1998.
[16] 巩有奎,王淑莹,王莎莎,等. 碳氮比对短程反硝化过程中N2O产生的影响[J]. 化工学报,2011,62(7):2049-2054.
Gong Youkui, Wang Shuying, Wang Shasha, et al. Effect of C/N ratio on N2O accumulation and reduction during nitrite denitrification process[J]. CIESC Journal, 2011, 62(7): 2049-2054. (in Chinese with English abstract)
[17] Oehmen A, Keller-Lehmann B, Zeng R J, et al. Optimisation of poly-beta-hydroxyalkanoate analysis using gas chromato- graphy for enhanced biological phosphorus removal systems[J]. Journal of Chromatography A, 2005, 1070(1/2): 131-136.
[18] Zeng R J, Van Loosdrecht M C M, Yuan Z G, et al. Metabolic model for glycogen-accumulating organisms in anaerobic /aerobic activated sludge systems[J].Biotechnology and Bioengineering, 2003, 81(1): 92-105.
[19] Zhao L, She Z, Jin C, et al. Characteristics of extracellular polymeric substances from sludge and biofilm in a simultaneous nitrification and denitrification system under high salinity stress[J]. Bioprocess and Biosystems Engineering, 2016, 39(9): 1375-1389.
[20] Chen M X, Wang W C, Feng Y, et al. Impact resistance of different factors on ammonia removal by heterotrophic nitrification-aerobic denitrification bacterium Aeromonas sp. HN-02[J]. Bioresource Technology, 2014, 167: 456-461.
[21] Chen G H, Wong M T, Okabe S, et al. Dynamic response of nitrifying activated sludge batch culture to increased chloride concentration[J]. Water Research, 2003, 37(13): 3125-3135.
[22] Castro-Barros C M, Rodrguez-Caballer O A, Volcke E, et al. Effect of nitrite on the N2O and NO production on the nitrification of low-strength ammonium wastewater[J]Chemical Engineering Journal, 2016, 287: 269-276.
[23] Yu R, Chandran K. Strategies of19718 to counter low dissolved oxygen and high nitrite concentrations [J]. BMC Microbiology, 2010, 10: 70-80.
[24] Zhou Y, Pijuan M, Zeng R J, et al. Free nitrous acid inhibition on nitrous oxide reduction by a denitrifying- enhanced biological phosphorus removal sludge[J]. Environmental Science & Technology, 2008, 42(22): 8260-8265.
[25] Lu H J, Chandran K, Stensel D. Microbial ecology of denitrification in biological wastewater treatment[J]Water Research, 2014, 64: 237-254.
[26] Zhao W, Wang Y, Lin X, et al. Identification of the salinity effect on N2O production pathway during nitrification: using stepwise inhibition and15N isotope labeling methods[J]Chemical Engineering Journal, 2014, 253: 418-426.
[27] He H, Yang C, Zeng G, et al. Influence of salinity on microorganisms in activated sludge processes: A review[J]. International Biodeterioration & Biodegradation, 2017, 119: 520-527.
[28] Obruca S, Sedlacek P, Koller M, et al. Involvement of polyhydroxyalkanoates in stress resistance of microbial cells: Biotechnological consequences and applications[J]. Biotechnology Advances, 2018, 36(3): 856-870.
[29] Palmeiro S T, Frav A, Rey M N, et al. Transient concentrations of NaCl affect the PHA accumulation in mixed microbial culture[J]. Journal of Hazardous Materials, 2016, 306: 332-339.
[30] 邹高龙,李小明,李启武,等. 盐度变化对 SBBR 和SBR 中含氨氮废水的处理影响[J]. 环境科学,2009,30(9):2603-2608.
Zou Gaolong, Li Xiaoming, Li Qiwu, et al. Effects of salinity variation on the treatment wastewater containing ammonia in the SBBR and SBR[J]. Environmental Science, 2009, 30(9): 2603-2608. (in Chinese with English abstract)
[31] Pan Y T, Ni B J, Lu H J, et al. Evaluating two concepts for the modelling of intermediates accumulation during biological denitrification in wastewater treatment[J]. Water Research, 2015, 71: 21-31.
[32] Gong Y K, Peng Y Z, Yang Q, et al. Formation of nitrous oxide in a gradient of oxygenation and nitrogen loading rate during denitrification of nitrite and nitrate[J]. Journal of Hazardous Materials, 2012, 227/228: 453-460.
[33] Zhao W,Wang Y,Liu S, et al. Denitrification activities and N2O production under salt stress with varying COD/N ratios and terminal electron acceptors[J]. Chemical Engineering Journal, 2013, 215-216(15): 252-260.
[34] Passanha P, Kedia G, Dinsdaler M, et al. The use of NaCl addition for the improvement of polyhydroxy-alkanoate production by[J]. Bioresource Technology, 2014, 163: 287-294.
[35] Ng H, Yong S L, Ng W J. Effects of sodium chloride on the performance of a sequencing batch reactor[J]. Journal of Environmental Engineering, 2005, 131(11): 1557-1564.
[36] Pan Y T, Ni B J, Yuan Z G. Modeling electron competition among nitrogen oxides reduction and N2O accumulation in denitrification[J]. Environmental Science & Technology, 2013, 47(19): 11083-11091.
[37] 季业,温沁雪,郝亚茹,等. 盐度对模拟餐厨垃圾发酵液产聚羟基脂肪酸酯工艺的影响[J/OL]. 环境工程学报. 2019-06-03 [2019-08-207]. http://kns.cnki.net/kcms/detail/ 11.5591.X.20190601.1228.016. html
Ji Ye, Wen Qinxue, Hao Yaru, et al. Influence of salinity on polyhydroxyalkanoate production using simulated food waste fermentation liquid[J/OL]. Chinese Journal of Environmental Engineering, 2019-06-03 [2019-08-207]. http://kns.cnki.net/ kcms/detail/11.5591.X.20190601. 1228.016.html.(in Chinese with English abstract)
[38] Reid E, Liu X, Judd S. Effect of high salinity on activated sludge characteristics and membrane permeability in an immersed membrane bioreactor[J]. Journal of Membrane Science, 2006, 283: 164-171.
Effects of NaCl concentration on simultaneous nitrification and denitrification process and N2O emission in SBBR
Gong Youkui1,2, Ren Lifang1, Luo Peiyun1, Peng Yongzhen2
(1., 264670,; 2.,100124,)
The sequencing batch biofilm reactor (SBBR) is widely applied in the wastewater treatment due to its strong adaptability to the unstable influent substrate concentrations. The growth environment for microorganisms is different in the outer and inner space of the biofilm, which leads to different microbial community structure in different zones of the system. Salinity is one of the key factors that affect biological nitrogen removal (BNR) performance for domestic wastewater treatment. Higher salinity could also promote the nitrite accumulation. In particular, nitrite accumulation was considered to be a major parameter for affecting the emission of N2O in both nitrification and denitrification stages, and therefore mitigate the environmental benefits of nitrogen removal process. In present study, the feasibility of simultaneous nitrification and denitrification process achievement in a SBBR was evaluated treating domestic wastewater with NaCl addition (0, 5, 10, 15 and 20 g/L) salinity addition. For more detailed insights, the changes of polyhydroxyalkanoate (PHA) and glycogen (Gly) were also analyzed to evaluate the salinity effect on nitrite accumulation and N2O emission.The results showed that with the increase of NaCl concentration, the nitrogen removal efficiency decreased, while the N2O emission ratio increased. The NH4+removal efficiency was more than 95% as the NaCl concentration was no more than 10 g/L. When the NaCl concentration increased to 20 g/L, the average NH4+decreased to 70.6%.As the NaCl increased from 0 to 20 g/L, the increment of PHA and Gly decreased from 43.6 mg/g and 34.5 mg/g to 28.2 mg/g and 22.7 mg/g, respectively, while the NO2-accumulation and the N2O emission ratio increased from 1.12 mg/L and 4.08 % to 18.87 mg/L and 13.60%. The more NaCl was added, the higher the ratio of NO2-to NOx-accomplished. The accumulated NO2-contributed to the occurrence of nitrifier denitrification (ND) by AOB. Most nitrous oxide emission was via ND process with NH4+as electron donor and NO2-as electron acceptor. The higher amount of N2O, formed in the transition zone, could be consumed in deeper regions of the biofilm when the COD was sufficient. In the absence of external carbon source, both PHAand glycogenGlywere used as internal carbon source for the endogenous denitrification. The higher NaCl concentration inhibited the PHA and Gly production, which decreased the internal electron donors for denitrification. The competition for electron between Nir and Nos during the endogenous denitrification process in the deeper region, as well as the nitrifier denitrification of AOB in the transition region, contributed to the high N2O emission, especially in the high NaCl concentration of 15 and 20 g/L. Furthermore, higher NaCl concentration reduced the density of the biofilm, which made it possible for more DO diffusing into the biofilm. It can not be ignored that DO possessed high inhibition on Nos, which attributed to the high N2O emission under high NaCl concentration. The “feast” time increased at a high salinity, revealing the inhibition of microbial activity. High salinity hindered the denitrification rate, and the inhibition degree was dependent on the influent COD/N and terminal electron acceptors. Compared with the nitrate reduction rate (DNAR) and the nitrite reduction rate (DNIR), the nitrous oxide reduction rate (DN2OR) was much more reduced by high salinity. In saline wastewater BNR process, the higher NO2-accumulation, the competion between Nir and Nos, as well as the higher DO concentration in the inner region of the biofilm, led to the increase in N2O yield.
wastewater; nitrogen; salinity; N2O; aerobic denitrification; endogenous denitrification
巩有奎,任丽芳,罗佩云,彭永臻. NaCl浓度对SBBR同步脱氮及N2O释放的影响[J]. 农业工程学报,2020,36(3):152-159.doi:10.11975/j.issn.1002-6819.2020.03.019 http://www.tcsae.org
Gong Youkui, Ren Lifang, Luo Peiyun, Peng Yongzhen. Effects of NaCl concentration on simultaneous nitrification and denitrification process and N2O emission in SBBR[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2020, 36(3): 152-159. (in Chinese with English abstract) doi:10.11975/j.issn.1002-6819.2020.03.019 http://www.tcsae.org
2019-9-23
2020-01-12
国家自然科学基金项目(51508008);烟职博士科研启动基金(2018002)
巩有奎,博士,副教授,主要从事生活污水生物脱氮过程温室气体排放控制研究。Email:260943813@qq.com
10.11975/j.issn.1002-6819.2020.03.019
X703.1
A
1002-6819(2020)-03-0152-08
