NaCl 胁迫对黄瓜幼苗叶片CsPLDα和CsNMAPK 表达及信号分子的影响
2020-04-09姚佳丽李鲁俊杨凤娟王秀峰魏珉史庆华
姚佳丽,李鲁俊,杨凤娟,2,3*,王秀峰,2,魏珉,3,4,史庆华,3,4
1.山东农业大学园艺科学与工程学院/作物生物学国家重点实验室,山东 泰安 271018
2.农业农村部黄淮地区园艺作物生物学与种质创制重点实验室,山东 泰安 271018
3.山东果蔬优质高效生产协同创新中心,山东 泰安 271018
4.农业农村部黄淮海设施农业工程科学观测实验站,山东 泰安 271018
黄瓜是设施栽培的主要蔬菜作物之一,在生产过程中经常遇到盐害等逆境胁迫。高浓度盐渍化逆境主要通过渗透、离子和氧化胁迫使植物受到伤害[1-3],从而影响植物能量和物质代谢[4],使植物生长受到抑制甚至导致死亡[5]。植物一般通过调节自身的形态特征与生理生化过程来适应轻度盐胁迫[6];而通过合成渗透调节物质、区隔过量离子及清除活性氧等响应来减轻高盐环境造成的胁迫损害,这些响应主要包括信号感知、信号转导、基因表达及相应产物产生等在内的信号系统[7]。细胞膜是植物细胞感知并传递环境胁迫信号的最重要部位。盐胁迫下,植物通过细胞膜将胞外胁迫信号传递至胞内,进而在胞内引发一系列信号级联反应;其自身也能作为前体参与第二信使1,4,5-三磷酸肌醇(IP3)、二脂酰甘油(DAG)、磷脂酸(PA)等合成,而参与磷脂信号通路[8]。
磷脂酶D(PLD)能够水解膜磷脂产生第二信使分子PA,PA能激活促分裂蛋白激酶(mitogen-activated protein kinase,MAPK)信号流和离子通道活性等引发一系列次级反应,从而完成细胞响应外部信号的过程[9,10]。在信号传递过程中,MAPK级联信号系统起着承上启下,将信号整合、放大和传递的作用[11]。林峰[12]研究发现,AtPLDα1缺失使突变体对盐更加敏感,而外施PA则可缓解盐胁迫现象;Li等[13]研究发现,将番茄SpMPK3转入拟南芥中可显著提高盐胁迫和干旱胁迫下种子的发芽率和抗氧化能力,表明SpMPK3是响应拟南芥萌发和发育阶段干旱和盐胁迫的正调控因子。刘文瑜等[14]研究发现低浓度的NO可激活抗氧化系统酶活性以减轻盐胁迫对蒺藜苜蓿种子的伤害。盐胁迫抑制黄瓜幼苗植株的生长及光合电子传递、降低叶片净光合速率[15],严重加剧膜脂过氧化程度[16]。Yu等[17]和庄宝程[18]研究发现,PA能与MAPK级联信号中的成分特异性结合,表明PLD信号转导途径与MAPK级联信号转导途径在响应逆境信号中存在关联性。故本试验拟通过NaCl处理模拟盐害,测定处理前0 h和处理后0.5 h、1 h、3 h、5 h和10 h黄瓜幼苗叶片中磷脂酶Dα(CsPL Dα)和促分裂原活化蛋白激酶(CsNMAPK)基因表达、PA、NO和活性氧等信号物质的变化,以期探明CsPLDα和CsNMAPK及各种信号分子对盐胁迫的响应机制,为丰富黄瓜耐盐机理提供理论依据。
1 材料与方法
1.1 材料与设计
以‘新泰密刺’黄瓜品种为试材。试验于2017 年4~6 月在山东农业大学本部玻璃温室内进行。经浸种催芽后的种子播于装有基质(草炭:蛭石:珍珠岩=2:1:1)的穴盘中,待第1 片真叶展平时,将幼苗转入盛5 L 营养液的水培盆中,每盆6 株。营养液中大量元素参照山崎配方[19]略加修改,微量元素参照Arnon 配方,pH 值用H2SO4调节在6.0~6.5 之间。待幼苗长至3 叶1 心时,一次性使营养液中的NaCl 浓度达100 mM,分别在处理0 h、0.5 h、1 h、3 h、5 h 和10 h 后取样并测定相关指标,重复3 次。
1.2 测定项目与方法
CsNMAPK和CsPLDα的mRNA 表达量参照Li 等[20]、Livak 和Schmittgen[21]的方法,通过实时荧光定量PCR 进行测定。CsNMAPK和CsPLDα的蛋白表达量通过Western blot 进行测定,所用抗体由艾比玛特生物医药(上海)有限公司制备。PA 含量采用双抗体夹心法测定,提取参照陶银华[22]的方法并加以修改。NO 含量采用苏州科铭生物技术有限公司一氧化氮含量测定试剂盒进行测定。O2.-的组织化学染色参考Jabs 等[23]的方法。H2O2染色用3,3’-diaminobenzidine(DAB),参考Veljovic-Jovanovic 等[24]的方法。
超氧化物歧化酶(SOD)活性测定参照Prochazkova 等[25]方法;过氧化氢酶(CAT)和过氧化物酶(POD)活性测定参照Cakmak 等[26]方法;抗坏血酸过氧化物酶(APX)活性测定参照Nakano 和Asada[27]的方法。
1.3 数据处理与分析
采用Excel 2010 软件处理数据和绘图,采用DPS V14.10 软件进行统计、相关性分析,采用新复极差法进行差异显著性检验(P<0.05)。
2 结果与分析
2.1 NaCl 胁迫对黄瓜幼苗叶片中CsPLDα和CsNMAPK 表达量的影响
图1 所示,随NaCl 处理时间延长,黄瓜幼苗叶片中CsPLDα和CsNMAPK基本呈先升高后降低趋势。处理1 h 后CsPLDα表达量达最大值,为0 h 表达量的6.65 倍,差异显著;而处理3 h 后CsNMAPK表达量达最大值,为0 h 表达量的15.56 倍,差异显著,且两基因表达量均在处理10 h 后略有上升。
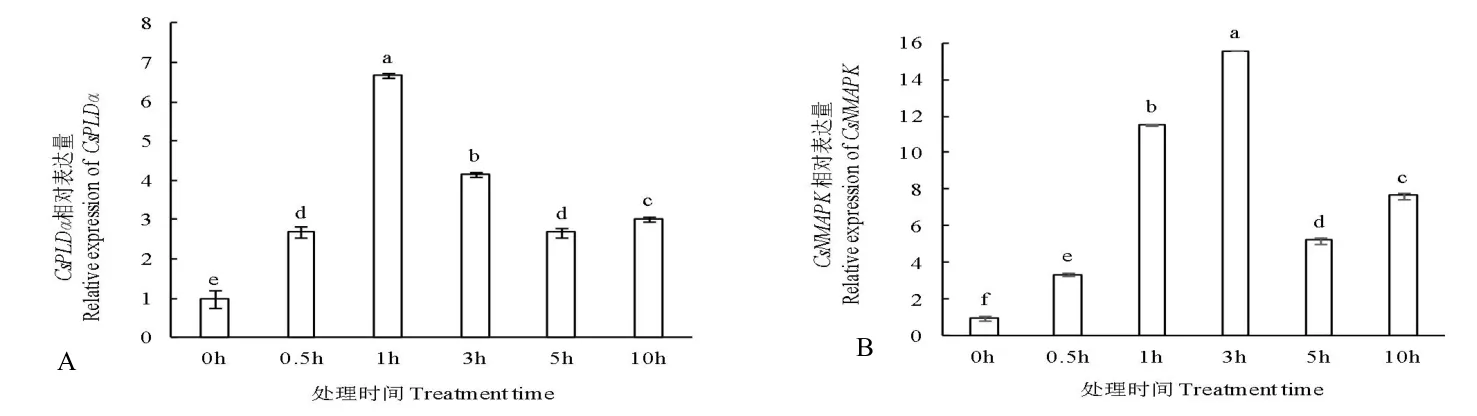
图1 NaCl 胁迫对黄瓜幼苗叶片中CsPLDα(A)和CsNMAPK(B)相对表达量的影响Fig.1 Effects of NaCl stress on relative expression of CsPLDα(A)and CsNMAPK(B)in cucumber seedling leaves
2.2 NaCl 胁迫对黄瓜幼苗叶片中CsPLDα和CsNMAPK 蛋白表达量的影响
NaCl 处理后0~10 h 范围内,黄瓜幼苗叶片中CsPLDα蛋白表达量均得到明显诱导,在处理1 h后表达量较高,处理5 h后的表达量亦稍高于其它处理。随NaCl处理时间延长,幼苗叶片中CsNMAPK表达量呈先增后降趋势,处理3 h 后表达量较高,其它处理时间下表达量差异不明显(图2)。
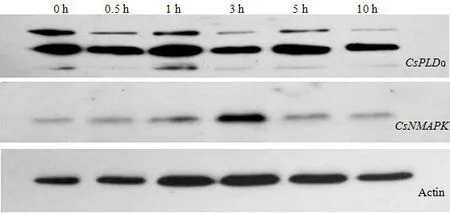
图2 NaCl 胁迫对黄瓜幼苗叶片中CsPLDα和CsNMAPK 蛋白表达量的影响Fig.2 Effects of NaCl stress on CsPLDα and CsNMAPK protein expression in cucumber seedling leaves
2.3 NaCl 胁迫对黄瓜幼苗叶片中磷脂酸含量的影响
由图3A 可以看出,随处理时间延长,黄瓜幼苗叶片中PA 含量亦呈先升高后降低趋势。在NaCl处理3 h 后,PA 含量达到较高值,比处理0 h 显著增加18.6%,随后其含量逐渐降低。
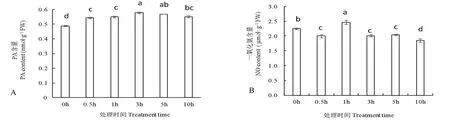
图3 NaCl 胁迫对黄瓜幼苗叶片中磷脂酸(A)和一氧化氮(B)含量的影响Fig.3 Effects of NaCl stress on the content of PA(A)and NO(B)in cucumber seedling leaves
2.4 NaCl 胁迫对黄瓜幼苗叶片中一氧化氮含量的影响
由图3B 可知,NaCl 处理0~10 h 范围内,黄瓜幼苗叶片中一氧化氮(NO)含量在处理1 h 后显著升高,比处理0 h 增加9.1%,随后逐渐下降,且其它处理时间,其含量均低于0 h 处理。
2.5 NaCl 胁迫对黄瓜幼苗叶片中过氧化氢和超氧阴离子含量的影响
图4 显示,随处理时间延长,黄瓜幼苗叶片中过氧化氢(H2O2)和超氧阴离子(O2·-)含量均呈逐渐升高趋势。

图4 NaCl 胁迫对黄瓜幼苗叶片中过氧化氢(A)和超氧阴离子(B)含量的影响Fig.4 Effects of NaCl stress on the content of H2O2和O2·in cucumber seedling leaves
2.6 NaCl 胁迫对黄瓜幼苗叶片中抗氧化酶活性的影响
如图5 所示,随处理时间延长,黄瓜幼苗叶片中抗氧化酶活性基本呈先降低后升高再降低趋势,在处理0.5 h 后,其SOD、CAT、POD 和APX 活性均显著低于0 h。SOD 活性在处理3 h 后达到较高值,但与处理0 h 无显著差异,处理0.5 h、1 h、5 h 和10 h 后其活性均显著低于处理0 h 后的活性;CAT、POD 和APX 活性均在处理5 h 后达较高值,分别比处理0 h 增加31.3%、33.0%和15.6%,在处理10 h 后略有降低。
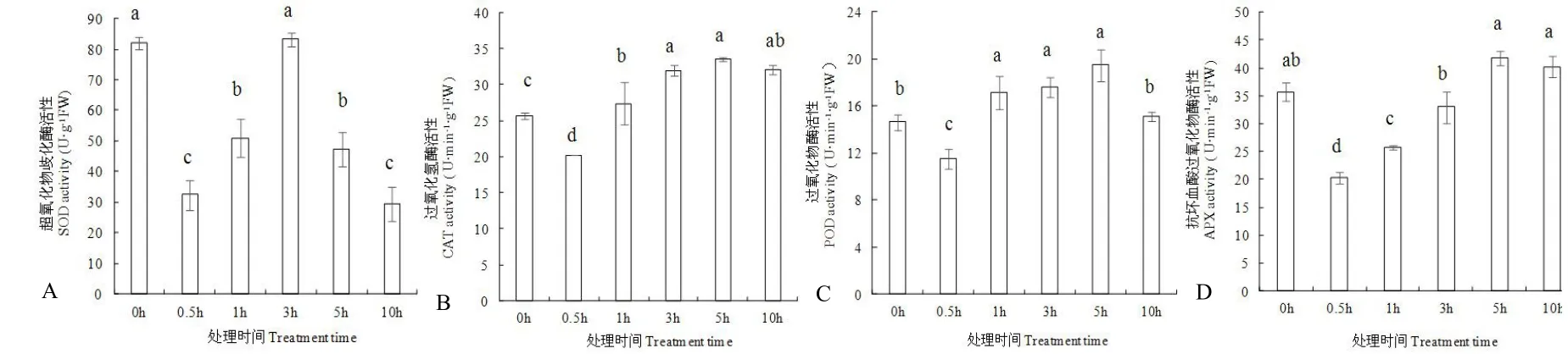
图5 NaCl 胁迫对黄瓜幼苗叶片中超氧化物歧化酶(A)、过氧化氢酶(B)、过氧化物酶(C)和抗坏血酸过氧化物酶(D)活性的影响Fig.5 Effects of NaCl stress on the activities of SOD(A),CAT(B),POD(C)and APX(D)in cucumber seedling leaves
3 讨论
研究表明,植物能够感受并迅速应答各种胁迫的信号转导过程,与特异的磷脂酶D(PLD)和下游产物磷脂酸(PA)激活有关[28];PA 是植物中重要的脂质信号分子,被称为“脂质第二信使”,参与多种逆境胁迫相关的信号传导途径[29]。而许多信号途径依靠支架蛋白提供的定位点,与信号通路中的成员结合进而有效传递信号,特别是MAPK 级联途径。当用NaCl 处理拟南芥细胞或幼苗时,AtPLDα1可被激活,产生第二信使PA 来参与盐响应过程[17,30]。林峰[12]研究表明,外施PA 可缓解植物因缺失AtPLDα1对盐的敏感性。Yu 等[17]研究发现,盐胁迫激活的PLDα1所产生的PA,能诱导MAPK6 激酶活性增加,进而引起下游机制响应来提高植物抗盐性;Lee[8]研究发现用正丁醇抑制PLD活性后,MAPK 活性亦受到抑制,而外施PA 能激活MAPK 活性。本试验结果表明,短时间NaCl胁迫处理后,黄瓜幼苗叶片中CsPLDα和CsNMAPK表达量呈先升高后降低趋势,CsPLDα表达量在处理1 h 后达最大值,而CsNMAPK表达量在处理3 h 后达最大值;两者的蛋白表达量亦分别在处理1 h 和3 h 达最大值;PA 含量亦呈先升高后降低趋势,在处理3 h 后达较高值,Li 等[31]研究结果与之相一致。以上结果说明,盐胁迫下黄瓜幼苗叶片中CsPLDα和CsNMAPK基因对NaCl 胁迫响应存在时间差,且CsPLDα响应早于CsNMAPK。NO 作为一种气体生物活性分子,在植物的生长发育和逆境信号应答过程中发挥重要功能[32]。Zhang 等[33]研究发现PLD 和PA 能够参与NO 缓解盐胁迫信号转导过程;Zhang 等[34]研究表明ABA 诱导气孔关闭信号转导过程中,NO 位于PLDα1/PA 信号下游;同时发现NO 能够激活叶肉细胞的PLD 活性。Raho 等[35]研究发现,植物通过PLD 和PLC/DGK 途径产生PA 需要NO 参与。Kumar 等[36]和Clark 等[37]研究发现激活的MAPKs 级联途径可引发NO 大量产生,而NO 亦能激活MAPK 活性来提高烟草和拟南芥的抗病能力。本试验结果表明,NO 可迅速被NaCl 诱发,且在处理1 h 后黄瓜幼苗叶片中NO 达最大值,与CsPLDα表达量出现最大值同步,且早于CsNMAPK信号响应。
盐胁迫下,植物体内会产生并积累大量的氧自由基,从而引起细胞膜脂过氧化。作为植物抗氧化的第一道防线,SOD 可通过清除过剩的超氧阴离子,催化活性氧发生歧化反应产生H2O2,来提高植物的抗氧化能力[38];而POD 和CAT 能催化H2O2与其底物反应进而分解H2O2,从而解除逆境胁迫产生的活性氧对植物的伤害[39]。本试验结果表明,NaCl 胁迫下,黄瓜幼苗叶片中SOD 活性在3 h后达较高值,CAT、POD 和APX 活性均在5 h 后达较高值;而叶片中H2O2和O2-·含量却随处理时间延长呈逐渐增加趋势。Ji 等[40]研究表明,过表达黄瓜CsPLDα可通过提高抗氧化酶SOD、POD、CAT及APX 的活性来提高烟草幼苗对NaCl 胁迫的抗性。而王静[41]研究也发现,过表达CsNMAPK能通过增加黄瓜幼苗叶片中的NO 含量和减少叶片中的O2·-和H2O2含量来提高对高浓度NO3-的抗性。说明以上保护机制可能是由受CsPLDα介导的CsNMAPK级联途径来激活[42]。
4 结论
本试验条件下,经100 mM NaCl 处理后,黄瓜幼苗叶片中CsPLDα和CsNMAPK 基因表达量和蛋白表达量分别在处理1 h 和3 h 达最大值,说明此两基因表达存在时间差;PA 含量呈先升高后降低趋势,在处理3 h 后达较高值;NO 含量在处理1 h 显著升高;H2O2和O2-含量随处理时间延长呈逐渐增加趋势;SOD 活性在处理3 h 后达较高值,而CAT、POD 和APX 活性均在处理5 h 后达较高值。以上结果表明,黄瓜幼苗叶片中CsPLDα和CsNMAPK基因表达对盐响应存在时间差,且CsPLDα表达早于CsNMAPK表达。
