一株氯嘧磺隆降解菌分离鉴定及降解条件优化
2020-04-09杨峰山张瑞肖延臣刘春光付海燕
杨峰山,张瑞,肖延臣,刘春光,付海燕
1 黑龙江大学 农业微生物技术教育部工程研究中心,黑龙江 哈尔滨 150500
2 黑龙江大学 生命科学学院 黑龙江省寒地生态修复与资源利用重点实验室,黑龙江 哈尔滨 150080
3 黑龙江大学 生命科学学院 黑龙江省普通高校分子生物学重点实验室,黑龙江 哈尔滨 150080
氯嘧磺隆 (Chlorimuron-ethyl) 是美国杜邦公司20世纪80年代研制的一种广谱、高效的选择性内吸传导型磺酰脲类除草剂,在我国广泛用于防除大豆、玉米等作物田间阔叶及禾本科杂草[1]。氯嘧磺隆的田间使用量和残留量不高,但残留时间长、难降解,尤其实际使用过程中存在长期、超量、重复使用等问题,对后茬敏感作物产生不同程度药害[2-4],造成减产甚至绝产,对农田土壤和周边水体造成污染,对生态环境和人类健康造成潜在威胁[5]。氯嘧磺隆在土壤中的降解主要包括光解、化学水解和微生物降解 3种途径,微生物降解因其具有高效、快速、安全等优点成为各国学者关注的焦点[6]。目前已经报道的具有氯嘧磺隆降解特性的微生物有真菌如掷孢酵母Sporobolomycessp.LF1、粘质沙雷氏菌Serratia marcescensN80、黑曲霉Aspergillus niger[7-10],细菌如假单胞菌Pseudomonassp. LW3、克雷伯氏菌Klebsiella jilinsis2N3、枯草芽孢杆菌Bacillus subtilisYB1、Hansschlegeliasp. CHL1、红球菌Rhodococcussp.D310-1、嗜麦芽寡养单胞菌Stenotrophomonas maltophiliaD310-3和路德维希氏肠杆菌属Enterobacter ludwigiisp.等[11-17]。深入挖掘氯嘧磺隆降解菌株资源,获得种类更多、降解特性更高的氯嘧磺隆降解菌株,进行氯嘧磺隆污染土壤生物修复,对农业种植结构调整、生态环境保护和可持续发展具有重要意义。
本研究从氯嘧磺隆污染土壤中分离鉴定了1株以氯嘧磺隆为唯一碳源的高效降解菌, 研究其对氯嘧磺隆的降解特性,优化菌株降解条件,提高其降解效率。为氯嘧磺隆污染土壤原位生物修复提供理论及应用依据。
1 材料与方法
1.1 土壤样品采集
从山东省高密市呼家庄镇小南庄村氯嘧磺隆药害农田中采集土壤样品,去除作物根系及地表浮土,随机选取10个采样点,每点取样200 g,深度5–13 cm,置于灭菌自封袋中,4 ℃冰箱保存。
1.2 主要试剂
氯嘧磺隆20%可湿性粉剂,大连瑞泽农药厂生产;氯嘧磺隆标样 (GSBG24151-42国标液):100 ng/μL,介质为丙酮,农业部天津环境保护科研监测所监制;琼脂糖凝胶DNA回收试剂盒 (天根生化科技有限公司);引物由生工生物工程 (上海) 股份有限公司合成;pMD18-T Vector购自大连宝生物公司;其他化学试剂均为分析纯。
1.3 氯嘧磺隆降解菌株分离
以氯嘧磺隆为唯一碳源,采用摇瓶富集培养技术分离土壤中的降解菌株。氯嘧磺隆起始含量200 mg/L,30 ℃、200 r/min恒温振荡培养5 d后5%接种量转接,终浓度至800 mg/L,3次重复。应用高效液相色谱法进行农药残留量的检测。选取降解率较高的样品,梯度稀释,30 ℃反复纯化培养,4 ℃冰箱保存[18]。
1.4 氯嘧磺隆降解菌鉴定
1.4.1形态特征鉴定
采用平板划线法将氯嘧磺隆降解菌接种于无机盐基础固体培养基 (MSM, NaCl 0.50 g/L,KH2PO40.50 g/L,K2HPO41.50 g/L,MgSO4·7H2O 0.50 g/L,NH4NO31.00 g/L,Agar 20 g/L,pH 7.0),30 ℃恒温培养5 d后观察菌落形态。采用革兰氏染色法和KOH反应试验确定菌株革兰氏类型。扫描电子显微镜观察菌株显微结构。
1.4.2生理生化鉴定
参照《伯杰细菌鉴定手册》[19]完成菌株生理生化指标测定,包括淀粉水解试验、液化明胶试验、接触酶试验、VP试验、耐盐性、氧化酶、葡萄糖氧化发酵、MR试验 (甲基红试验)、柠檬酸盐利用试验、乙醇氧化、高温培养 (60 )℃、吲哚试验等。
1.4.3 16S rDNA基因序列测定与系统发育分析
采用CTAB法和SDS高盐沉淀法提取菌体总DNA。利用16S rDNA通用上、下游引物P2/P7,P2:5′-AGAGTTTGATCCTGGCTCAG-3′和 P7:5′-AAGGAGGTGATCCAGCCGCA-3′扩 增 降 解 菌株的16S rDNA区域序列。PCR产物回收、纯化,与 T载体连接。将10 μL连接产物转化到E. coliDH5α感受态细胞,检测阳性克隆子。利用pMD18-T载体上的通用引物,由生工生物工程 (上海) 股份有限公司测序,应用BLAST进行DNA序列分析。测序结果与GenBank上的序列进行同源性比对,用ClustalX进行序列比对,并构建系统发育树。
1.5 氯嘧磺隆降解性能测定
降解菌株在 LB液体培养基活化至对数生长期,离心去上清,0.02 mol/L NaH2PO4-Na2HPO4(pH 7.0) 缓冲液洗涤2次,用等体积缓冲液悬浮菌体,4 ℃保存备用。
制备氯嘧磺隆300 mg/L的无机盐基础培养液(MSM,不含琼脂),接入终浓度为8.0×107cfu/mL降解菌株,30 ℃、200 r/min条件摇床振荡培养5 d,离心取上清液2 mL,参照肖延臣[18]建立的氯嘧磺隆的高效液相色谱条件,测定氯嘧磺隆浓度,设不接菌为对照。降解率计算公式:
降解率(%)=(残留农药量/起始农药量)×100%。
1.6 氯嘧磺隆降解菌降解条件优化
分别以 10 ℃、15 ℃、20 ℃、25 ℃、30 ℃、35 ℃、40 ℃、45 ℃作为温度试验组,以初始pH分别为 4.0、5.0、6.0、6.5、7.0、7.5、8.0、9.0、10.0作为pH试验组,以分别装入25 mL/250 mL、50 mL/250 mL、75 mL/250 mL、100 mL/250 mL、125 mL/250 mL、150 mL/250 mL、200 mL/250 mL培养基作为装液量试验组,以氯嘧磺隆浓度分别为50 mg/L、l00 mg/L、150 mg/L、200 mg/L、250 mg/L、300 mg/L、400 mg/L、600 mg/L、800 mg/L作为初始浓度试验组,分别按1%、2%、4%、6%、8%、10%、15% (V/V) 的量定量接种菌悬液作为接种量试验组。以上各试验组均使用初始浓度300 mg/L无机盐基础培养液,每个处理设3次重复,对照组加药不接菌,200 r/min摇床培养5 d后,测定培养液OD600值及氯嘧磺隆降解率,研究不同环境因素对降解菌株生长和氯嘧磺隆降解率的影响。
1.7 氯嘧磺隆降解菌株降解性能正交优化试验
在单因素实验基础上,对pH值、浓度、接种量、培养温度和装液量进行5因素4水平的正交实验,每个处理重复3次。以降解率作为考察指标。正交实验设计表见表1。
1.8 数据处理
所有数据取3次重复的平均值,数据分析和制图采用Origin8.0软件完成。
2 结果与分析
2.1 氯嘧磺隆降解菌分离
通过富集培养、逐级驯化和平板分离等方法,分离出一株氯嘧磺隆降解菌,命名为 T9DB-01,该菌株以氯嘧磺隆为唯一碳源。测得菌体浓度为8.0×107CFU/mL,30 ℃、pH 7.0、200 r/min 条件下培养5 d,对浓度为300 mg/L的氯嘧磺隆的降解率为92.1%。
菌落呈白色,不透明,形态呈圆形,表面光滑,微微隆起,边缘整齐。菌株为革兰氏阴性,无芽孢。扫描电镜下观察到菌体细胞长杆状,菌体大小(0.2–0.4)×(0.8–0.9) μm,侧生鞭毛 (图 1),好氧,能运动。
2.2 氯嘧磺隆降解菌株生理生化鉴定
对氯嘧磺隆降解菌株T9DB-01进行24项生理生化指标鉴定,结果如表2所示。
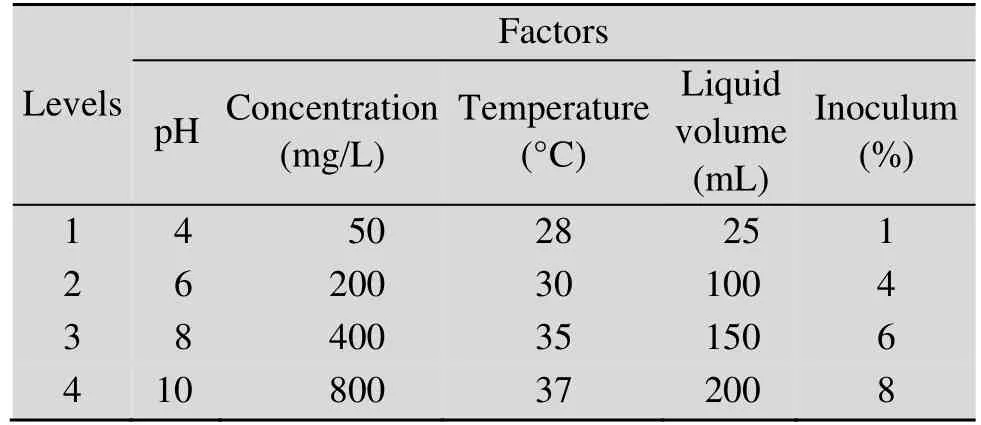
表1 T9DB-01降解特性正交实验设计表Table 1 Or thogonal expe riments de sign of strain T9DB-01 about degradation characteristics
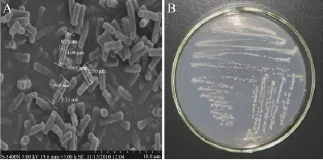
图1 菌株T9DB-01扫描电镜图 (A) 和无机盐培养基上菌落形态 (B)Fig. 1 Morphological observation of strain T9DB-01. (A)A scanning electron micrograph of strain T9DB-01. (B) A photograph of the colony after 2 days culture on mineral medium.

表2 降解菌株T9DB-01生理生化特征Table 2 Physiological and biochemical c haracteristics of strain T9DB-01
2.3 氯嘧磺隆降解菌分子生物学鉴定
菌株T9DB-01的16S rDNA序列与假单胞菌属的序列同源性达到100%。说明该菌株在分子系统发育分类学上属于假单胞菌属,学名为Pseudomonassp.。用Clustalx软件分析比对菌株的16S rDNA基因序列,利用NJ法构建系统发育树(图 2)。结合菌株的形态特征、生理生化特征,综合推断该菌株为假单胞菌Pseudomonassp.。菌株T9DB-01序列已在GenBank中注册,GenBank登录号为GU395783。
2.4 环境因素对 T9DB-01生长和氯嘧磺隆降解的影响
温度对菌株 T9DB-01降解率影响比较大(图3A),10–45 ℃降解率呈先增加后减小的趋势,30 ℃时菌体的降解率为 86.3%达到最大值,此时菌体OD600值为0.771。pH 4.0–10.0范围内,降解率先增加后减小 (图3B),pH值为7.0时降解率达到最大值 90.4%,此时菌体OD600值为 0.904。氯嘧磺隆的降解率随着接种量增加而增大 (图3C),但在接种量达4%以后,降解率不再显著增加,故确定4%为最佳接种量。氯嘧磺隆初始浓度对菌株T9DB-01的生长及降解率的影响呈先升后降的趋势 (图3D),氯嘧磺隆浓度在50–300 mg/L范围内,降解菌的生长呈逐渐上升趋势,氯嘧磺隆浓度在300–800 mg/L范围内,菌株T9DB-01生长受到抑制,降解率也随之逐渐减低。随着三角瓶中装液量的增加,菌株的生长速度呈现先上升后下降的趋势(图3E),装液量为100 mL时,菌体的生长量和降解率均达到峰值。
2.5 正交法对环境条件的优化
单因素实验结果单一,为进一步优化菌株降解条件,提高菌株对氯嘧磺隆降解率,根据单因素实验结果,设计5因素4水平正交实验。结果显示,正交试验第12组 (A2B3C2D2E2) 为菌株T9DB-01降解氯嘧磺隆最佳条件:30 ℃,pH 8.0,接种量4%,装液量100 mL/250 mL,底物浓度为200 mg/L,培养5 d,降解率为93.7% (表3)。
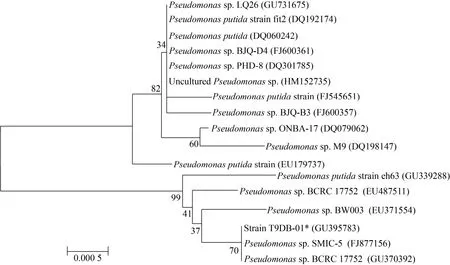
图2 菌株T9DB-01基于16S rDNA基因序列的系统发育树Fig. 2 Phylogenetic tree based on 16S rDNA genes of strain T9DB-01.
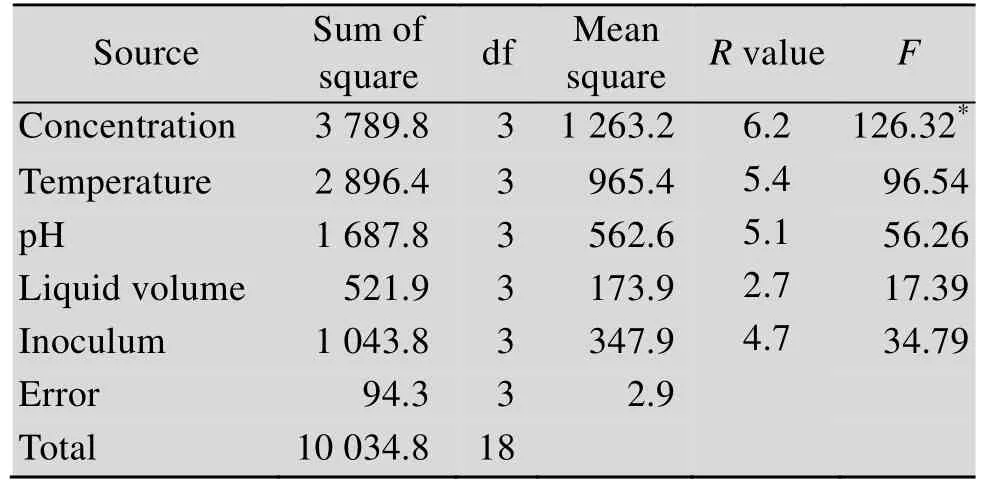
表4 正交实验结果方差分析Table 4 Variance analysis of orthogonal test results
进一步对方差分析可以发现,5个因素中浓度的F值最大,为 126.32,对其降解氯嘧磺隆效果影响达到极显著水平。其次是温度,装液量的F值最小。所以5个因素的显著性差异由大到小的顺序是:底物浓度>温度>pH值>接种量>装液量。
3 讨论
以微生物修复理论为基础的除草剂残留降解技术是解决土壤修复问题的有效途径[20]。文献已经报道了很多能降解或转化氯嘧磺隆的微生物,包括真菌、细菌和放线菌,其中以细菌为主。Ma等[11]从污染土壤中分离到氯嘧磺隆降解菌为假单胞菌属LW3,氯嘧磺隆50 mg/L,pH 7.0,30 ℃,接种7 d后,液体培养基中的降解率约为81.5%。Pan等[17]从污染土壤中分离得到氯嘧磺隆降解菌Enterobacter ludwigiisp.,生物降解作用随着浓度(1–10 mg/L) 和温度 (20–40 ℃) 的升高而增加,最佳pH为7.0。刘艳等[21]从长期施用氯嘧磺隆的土壤中分离得到 1株氯嘧磺隆降解菌恶臭假单胞菌L-6,200 mg/L、pH 8.0、30 ℃,接种4 d后氯嘧磺隆降解率达到80%以上。Zhang等[22]从污染农田土壤中分离出苯磺隆甲基共代谢降解菌株假单胞菌属NyZ42,当葡萄糖或琥珀酸盐作为补充碳源时,200 mg/L苯磺隆甲酯,接种4 d,降解率约80%。Li等[23]用两种氯嘧磺隆-乙基降解菌株(Rhodococcussp. D310-1;Enterobactersp. D310-5)混合发酵制备氯嘧磺隆-乙基降解细菌聚生体,在温室中用于修复氯嘧磺隆污染的 (20 mg/kg) 土壤,60 d后降解率达到 80.02%。Cheng等[24]对D310-1进行了RNA-Seq分析,根据qRT-PCR,提出羧酸酯酶、细胞色素P-450和糖基转移酶3个基因参与氯嘧磺隆的生物降解。本研究从氯嘧磺隆污染土壤中分离到1株高效氯嘧磺隆降解菌,经鉴定为假单胞菌Pseudomonassp.。氯嘧磺隆200 mg/L,30 ℃,pH 8.0,接种量 4%,装液量 100 mL/250 mL,培养5 d,降解率为93.7%。利用假单胞菌对氯嘧磺隆污染土壤进行生物修复具有巨大潜力。假单胞菌既可以降解氯嘧磺隆,也可以降解其他磺酰脲类除草剂,体现了微生物适应环境的多重活性。
降解菌株氯嘧磺隆的效率与菌株活性密切相关,凡是能够影响微生物活性的因素均能影响它们的降解率。如底物浓度、温度、pH值、装液量、接种量等因子。其中底物浓度对降解菌的降解效率影响达到极显著水平,底物浓度小于300 mg/L可促进菌株生长,大于300 mg/L则抑制菌株生长。这与刘艳等[21]在研究恶臭假单胞菌属菌株 L-6降解特性时得到的结果基本相同,氯嘧磺隆浓度为200 mg/L时,菌株L-6的降解率达到86.75%。低于或高于该浓度,菌体生长量和降解率均有所下降。李春艳等[25]在研究肠杆菌属菌株D310-5也得到同样结果。这是因为氯嘧磺隆作为一种复杂的化学物质,一方面为微生物的生长提供了碳源,随着浓度增加,为菌体提供足够的能量,使菌体大量繁殖,促进了菌株对氯嘧磺隆的降解;另一方面氯嘧磺隆具有一定的毒性,且难以被微生物直接利用,当氯嘧磺隆浓度过大时,对菌株产生了毒性,影响菌株生长,从而使降解率下降。当氯嘧磺隆的浓度较低时,菌体可以耐受氯嘧磺隆的毒性,并能够利用其提供的碳源生长,当氯嘧磺隆的浓度高于菌体的耐受力时则抑制其生长。菌体对氯嘧磺隆的耐受能力因菌而异。
经降解条件优化,氯嘧磺隆降解菌株T9DB-01在实验室条件下较其他菌株表现出显著优良的降解性能,具有一定的应用潜力,为氯嘧磺隆降解菌株资源提供了有益的补充,关于菌株T9DB-01在污染土壤中的降解能力及对后茬敏感作物药害修复能力还需进一步研究。
