奶粉中单核增生李斯特菌能力验证结果与分析
2020-04-08周志南吴渊夏琪琪黄甜甜杨启立刘鹏鹏
周志南 吴渊 夏琪琪 黄甜甜 杨启立 刘鹏鹏
摘 要:目的:提升单核增生李斯特菌的检测能力,增强实验室的竞争能力。方法:按照现行的检验标准GB 4789.30-2016进行增菌,再用不同的增菌液进行二次增菌,然后分离、生化鉴定,并采用PCR电泳凝胶成像、全自动病原菌检测系统(BAX Q7)和全自动微生物生化鉴定系统(VITEK2)对增菌液和疑似菌进行鉴定。结果:本实验室2个样品测试均取得满意的结果,单核细胞增生李斯特氏菌的能力验证满意率仅为59%。结论:采用不同增菌液对结果有一定的影响,为避免漏检,必要时可将两种不同增菌液结合起来使用,并采用多种鉴定手段,以提高目标菌的检出率。
关键词:奶粉;单核增生李斯特菌;能力验证
Abstract:Objective: To strengthen the detection capability of L. monocytogenes and enhancing the competitiveness of laboratories. Methods: The enrichment of samples was carried out under the following present standards GB 4789.30-2016, National food safety standard food microbiological examination, and use different liquid enrichment medium for enrichment, then isolation and biochemical identification. The isolated bacteria of two samples were identified by PCR、BAX Q7 and VITEK2. Results: The test results of two samples were satisfied. The satisfactory rate of ability verification of L. monocytogenes was only 59%. Conclusion: The results showed that different liquid enrichment medium had certain influence on the results. In order to avoid missed detection, two different enrichment liquids could be used together if necessary, and a variety of identification methods could be used to improve the detection rate of target bacteria.
Key words:Milk powder; L. monocytogenes; Proficiency testing
中圖分类号:R155.5
李斯特氏菌属(Listeria)早在20世纪初即被发现,它共有7个菌种,革兰氏染色阳性。其中,单核细胞增生李斯特氏菌(L. monocytogenes)简称单增李斯特菌,是唯一能引起人畜共患疾病的病原菌。单增李斯特菌广泛存在于自然界中,引起李斯特菌病暴发的食品主要有乳及乳制品、肉类制品、水产品以及蔬菜水果,其中蔬菜水果、乳及乳制品中最为常见。中毒多发生在夏秋季,感染后能引起李斯特菌病,主要表现为败血症、脑膜炎和单核细胞增多[1],对孕妇、婴儿、老年人及免疫力低下者更容易引起感染。欧美国家曾多次发生该菌引起的食物中毒,死亡率达30%以上,致死率甚至高达70%[2]。因此,许多国家将其列入进出口必检项目。现行的有效标准中都要求不得检出,而实验结果的准确性直接关系到一个单位的实验室工作技术能力水平。通过能力验证,可以识别实验室存在的问题并启动改进措施,以达到不断提高实验室检测技术和质量控制水平的目的[3]。能力验证作为评价实验室能力的一个重要手段,一直以来受到国内外实验室管理者的广泛重视。为了使实验室的检验水平与国际接轨,本实验室参加了英国食品与环境研究院(Fera)组织的FAPAS分析实验室能力验证(Food Analysis Performance Assessment Scheme)——奶粉中单核增生李斯特菌检测能力验证,取得了满意的结果。
1 材料与方法
1.1 标准菌株
单核细胞增生李斯特氏菌ATCC 19111、英诺克李斯特氏菌ATCC 33090,购自青岛海博生物技术有限公司;伊氏李斯特氏菌CICC 21663、斯氏李斯特氏菌CICC 21671,购自中国工业微生物菌种保藏管理中心。
1.2 待测样品
FAPAS-Food Microbiology Distribution 224奶粉能
力验证样品,批号为M224d02,外观为25 mL塑料广口瓶,内装25 g奶粉,共两瓶,样品编号分别为M224d02A、M224d02B(简称A、B,下同),由英国食品与环境研究院(Fera)提供。
1.3 培养基及试剂
李氏增菌肉汤LB(LB1,LB2)、Fraser增菌肉汤、PLACAM琼脂培养基、血液琼脂基础培养基、TSA-YE培养基、李斯特菌显色培养基(以下简称李显培养基)、单增李斯特菌干制生化鉴定试剂盒、PCR所用试剂、单增李斯特菌BAX试剂盒、VITEK2 GP鉴定卡。
1.4 仪器
生物安全柜、培养箱、高压灭菌锅、PCR仪、电泳仪、凝胶成像仪、全自动病原菌检测系统BAX Q7、VITEK2 Compact全自动微生物鉴定系统。
1.5 方法
按照国家标准GB 4789.30-2016第一法单增李斯特菌定性检验的要求进行增菌、分离和鉴定,划线分离的同时进行涂布分离。同时,采用PCR电泳凝胶成像、全自动病原菌检测系统(BAX Q7)和全自动微生物生化鉴定系统(VITEK2)对增菌分离的增菌液和疑似菌进行鉴定,最终综合以上试验结果出具报告。同时,以单增李斯特菌ATCC 19111作为阳性对照菌进行阳性对照试验。
1.5.1 增菌
在生物安全柜内以无菌操作将25 g奶粉样品加入到含有225 mL LB1增菌液中,充分摇匀。于(30±1)℃培养24~48 h,移取0.1 mL转种于10 mL LB2增菌液内,于(30±1)℃培养(24±2)h。同时移取0.1 mL于10 mL于Fraser增菌肉汤中,于(37±1)℃培养(48±2)h。
1.5.2 划线分离和涂布分离
各从LB2增菌液和Fraser肉汤中挑取培养物一环划线接种于李显平板和PALCAM琼脂平板,并同时各从LB2增菌液和中Fraser肉汤吸取0.4 mL增菌液涂布接种于李显平板和PALCAM琼脂平板,于(36±1)℃培养24~48 h。同时操作阳性对照。
1.5.3 生化反应试验
从李显平板和PALCAM琼脂平板平板上选取典型菌落,划线接种于TSA-YE平板上,(36±1)℃培養18~24 h,涂片,进行革兰氏染色、镜检,并用商业化的单增李斯特菌干制生化鉴定试剂盒进行生化鉴定及溶血试验。
1.5.4 VITEK2-Compact鉴定
分别从TSA-YE平板上挑取纯化菌落,制备0.5~0.8 MCF的菌悬液,用GP鉴定卡上机VITEK2鉴定系统进行鉴定。
1.5.5 PCR法电泳凝胶成像
从LB1和LB2增菌液中各吸取1 mL于EP管中,离心洗菌后,于95 ℃裂解10 min。配制反应体系:12.5 μL 2×PCR TaqMix;上下游引物各0.5 μL;DNA模板1 μL;加双蒸水补至终体积25 μL。PCR反应条件:95 ℃预变性5 min;95 ℃变性30 s,55 ℃退火30 s,74 ℃延伸1 min,共35个循环;最后72 ℃延伸5 min,凝胶电泳成像。
1.5.6 BAX Q7鉴定
按BAX单增李斯特菌检测试剂盒说明书来操作上机鉴定。
2 结果与分析
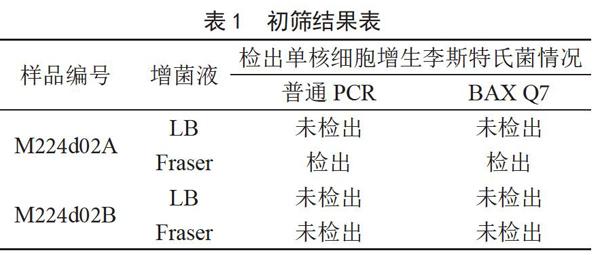
2.1 初筛
对增菌液采用PCR法、BAX Q7进行初筛,结果如表1所示,A样品仅在Fraser增菌液中有单增李斯特菌检出,LB增菌液中初筛未检出。结果显示,可能受干扰菌或培养条件等影响,LB增菌液目标菌增菌效果较差,不能达到PCR方法的检出限。
2.2 划线分离和涂布分离结果
通过划线分离,两个样品在李显培养基和PALCAM
琼脂平板上都有可疑菌落,染色镜检结果均为革兰氏阳性菌,需进一步进行生化鉴定。其中,A样品目标菌增菌效果较差,LB2增菌液划线分离多块平板均出现选择性培养基无菌生长情况,增菌液涂布分离可疑菌落不多于10个;但经Fraser增菌后,李显培养基和PALCAM上菌长有典型菌落。B样品在PALCAM培养基上也分离到可疑菌落,但在李显培养基上长有蓝色菌落但无白色晕环,且Fraser增菌比LB2增菌效果较好。
2.3 生化反应试验结果
对李显培养基平板和PALCAM琼脂平板上的可疑菌落进行分离纯化,根据GB 4789.30-2016进行生化鉴定。结果显示,A和B的生化反应仅溶血反应有区别。结合菌落形态生化反应,可以初步判定A样品检出单增李斯特菌,与单增李斯特菌阳性对照完全一致;B样品检出英诺克李斯特氏菌。VITEK2检测结果显示,A样品检出李斯特属菌(需做溶血反应确认,结合溶血反应结果判断为单增李斯特菌),B样品检出英诺克李斯特氏菌。
3 讨论
从这次的FAPAS能力验证的结果报告中可以看出,本次单增李斯特菌的能力验证计划共计有64家实验室参加,其中只有38家实验室检测结果被评为满意,占59%;28家实验室检测结果被评为不满意,占41%[4]。A样添加目标菌单增李斯特菌,检测结果显示28家实验室(41%)得到假阴性结果;B样添加英诺克李斯特菌作为干扰菌,有10家实验室(16%)得到假阳性结果。
常规培养法是基准方法,检测成本较低,在一般的实验室都能开展,但检测步骤多,检测周期较长。在二次增菌后还要纯培养,生化鉴定步骤中的溶血试验操作比较难把握,因此在检测工作者经验不足的情况下容易漏检和假阳性。
在选择增菌过程中,应严格按照标准方法进行二次增菌。目前国内都有报道不同增菌液对检出单增李斯特菌的检出效果,总的检出率没有很大的差异性,但对不同类食品的检出率有所不同。这就说明针对不同类食品有必要选择不同种类的增菌液来达到最好的增菌效果。国家标准的LB二次增菌和Fraser的二次增菌法对不同的食品都有很高的检出率,增菌范围都比较广。但从这一次的FEPAS能力验证来看,Fraser肉汤的二次增菌后检出单增李斯特菌的效果好于LB的二次增菌,所以必要时可将该两种方法结合一起增菌,以达到提高检出单增李斯特菌的目的。
单增李斯特菌的检测在食品微生物检测中对检测人员经验有较高的要求,尤其是生化反应鉴定。在挑取可疑菌落进行纯化的时候,可同时接种木糖,鼠李糖发酵管进行初筛。鼠李糖(+)和木糖(-)这两个生化特征可以区分单增李斯特菌和其他大部分的李斯特菌。另外,无论是选择用生化鉴定试剂盒还是用VITEK全自动微生物检测系统,均需进行溶血试验和协同溶血试验才能做最终的确定。而本次能力验证B样品添加英诺克李斯特菌作为干扰菌,其生化特征反应仅溶血试验与单增李斯特菌不同。溶血试验对检测人员经验和血平板质量要求要求较高,如存在操作不当极有可能造成溶血现象的误判,这也可能是16%实验室得到假阳性结果的重要原因之一。建议使用API Lisiter生化鉴定,即可区分单增、英诺克及伊氏,又能对选择性平板分离和初步生化结果进行验证。且API省去溶血试验和协同溶血试验的鉴定步骤,即缩短检测时间又提高检测准确性。
Hly基因是Lm最重要的毒力基因,它的缺失将会导致细菌毒力的全部丧失[5]。尽管通过生化反应、溶血试验等试验可以基本确立单增李斯特菌的检出,但根据Hly基因建立的PCR检出方法与传统鉴定方法结合起来,不失为鉴定单增李斯特菌提供了一种准确且特异的方法。无论何种的能力验证,为了能达到满意的结果,力求让鉴定手段尽可能多样化,可采用多种鉴定手段来检出目标菌。从这次的能力验证的结果报告中还统计了其他方法或快速方法,如MOLDI-TOF、PCR、Petrifilm(3M)、VIDAS等,通过多种方法进行初筛,或对现有方法进行优化,并结合先进的鉴定手段提高单增李斯特菌检测的准确性。
参考文献:
[1]贾俊涛,梁成珠,马维兴.食品微生物检测工作指南[M].北京:中国标准出版社,2012.
[2]孙静娟,曾海娟,丁承超,等.单核细胞增生李斯特菌检测技术研究进展[J].微生物学杂志,2017,37(4):120-125.
[3]舒鹃娟,张伟冲,袁 峰,等.食品微生物的检测能力验证[J].上海预防医学,2014,26(3):154-157.
[4]FAPAS. Food Microbiology Proficiency Test Report 224[R].London:Fera Science Ltd, 2017.
[5]谢曼曼,刘武康,丁承超,等.单核增生性李斯特菌hly缺失菌株的构建及生物特性的初步鉴定[J].食品科学,2017,38(16):17-22.
