源自嗜热菌的α-L-鼠李糖苷酶交联聚集体的制备及应用
2020-04-08许锦徐佳慧张小濛卢昌宁赵林果
许锦,徐佳慧,张小濛,卢昌宁,赵林果*
(1. 南京林业大学江苏省林业资源高效加工利用协同创新中心, 南京210037;2. 南京林业大学化学工程学院,南京210037)
α-L-鼠李糖苷酶(E. C. 3.2.1.40)是一种能特异性水解α-1, 2、α-1, 3、α-1, 4、α-1, 6和 α-1鼠李糖苷键的水解酶[1-2],广泛存在于植物、动物和微生物中[3]。α-L-鼠李糖苷酶作为一种重要的糖苷水解酶,可应用于橘汁类饮料的脱苦、葡萄酒的增香以及催化含鼠李糖基的天然产物以提高其生物活性[4]。在生物催化含鼠李糖基的天然产物中,高温α-L-鼠李糖苷酶的催化转化效率、反应体系的底物浓度明显高于常温α-L-鼠李糖苷酶[5-6]。由于游离酶不能重复利用,导致酶的使用成本较高,很大程度上限制了工业应用。另一方面,酶在实际应用过程中受反应体系的温度和pH的影响容易失活,继而影响了酶的催化效率。
酶的固定化是一种节约酶的使用成本的有效手段,其能使酶在工业应用中被重复利用,且在一定程度上能够提高酶的稳定性。常见固定化酶的方法有共价结合、吸附、交联和包埋等[7],也可分为载体固定化和无载体固定化[8-9]。其中,无载体固定化酶技术中的交联酶聚集体(cross-linked enzyme aggregates,CLEAs)技术应用较广,该法不需要载体,而且对酶的纯度要求低、操作简便、酶回收率高[10]。添加聚氧乙烯聚氧丙烯醚嵌段共聚物F127(Pluronic F127)制备交联酶聚集体是一种提高固定化酶稳定性和催化效率的有效方法,其可通过聚合物的疏水段与酶表面疏水区的相互作用提高酶的稳定性和活性[11-13]。因此,Pluronic F127可用于交联酶聚集体的制备。
笔者在前期研究中克隆表达了来源ThermotogapetrophilaDSM 13995的GH78家族的耐高温的α-L-鼠李糖苷酶(TpeRha),该酶能够有效催化多种黄酮类底物(淫羊藿苷、朝霍定C等),但该酶存在高温条件下稳定性较差、酶使用成本高等缺点。因此,笔者研究了添加共聚物Pluronic F127制备α-L-鼠李糖苷酶交酶聚集体的方法,并将固定化酶(PAG-R)应用于芦丁的转化,旨在将固定化酶和高温酶的优势有机结合起来,改善高温α-L-鼠李糖苷酶的酶学性质,提高酶的催化性能和重复利用率。研究结果为α-L-鼠李糖苷酶在含鼠李糖基的天然产物中的规模化应用提供技术支撑。
1 材料与方法
1.1 试验材料与试剂
嗜热菌T.petrophilaDSM 13995、克隆宿主菌株Escherichiacoli(E.coil) TOP 10F’、表达宿主菌株E.coilBL21(DE3) 、表达载体pET-28a均由本实验室保藏;Pluronic F127购自美国Sigma-Aldrich公司;戊二醛、硫酸铵、磷酸氢二钾、磷酸二氢钾购自国药集团(上海)化学试剂有限公司,均为国产分析纯;芦丁(纯度为97%)购自上海Aladdin化学试剂有限公司;异槲皮素标准品购自成都曼思特生物技术有限公司;酵母提取物、蛋白胨购自英国OXOID公司;麦芽糊精购自南京姜华化玻有限公司;Bradford蛋白含量检测试剂盒购自日本 TaKaRa公司。
1.2 主要仪器与设备
BS124S电子天平:北京Sartorius仪器系统有限公司;TOMY SX-500型全自动高压蒸汽灭菌器:日本TOMY公司;5417R小型高速冷冻离心机:德国 Eppendorf公司;HH-4型恒温水浴锅:常州国华电器有限公司;ZHWY-2102C 摇床:上海智城分析仪器制造有限公司;SpectraMax190酶标仪:美国分子仪器公司;Agilent 1260高效液相色谱仪:美国安捷伦科技有限公司。
1.3 试验方法
1.3.1 游离酶的制备
Terrific Broth(TB)培养基的配制:A液,1%(质量分数)麦芽糊精,1.2%(质量分数)蛋白胨,2.4%(质量分数)酵母提取物;B液,磷酸二氢钾2.3 g,磷酸氢二钾16.43 g溶于100 mL蒸馏水中,A液与B液体积比为9∶1。
将活化后的菌种[E.coilBL21(DE3)-pET-28a-TpeRha]转入TB培养基中培养至OD600为0.8左右,加入IPTG诱导剂诱导48 h后收集菌体、超声破碎、离心,上清液即为TpeRha粗酶液。将粗酶液超滤后得到浓缩粗酶液。
1.3.2 固定化酶的制备
将粗酶TpeRha与Pluronic F127按一定质量比加入到50 mmol/L pH 7.0的磷酸缓冲液中处理30 min,再加入硫酸铵沉淀30 min,最后加入40 mmol/L戊二醛交联3 h,6 000 r/min离心3 min得到的沉淀即为固定化酶。将固定化酶用pH 7.0的缓冲液反复清洗几次后加入pH 7.0的缓冲液中,置于4 ℃冰箱保存备用。
1.3.3 酶活力的测定
以对硝基苯酚-α-鼠李糖苷(pNPR)为底物,水解得到的pNP与碳酸钠发生显色反应,在405 nm 的波长下测定产物的吸光度。反应体系为: 75 μL柠檬酸-磷酸氢二钠缓冲液(50 mmol/L),20 μL底物,混匀预热后加入5 μL游离酶(或者固定化酶),在酶的最适温度和pH下反应5 min,以不加酶液的反应体系作空白对照。酶活力单位(U)定义:在酶的最适温度和pH下反应,每分钟水解相应底物pNPR释放1 μmol对硝基苯酚所需的酶量。对硝基苯酚(pNP)的标准曲线为y=2.376x+0.048,决定系数R2=0.999 0。
酶活计算公式如下:
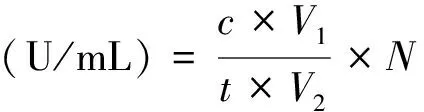
(1)
式中:c为对硝基苯酚含量,μmol/mL;V1为反应体系总体积,mL;t为反应时间,min;V2为酶液的体积,mL;N为酶液稀释倍数。
1.3.4 蛋白含量的测定
配置不同浓度的蛋白标准品,反应体系为200 μL Bradford溶液加入6 μL标准品,测定其在595 nm下的吸光度,以不含牛血清蛋白的吸光值为空白对照,根据所测吸光度值代入标准曲线中即可算得蛋白含量。蛋白含量测定的标准曲线为y=0.000 8x+0.008 1,决定系数R2=0.992 4。
1.3.5 固定化酶制备条件优化
以酶活回收率大小确定酶固定化的条件。
1)酶蛋白与Pluronic F127的质量比:将2 mg/mL的酶液置于pH 7.0缓冲体系中,加25 mg/mL的硫酸铵沉淀,分别按酶蛋白与Pluronic F127的质量比1∶0,1∶2,1∶4,1∶6,1∶8,1∶10加入相应量的Pluronic F127,处理30 min,最后加入40 mmol/L戊二醛交联3 h,探究酶蛋白与Pluronic F127的质量比对酶活回收率的影响。
2)硫酸铵浓度:将2 mg/mL的酶液置于pH 7.0缓冲体系中,分别加入25,50,75,100,150 mg/mL的硫酸铵沉淀,再加入质量比为1∶8的Pluronic F127处理,最后加入40 mmol/L戊二醛交联3 h,探究沉淀剂浓度对酶活回收率的影响。
3)戊二醛浓度:将2 mg/mL的酶液置于pH 7.0缓冲体系中,加75 mg/mL硫酸铵沉淀,再加入质量比为1∶8的Pluronic F127处理,最后加入30,40,60,90,120 mmol/L浓度戊二醛交联3 h,探究戊二醛浓度对酶活回收率的影响。
4)固定顺序:将酶分别按照以下步骤固定——①硫酸铵沉淀、戊二醛交联(CLEA);②硫酸铵沉淀、戊二醛交联、Pluronic F127处理(AS-GL-PL);③Pluronic F127处理、硫酸铵沉淀、戊二醛交联(PL-AS-GL);④硫酸铵沉淀、Pluronic F127处理、戊二醛交联(AS-PL-GL),其中硫酸铵浓度为75 mg/mL、酶蛋白与Pluronic F127的质量比为1∶8、戊二醛浓度为40 mmol/L。研究不同固定化顺序对酶活回收率的影响。
1.3.6 固定化酶的酶学性质
1)最适温度和最适pH:分别将固定化酶和游离酶置于60,65,70,75,80,85,90,95 ℃水浴中和pH为4.0,4.5,5.0,5.5,6.0,6.5,7.0,7.5,8.0缓冲溶液中测定酶活,并计算相对酶活,以最高酶活力为100%,确定最适温度和最适pH。
2)温度稳定性和pH稳定性:将固定化酶和游离酶置于60,65,70,75,80,85,90,95 ℃水浴中保温3 h后,在其最适温度和最适pH下测定剩余酶活力,探究其温度稳定性;将固定化酶和游离酶置于70 ℃和pH为4.0,4.5,5.0,5.5,6.0,6.5,7.0,7.5,8.0缓冲溶液保温3 h测定剩余酶活力,探究其pH稳定性。
3) 鼠李糖耐受性:在酶反应体系中加入5,10,15,20,25,50 mmol/L的鼠李糖,以不加鼠李糖的酶活力为对照,探究鼠李糖(即产物)对酶活力的影响。
4)动力学参数测定:将酶加入不同浓度的底物中反应5 min后测定其吸光度值,按照米氏动力学方程计算其Vmax、Km及kcat值。
1.3.7 HPLC分析
色谱柱为ZORBAX SB-Aq(填料颗粒直径5 μm;内径4.6 mm;长度250 mm)。HPLC检测条件为:柱温40 ℃;流速0.8 mL/min;进样量10 μL;检测波长369 nm;流动相为甲醇/0.1%(质量分数)甲酸水=40/60 (体积比);时间20 min。芦丁出峰时间为13.091 min,异槲皮素为 14.545 min。以不同浓度异槲皮素及相对应的色谱峰面积绘制标准曲线y=21 456x-245.42,决定系数R2=0.999 5。
1.3.8 PAG-R转化芦丁
1)温度和pH对转化的影响:以1 g/L芦丁为底物,10 U/mL的PAG-R,在65~95 ℃和pH 4.0~7.0缓冲液中反应30 min,液相检测产物异槲皮素浓度计算其产率,确定最适转化温度和pH。
2)加酶量对转化的影响:以1 g/L芦丁为底物,在转化最适温度和pH条件下,加入0.25~12.00 U/mL的PAG-R,反应30 min,液相检测确定最佳加酶量。
3)底物浓度与转化时间的关系:在转化最适温度、pH和加酶量的条件下,分别转化 3和 4 g/L底物,每隔30 min取样至反应240 min,探究底物浓度与转化时间的关系。
4)PAG-R与游离酶催化效果的比较:在相同转化条件下分别使用固定化酶和游离酶进行反应,根据异槲皮素产率比较其催化效果。
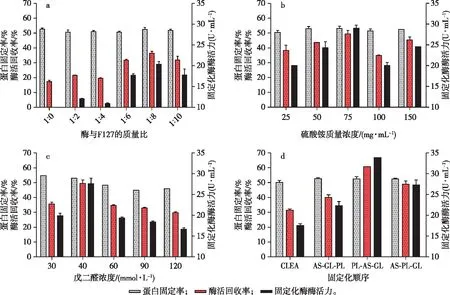
图1 固定化酶的条件对酶活力的影响Fig. 1 The effect of immobilized conditions on enzyme activity
5)重复使用次数:以一定底物,适量加酶量下反应时间90 min为一次转化反应,反应结束后离心回收固定化酶,将回收的固定化酶用缓冲液洗涤2~3次后继续反应,循环数次,确定其重复使用性能。
1.4 数据分析
固定化酶酶活回收率、相对酶活力、异槲皮素产率和相对转化率的计算公式如下:
固定化酶酶活回收率=
(2)
相对酶活力=
(3)
(4)

(5)
2 结果与分析
2.1 固定化酶的条件
2.1.1 酶蛋白与Pluronic F127的质量比
在固定化酶的过程中加入不同质量的Pluronic F127处理,对固定化酶的酶活回收率有很大的影响,结果如图1a所示。不加Pluronic F127处理的固定化酶酶活力为10 U/mL,酶活回收率仅为17.00%,而随着加入Pluronic F127质量的增加,固定化酶酶活力和酶活回收率会逐渐提高,在酶蛋白与Pluronic F127的质量比为1∶8时,固定化酶酶活力为20 U/mL,回收率达到36.52%;这是由于Pluronic F127的疏水段与酶表面疏水区的相互作用逐渐增强,酶的稳定性逐渐提高[14];但当达到一定程度后,相互作用力过大会影响酶的结构的稳定,从而使其酶活降低。因此,最佳酶蛋白与Pluronic F127的质量比为1∶8。
2.1.2 硫酸铵质量浓度
加入沉淀剂的作用是改变溶液的静电参数,破坏酶蛋白分子内的非共价键,使其空间结构变形,从而聚集形成沉淀[15-16]。在一定浓度内,随着沉淀剂的浓度越高,酶蛋白沉淀越快,其空间结构改变一定程度上会较小,从而对其酶活性中心的破坏越小;当浓度过高时,会导致酶空间结构包括活性中心变形,影响其酶活力[17],这与图1b结果符合。因此,最佳硫酸铵质量浓度为75 mg/mL。
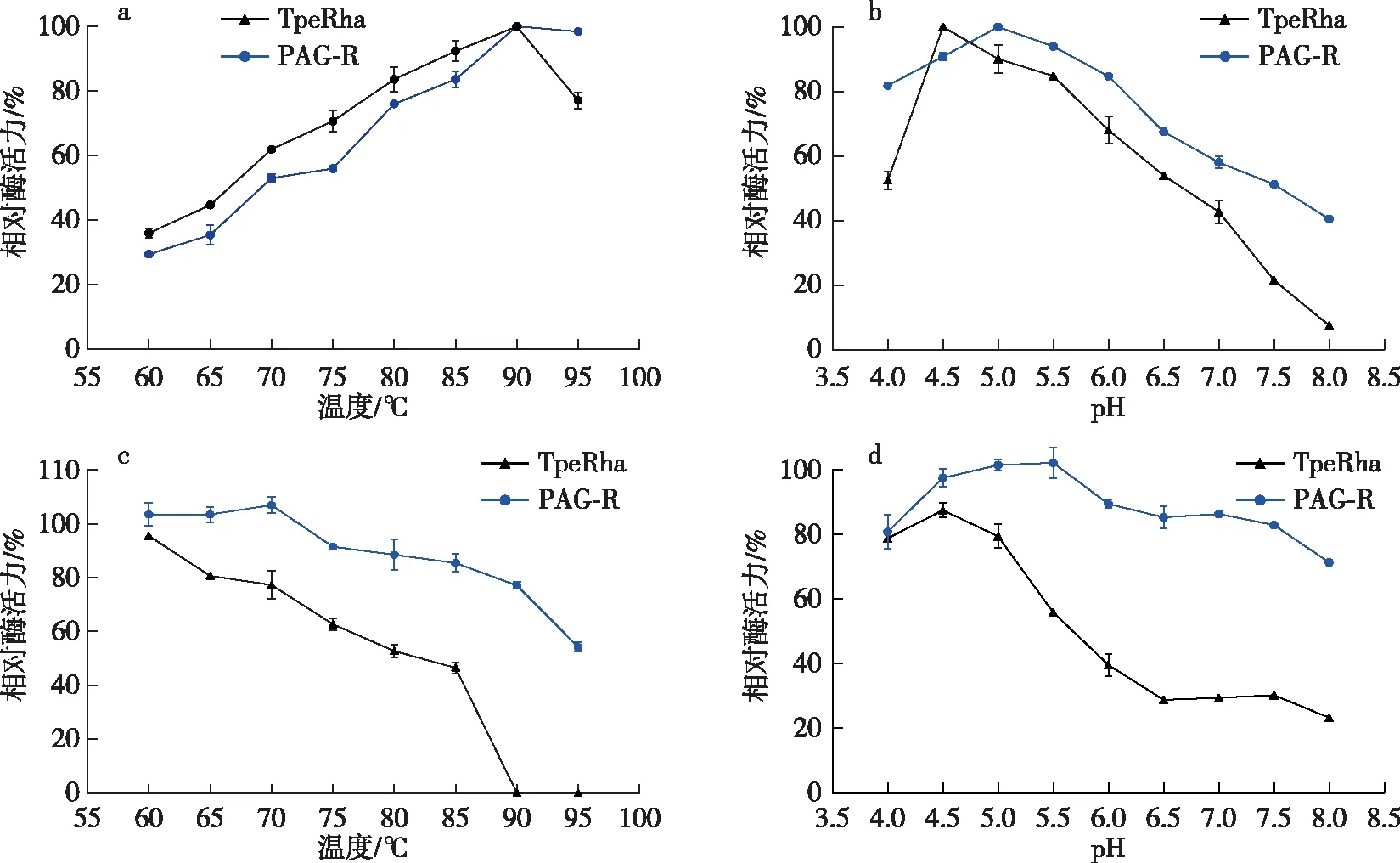
a. 最适温度; b. 最适pH; c. 温度稳定性; d. pH稳定性。图2 游离酶和固定化酶的酶学性质Fig. 2 Enzymatic properties of free and immobilized enzymes
2.1.3 戊二醛浓度
(4)综合性实验、实训教学的应用与管理。将一系列单一项目按其内在关系有机结合在一起进行的综合性实验、实训教学,是培养和提升学生综合素质和综合能力的主要途径和必然选择,应予以广泛倡导与运用。
在无载体的固定化酶-交联酶聚集体制备过程中,戊二醛两端的醛基官能团能够与酶蛋白上的多种官能团共价结合,并形成聚集体。当戊二醛的浓度过小时,交联不充分导致部分酶蛋白脱落,暴露在环境中容易失活;而戊二醛的浓度过高时,会导致酶蛋白活性中心构象改变而失活[18]。因此,最佳戊二醛的浓度如图1c所示,为40 mmol/L。
2.1.4 固定顺序
探究了试剂处理顺序对固定化酶的影响,结果如图1d所示。常用的交联酶聚集体——CLEA的制备顺序所制备的固定化酶的酶活回收率为30.85%,而先加入Pluronic F127对酶蛋白进行处理,所制备的固定化酶的酶活回收率为60.90%,是前者的1.97倍,此时固定化酶酶活力可达到34 U/mL。这可能是由于Pluronic F127的疏水片段与酶的疏水片段相互作用,保证了酶蛋白在沉淀剂沉淀作用下的酶活损失少。
2.2 PAG-R的酶学性质
2.2.1 最适温度和最适pH
固定化酶的最适温度及最适pH如图2a、b所示。PAG-R的最适温度为90 ℃、最适pH为5.0,较游离酶差别不大。PAG-R的反应温度和pH范围较游离酶均有所扩宽,在其他不同温度和pH条件下,PAG-R的相对酶活亦明显高于游离酶。
2.2.2 温度稳定性和pH稳定性
PAG-R、TpeRha的温度稳定性和pH稳定性如图2c、d所示。在不同温度保温3 h后,PAG-R和TpeRha的相对酶活力相差很大,TpeRha在90,95 ℃保温后,酶活力完全丧失,而PAG-R的相对酶活仍有77.13%和54.12%,说明固定化后酶的热稳定性显著提高。另一方面,PAG-R在pH6.0~8.0条件下、70 ℃保温3 h,PAG-R的相对酶活仍保持在72.41%以上,是TpeRha的3倍左右。说明固定化后不仅酶的热稳定性显著提高,酶的pH稳定性也得到了极大的改善,可能是由于固定化酶具有更加稳定的空间立体结构,酶蛋白耐受热变性的能力提高[19]。
2.2.3 鼠李糖耐受性
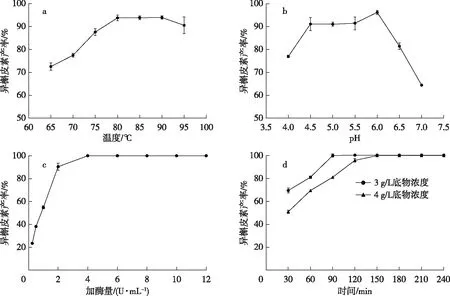
a. 最适温度; b. 最适pH; c. 加酶量优化; d. 底物浓度与转化时间关系。图4 PAG-R催化芦丁转化的最适条件Fig. 4 The optimum conditions of rutin conversion catalyzed by PAG-R
α-L-鼠李糖苷酶在底物的水解过程中,通常被水解产物所抑制。固定化酶技术有望能改善其糖耐受性。在相同条件下分别研究游离酶和固定化酶对鼠李糖的耐受性,结果如图3所示。TpeRha随着鼠李糖浓度逐渐升高,相对酶活下降非常迅速,鼠李糖浓度为5 mmol/L时,其相对酶活仅为29.21%,说明TpeRha对鼠李糖极不耐受,导致其在实际应用中催化效果不佳。而PAG-R在相同鼠李糖浓度下,相对酶活为65.50%,比游离酶高36.29%,有效提高了该酶的鼠李糖的耐受性。分析原因可能是固定化后,酶蛋白的空间结构发生改变,鼠李糖苷酶的催化通道内,与鼠李糖结合的非催化位点变多,降低了其与催化活性位点结合的几率,从而提高了鼠李糖苷酶的糖耐受性,这与Yoshida等[20-21]研究的葡萄糖苷酶的葡萄糖耐受性结果相似。
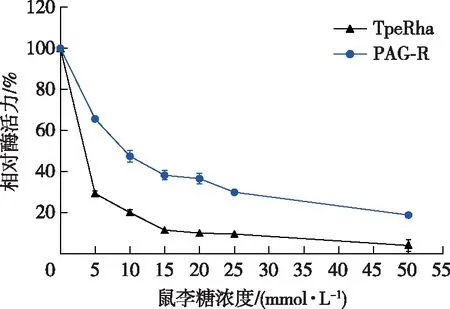
图3 游离酶和固定化酶的鼠李糖耐受性Fig. 3 Tolerance of rhamnose for free and immobilized enzymes
2.2.4 动力学参数测定
根据米氏方程计算得出TpeRha 和 PAG-R的动力学参数,结果如表1所示。由表1可见,PAG-R和TpeRha的Vmax值相近,Km值分别为5.77和4.66 mmol/L,这与Wu等[22]发现的多形拟杆菌来源的鼠李糖苷酶BtRha的Km值相近,且固定化酶对底物pNPR的亲和力略大于游离酶。

表1 TpeRha 和 PAG-R的动力学参数Table 1 Kinetic parameters of TpeRha and PAG-R
2.3 PAG-R催化芦丁转化的应用
2.3.1 最适温度和最适pH
PAG-R催化芦丁转化生成异槲皮素过程中,温度在65~80 ℃时,随温度的升高异槲皮素产率逐渐提高(图4a),80~90 ℃时达到平衡,PAG-R在此温度下的催化效果相同,但在95 ℃产率有所下降,可能是由于95 ℃时酶活力有所下降导致。根据 PAG-R的温度和pH稳定性检测结果,选择80 ℃为转化最适温度,pH 6.0为转化的最适pH(图4b)。
2.3.2 加酶量优化
加酶量对异槲皮素产率的影响结果如图4c所示。转化率随酶量的增加而逐渐升高,加酶量为4~12 U/mL 时产率均达到100%。结合用酶成本,选择4 U/mL为转化时的最佳加酶量。
2.3.3 底物浓度与转化时间的关系
以4 U/mL的酶量分别转化3和4 g/L的底物,转化随时间的变化如图4d所示。由图4d 可见,3 g/L的底物在90 min时异槲皮素产率到100%,4 g/L的底物在120 min时异槲皮素产率到95.88%。结合图4c,1 g/L的底物在30 min时异槲皮素产率达到100%,说明PAG-R催化芦丁转化的能力在一定底物浓度范围不受底物和产物的影响,也与鼠李糖耐受性的研究结果相符合。
2.3.4 PAG-R与游离酶催化效果的比较
分别以4 U/mL的PAG-R 和游离酶TpeRha转化3 g/L的芦丁,结果如图5所示。PAG-R和TpeRha催化芦丁的转化量均随着时间的延长而逐渐增加,但在相同的反应时间内,PAG-R催化芦丁生成异槲皮素的产率显著高于TpeRha。转化90 min时,PAG-R生成异槲皮素的产率100%, TpeRha的异槲皮素产率43.36%,PAG-R催化异槲皮素的生成量是TpeRha的2.31倍。这是由于PAG-R 在80 ℃和pH 6.0条件下的稳定性较游离酶TpeRha高很多,综合图2c、d可知,固定化后的PAG-TpeRha在80 ℃和pH 6.0条件下保温3 h后,剩余酶活力均达到85%以上,而游离酶TpeRha在80 ℃和pH 6.0条件下极不稳定,这是导致两者催化效果差距大的主要原因。另一方面,随着催化反应的进行,反应体系中的产物鼠李糖的含量不断增加,游离酶的产物反馈抑制作用比PAG-R更严重,导致其催化活力下降。
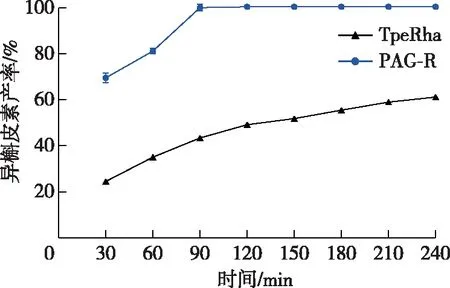
图5 PAG-R与游离酶催化效果的比较Fig. 5 Comparison of catalytic effects of PAG-R and free enzymes
2.3.5 重复使用次数
游离酶的不可重复使用性是限制其在工业应用的最重要因素之一,利用固定化酶技术提高酶的重复利用率是减少酶使用成本的重要途径。以4 U/mL PAG-R、3 g/L芦丁反应90 min为一个循环,重复反应10次后,相对转化率保持在60%以上(图6),这有利于嗜热α-L-鼠李糖苷酶的工业应用。
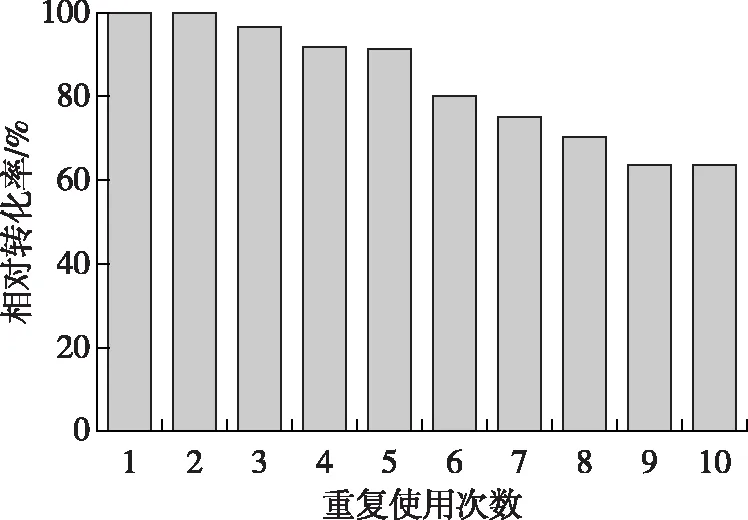
图6 PAG-R的重复使用次数Fig. 6 Reusability of PAG-R
3 结 论
1)固定化酶(PAG-R)制备适宜条件为:酶蛋白与Pluronic F127质量比为1∶ 8、沉淀剂硫酸铵质量浓度为75 mg/mL、戊二醛浓度为40 mmol/L、固定顺序为Pluronic F127-硫酸铵-戊二醛;酶活回收率最高达到60.90%,酶活力为34 U/mL。
2)固定化酶的最适温度和pH与游离酶相近,反应温度和pH范围较游离酶均有所扩宽;固定化后酶的温度稳定性、pH稳定性和鼠李糖耐受性均显著提高。
3)固定化酶(PAG-R)转化芦丁的最适条件为:80 ℃、pH 6.0、加酶量4 U/mL;在相同条件下转化芦丁,PAG-R催化异槲皮素的生成量是TpeRha的2.31倍;且重复使用10次后,相对转化率仍达到60%以上。研究结果为来自嗜热菌T.petrophilaDSM 13995耐高温GH78家族的α-L-鼠李糖苷酶应用于催化淫羊藿苷、朝霍定C等溶解性差的黄酮化合物转化提供了技术支持。
