固体脂质纳米载体促进药物吸收的研究进展
2020-04-08刘宇达谢书宇
刘宇达,谢书宇
(华中农业大学国家兽药残留基准实验室(HZAU),国家兽药安全评价实验室(HZAU),农业部畜禽产品质量安全风险评估实验室,武汉 430070)
药物的吸收和生物利用度会受到药物性质、溶出率、酶、pH环境、给药途径、肝首过效应等各种因素的影响,严重限制了其临床上的应用。比如,不溶性药物往往在胃肠道消化液中存在溶出速度慢、溶解性差和吸收不完全等问题,以致影响疗效发挥。研究发现,包合物、混悬剂、微球、纳米晶体等制剂技术可以提高不溶性药物的溶解性和生物利用度。然而,这些方法仍然存在一些问题:每种制剂只适合特定的物理和化学性质的药物,比如必须可溶于某些有机溶剂;包合物技术要求药物具有适当的分子大小;微球提高生物利用度的效果不明显。因此,提升不溶性药物的生物利用度一直是药学研究的热点和难点。固体脂质纳米粒(SLN)是一种新型药物载体,具有释放药物时间长、毒性低、细胞吸收能力优于传统胶体载体等特性,在促进药物吸收方面具有显著的优势[1]。它被认为是纳米乳、脂质体、高分子纳米颗粒、纳米悬浮液等传统胶体体系的替代药物载体体系[2]。药物可以浸没、溶解、或包裹在纳米级生理相容聚合物,如固体脂质基质骨架(磷脂、三酰基甘油、长链脂肪酸、胆固醇和蜂蜡等)和凝胶材料中[3]。这些高分散性和具有表面活性的材料能够较大地改善不溶性药物的溶解性,提高药物的渗透性和缓释性能。此外,固体脂质纳米载体可以防止药物破坏胃肠道的酸和酶,减少药物对胃肠道的刺激,能够以整体的形式被肠壁细胞吸收。这些独特的性质有利于载荷药物的有效吸收,避免了不溶性药物溶解率低对吸收的影响。本文将从作用、影响其促吸收的因素和促吸收的机制方面综述固体脂质纳米的现状以及仍面临的问题。
1 固体脂质纳米载体的组成
固体脂质纳米载体一般由具有可降解性和生物相容性的成分制备而成[4],主要成分包括脂质、表面活性剂、主体药物和防腐剂、冷冻保护剂、修饰性成分等辅料,其中脂质和表面活性剂是关键成分[5]。区别于由低熔点的磷脂和液态油组成的脂质体和乳状液,固体脂质纳米载体中的基质为高熔点的固体脂质[2],比如蜂蜡、硬脂酸、胆固醇、甘油三酯、棕榈酸、硬脂酸甘油酯、月桂酸、苯甲酸、山嵛酸、石蜡等[2]。在固体脂质纳米载体的制备中,需要加入的表面活性剂一般起稳定性和包裹作用,Aldema等列举出了一些常用表面活性剂,如聚山梨醇酯20(60、80)和吐温20(60、80)、泊洛沙姆188(407、182)、十二烷基硫酸钠、胆酸钠、乙醇酸钠、西曲溴铵、聚乙二醇、PVP、PVA等[6]。在Ana等的研究中,主要是使用Witepsol©E85、硬脂酸和Compritol©888 ATO,采用改进的溶剂乳化蒸发法制备固体脂质纳米药物[7]。在某些研究中,也有对固体脂质纳米载体进行表面修饰,如加入聚乙二醇、壳聚糖、甘露糖等,以达到提高靶向性、提高吸收率等作用[7-9]。

表1 固体脂质纳米载体的主要成分及常用试剂
2 固体脂质纳米载体的作用
2.1 促进体内吸收 固体脂质纳米载体可以促进药物吸收,提高生物利用度。已知脂质可以制备出低粒径的药物,可以增强药物的吸收[10]。低粒径的固体脂质纳米粒通过维持药物在胃肠道中的较高溶解状态,促进内源性分泌胆汁盐和磷脂共同形成混合胶束[11],这种特性在促进药物胃肠吸收方面有着重要作用。例如,分别以槲皮素-固体脂质纳米载体和槲皮素混悬液的形式给药(50mg/kg)后,在大鼠体内对槲皮素进行药代动力学研究。与槲皮素混悬液相比,槲皮素固体脂质纳米的生物利用度提高了571.4%[12]。在雄性大鼠体内进行了不同配方的长春西汀体内吸收研究结果表明,长春西汀固体脂质纳米的相对生物利用度较长春西汀溶液明显提高[13]。Muller RH等的研究表明,环孢霉素A的固体脂质纳米制剂比市售的环孢霉素A微乳制剂和纳米晶体的生物利用度更好,并且克服了不同受试者之间的生物利用度差异性问题[14]。Ramalingam等研究了多种姜黄素制剂向大脑递送的生物利用度,结果表明固体脂质纳米载体负载的姜黄素有更高的生物利用度,他们还发现,固体脂质纳米载体可以使白藜芦醇的生物利用度比白藜芦醇混悬液高3.8倍[9]。
在淋巴药物运输研究中,与添加甲基纤维素0.5%(W/V)的药物混悬液相比,通过固体脂质纳米载体运输到淋巴中的洛匹那伟的累积百分数明显增加了4.91倍[10]。在另一项研究中,使用N-羧甲基壳聚糖修饰的姜黄素固体脂质纳米药物使姜黄素在淋巴细胞中的生物利用度更高,经淋巴细胞摄取途径比姜黄素混悬液口服途径的生物利用度高了6.3倍,经口服途径比姜黄素混悬液生物利用度高了9.5倍[11]。
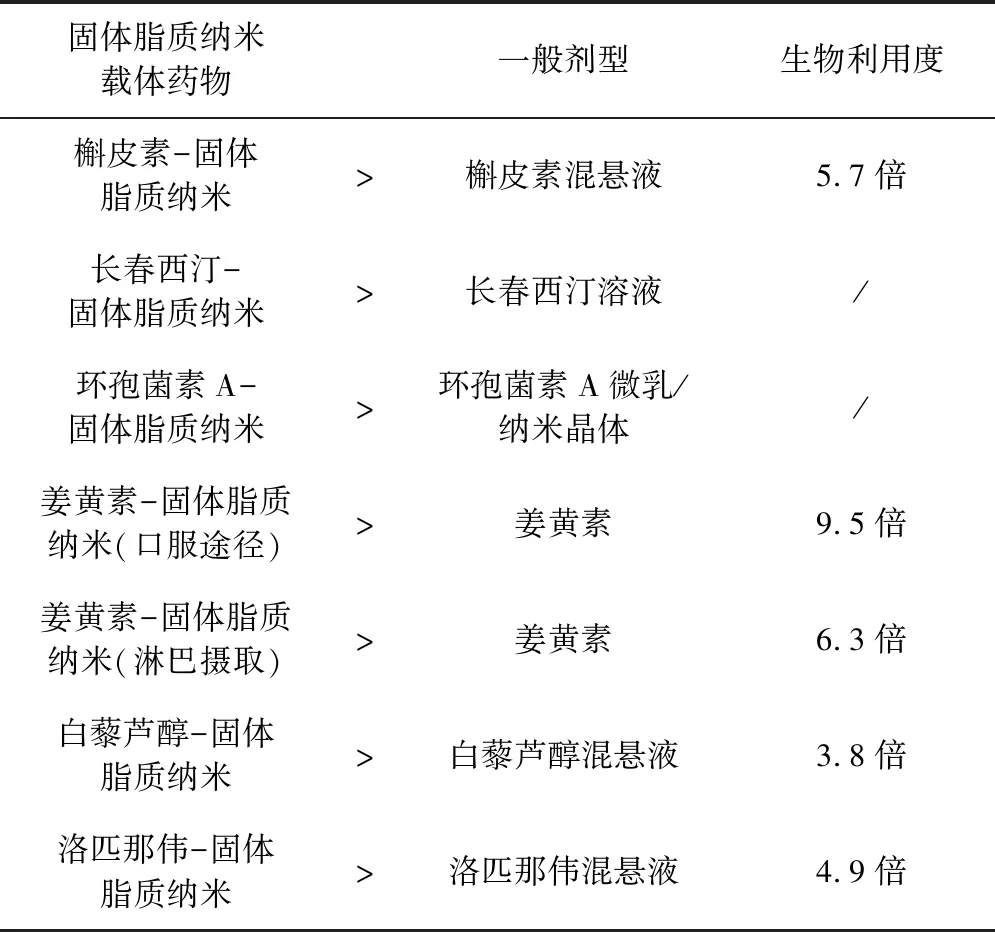
表2 固体脂质纳米载体促进药物吸收的效果
2.2 提高药物稳定性 固体脂质纳米载体可以提高药物的稳定性。固体脂质纳米可以作为一种笼状结构避免了药物与外界环境的直接接触,以免不稳定的药物被胃酸降解,因此提高了药物的稳定性。固体脂质纳米载体也能够通过避免蛋白酶水解作用,显著提高所搭载的siRNA、多肽和蛋白质的稳定性,并使它们持续释放[5]。如抗疟药物蒿乙醚内过氧化物环,在胃酸介质中易降解的性质限制了它的使用,而研究表明它的降解可以通过使用固体脂质纳米载体来避免,从而保持药物的活性[18]。柴桂宏等用单硬脂酸甘油酯为基底制备了固体脂质纳米粒,用十八胺-异硫氰基荧光素标记和纳米粒包裹药物。透射电镜分析结果表明粒径均匀,且在一周贮存期内质量没有发生明显变化,说明固体脂质纳米药物的稳定性良好。对制备的固体脂质纳米粒进行毒理学研究,结果表明,固体脂质纳米粒对细胞的毒性较低,不会引起细胞的氧化应激反应,也不会破坏细胞膜的完整性[4]。
有研究表明,在贮存过程中,固体脂质纳米载体的脂质会逐渐变得更加稳定[19]。Sacheen Kuma等以甘油三酯作为基底制备了固体脂质纳米粒,已知在甘油三酯中存在α、β晶体修饰,如果在固体脂质纳米粒的生产过程中发生快速冷却,脂质将结晶成不稳定的α修饰,在储存时则会逐渐变为更稳定的β修饰。需要注意的是,加入电解质会导致制剂的不稳定,随着电解质浓度的增加和阳离子价数的增加,稳定性会明显下降,以部分电解质为例,去稳定性强弱为Al3+>Ca2+>Na+[20]。因此在固体脂质纳米药物的制备中应尽量避免加入过多的电解质。
2.3 降低耐药性 固体脂质纳米载体有助于抑制或消除微生物的生物膜耐药性。微生物引起的疾病的严重程度和慢性感染的发展与微生物形成生物膜的能力有关,而生物膜这些复杂结构对目前临床使用的药物或许会具有耐药性,因此研究具有低耐药性和靶向抗生物膜的新药物载体势在必行。固体脂质纳米载体为药物靶向治疗由耐药生物膜引起的微生物感染提供了安全的平台[21]。如Nafee等制备了固体脂质纳米药物,旨在通过消除微生物的生物膜优化药物在肺囊性纤维化患者肺组织的靶向递送,抑制肺部炎症发展,结果表明,制备的固体脂质纳米药物对铜绿假单胞菌的生长有明显抑制作用[22]。Taylor等合成了由唾液酸(SA)、月桂酸(LA)和油酸(OA)组成的固体脂质纳米粒,能够阻碍生物膜的形成,从而减少组织和表面的细菌粘附,LA和OA的抗菌作用也促进了细菌细胞膜的破坏[23]。Zhe Chen等的研究表明,固体脂质纳米载体可以使吉西他滨这种抗癌药克服肿瘤细胞对吉西他滨的耐药性,为抗癌化疗药物的有效使用提供了新思路[24]。
3 影响固体脂质纳米药物吸收的因素
3.1 粒径 粒径大小对于固体脂质纳米载体药物的释放速度、生物分布、黏附性、被细胞的摄取和扩散有重要影响,且由于固体脂质纳米载体具有较大的比表面积,纳米粒的尺寸问题对其搭载的药物稳定性更加重要[25]。已经证明,随着粒径的减小,药物对胃肠道的附着力也会随之增加[26]。Sigfridsson等的研究进一步表明,粒径的减小能促进难溶性药物的口服吸收,证明了固体脂质纳米载体在胃肠道中的促吸收作用存在粒径依赖性[27]。同时发现,粒径的大小还会影响所载药物的释放性能,从而影响药物的吸收。有研究将150 nm大小的水飞蓟素固体脂质纳米粒分别与500 nm和1000 nm大小的水飞蓟素固体脂质纳米粒进行口服给药后吸收率比较,结果吸收率AUC(曲线下面积)分别提高了2.08倍和2.54倍,表明减小粒径可以明显提高生物利用度[28]。
3.2 给药途径 一般来说,药物载体会从离目标器官较远的组织进入,通过血液循环运输到目标位置,因此药物吸收的效率取决于给药途径和给药部位的生理条件。静脉给药时,药物通过皮下途径直接进入肌肉,绕过上皮层,可以很容易通过内皮间隙被毛细血管吸收,迅速到达作用部位。局部给药时,药物可以直接应用于目标部位(非深部组织),吸收也较为迅速[29]。但在口服给药时,由于在胃肠道中,药物最初必须通过一层致密的上皮细胞,且pH值、酶、离子强度、摄入的食物、吸收窗口、停留时间、溶解度和溶解速度等因素也会影响药物的释放和吸收[30],因此口服给药药物吸收困难较大。
固体脂质纳米载体可以在一定程度上解决口服途径药物吸收的差异性问题。已知脂质可以增强口服药物的吸收,并且可以制备出低粒径的药物载体,所以利用脂质作为赋形剂的药物载体系统很有前途[10],比如在大鼠的体内药代动力学研究中,口服槲皮素固体脂质纳米载体药物相比槲皮素混悬液的口服生物利用度可提高574.1%[12]。
固体脂质纳米载体也可以通过吸入的方式给药,能够直达肺部上皮细胞,以治疗局部肺部疾病,并且由于其比表面积大而肺部上皮薄,可以使药物绕过一级代谢被快速吸收转运到达全身。同时固体脂质纳米药物可以在肺部沉积,由于体积小、毒性低,释放时间长,可以更好地避免对组织的刺激,有效提高生物利用度[31]。另外支气管内黏液的粘附性对药物的局部控制释放也具有重要作用[2]。有研究制备了紫杉醇固体脂质纳米,结果表明固体脂质纳米可以作为良好载体通过吸入方式将紫杉醇输送至肺部,并且可以实现靶向给药,避免了药物在非靶标区域的积聚,从而提高治疗效果并降低毒性[32]。但肺部给药需要制成具有生物相容性、无菌性、等渗性和中性pH的雾化制剂[33]。
综合来看,固体脂质纳米药物在不同给药方式下对深部组织的生物利用度为静脉注射>口服>吸入>局部涂抹。
3.3 表面性质 不同的药物和脂质材料制备的固体脂质纳米药物的表面性质存在显著差异,这对药物的生物利用度有较大影响。采用不同材料和结构,或使用不同长度碳链的脂质材料,或者对纳米粒表面使用不同含量的聚乙二醇进行修饰,对固体脂质纳米粒的转运的影响有着差异性。Huang等的研究表明,经适当量聚乙二醇表面修饰的纳米载体可以降低药物的突释效应,提高药物的生物利用度[8]。又如脂质材料的碳链长度缩短,或者一定量的聚乙二醇修饰(PEG-20%)可以增加纳米粒被摄取进入细胞单层和跨膜转运的量[4]。使用壳聚糖等生物粘附聚合物对纳米载体进行修饰,可以提升药物在胃肠道中的生物粘附性,增大和延长与胃肠道的接触面积和停留时间,从而提高吸收率和生物利用度。El-Shabouri等分别以壳聚糖或盐酸明胶为载体,制备的表面正环孢素A(CsA)纳米颗粒比传统的CsA微乳液口服生物利用度分别提高了73%和18%[9]。可见使用的脂质的结构和表面性质不同,对固体脂质纳米载体的促吸收作用有着重要影响。
另有研究利用甘露糖受体可在肺泡巨噬细胞上高度表达的特性,采用双乳化技术制备了搭载异烟肼(lsn)的固体脂质纳米粒,并用甘露糖对其进行进一步表面官能化,然后对同种巨噬细胞进行摄取研究,结果表明,这种固体脂质纳米载体有更高的内化效率,可以为肺泡巨噬细胞搭载抗感染药物提供有效帮助[7]。
3.4 药物释放环境 不同载体材料和药物类型在不同pH环境下的性能是不同的。Yang F等发现,给药环境的有机弱酸或弱碱的pH值对吸收的影响尤为明显,固体脂质纳米载体聚合物的总体相对分子质量越小,pH值越低,对药物吸收的影响越大。此外,由于消化道不同部位分泌物的含量不同,也会影响药物吸收[34]。
4 固体脂质纳米载体促进药物吸收的机制
4.1 增溶作用 在胃肠溶液中,不溶性药物的溶解度受到药物的固有溶解度和内、外源性物质对药物的增溶作用等方面的影响。固体脂质纳米载体的辅料主要是脂质,而药物在体内的吸收与脂质的性质密切相关。小肠绒毛的表面存在着一层静态水层,不溶性药物必须在穿过该静态水层时经过溶解、扩散,然后与小肠上皮细胞接触,才能够被吸收。但不溶性药物在静态水层中的溶解度很低,阻碍了药物的吸收。
固体脂质纳米载体中的脂质成分在消化酶作用下会降解,然后与胆盐等分泌物相互作用,形成胶束或混合胶束,药物包裹在其中,由此在静态水层中的溶解度得到提高。如口服给药后,脂质体在消化道经脂肪酶分解成具有表面活性的甘油单酯和甘油二酯等乳化剂,随着脂质体进入十二指肠,刺激内源性胆酸盐、胆固醇以及胰液等从胆囊分泌并排入肠腔[35]。经过一系列反应和相互作用,在胃肠道中形成各种胶体分散体系,如混合胶束、小囊泡以及乳滴等,同时不溶性药物也浸没、包裹在其中,从而溶解度能够提高,促进了药物的吸收[2]。
4.2 增加附着性 固体脂质纳米载体粒径微小,具有易附着性[36],可以增强药物在胃肠道黏膜上的吸附作用,使大量的药物可以积累在胃肠道黏膜上,延长滞留时间,减少损失。随后,药物经释放后就可以随即被胃肠壁吸收,减少药物的损失,胃肠壁与血药浓度形成浓度梯度从而促进药物的吸收和转运,提高药物的生物利用度。柴桂荣等的研究表明,小肠上皮细胞单层对固体脂质纳米粒的摄取过程,首先就是固体脂质纳米粒黏附于细胞膜上,并显著降低细胞膜流动性[4]。固体脂质纳米载体的附着性被认为是提高生物利用度和靶向性的主要因素[2]。
4.3 优化各转运吸收途径
4.3.1 淋巴转运 脂质能够优化药物在肠淋巴的转运。有研究采用热自乳化法制备了洛匹那伟的固体脂质纳米微球,由于肠淋巴的高效吸收,明显提高了其生物利用度[37]。以口服给药为例,在胃肠内含药粗乳经过一系列的相互作用和消化,最终变为含药混合胶束,可以通过自由扩散穿过静态水层。混合胶束很少以完整的形式吸收,而是会分别以2-甘油单酯、游离脂肪酸和游离药物的形式各自吸收。脂质中的长链脂肪酸将先后在滑面内质网和糙面内质网内,先重新酯化形成甘油三酯,然后再和产生的初始脂蛋白结合,变成乳糜微粒,药物同时与乳糜微粒中的三酰甘油结合[38],由于形成的乳糜微粒聚合物粒径一般仅有200~800 nm,而肠上皮毛细淋巴管细胞间隙孔径较大,就可以顺利进入到毛细淋巴管之中,即药物可以从淋巴转运进入体循环,避免肝首过效应。淋巴外分流实验表明,被吸收的固体脂质纳米药物有约77%会通过淋巴进入体循环,说明淋巴转运是固体脂质纳米药物的主要转运途径。其余23%可能通过细胞旁途径或毛细血管被肠道上皮细胞吸收,进入血液循环[2]。此外,固体脂质纳米药物经口服后,主要被回肠内集合淋巴结吸收,纳米粒被微粒细胞吞噬,以囊泡的形式转运到M细胞基底面凹腔,被释放后会以游离状态或以被巨噬细胞吞噬的状态,随着淋巴细胞通过淋巴管,从淋巴循环进入血液循环,这个过程也可以避免肝首过效应。
4.3.2 囊泡介导转运 固体脂质纳米搭载药物可以通过囊泡内吞的方式被摄取进入细胞。柴桂宏等以单硬脂酸甘油酯为材料,制备了固体脂质纳米粒,并通过体外构建小肠上皮细胞单层,进行了转运机制研究。结果表明,20%的固体脂质纳米粒被摄取进入细胞单层,其中的2.5%以完整的形态完成了跨膜转运。透射电镜结果显示,固体脂质纳米粒被小肠上皮单层细胞摄取的方式是依靠细胞膜流动性的胞吞作用,而跨膜转运是以脂筏结构和网格蛋白结构作主要介导、肌动蛋白微丝辅助的过程。在该过程中,内质网、高尔基体和微管蛋白等都起着重要作用,说明转运方式是依赖能量的主动转运[4]。
小肠上皮单层细胞对固体脂质纳米药物的摄取也是时间依赖过程,显微镜下,在4 h内小肠上皮细胞内的荧光信号不断增强,而4 h后荧光信号没有明显的增多,说明摄取过程达到了饱和。
4.3.3 可以透皮吸收 透皮途径具有使用方便、可以避免肝首过效应和胃肠道消化分解等优势。然而,皮肤的低渗透性是药物吸收的主要障碍。皮肤由真皮和表皮组成,表皮最上层为角质层,结构较为复杂,因此一般药物无法轻易透过皮肤被吸收。研究表明,纳米级尺寸使固体脂质纳米药物和角质层紧密接触,使被包裹的药物更加容易透过皮肤并累积,然后被全身微循环吸收[2]。这属于被动吸收的过程,而不是主动运输。另外,由于固体脂质纳米在皮肤表面形成了极薄的涂层,可以减少表面的水分流失,延长作用时间,同时增大表皮孔径,提高药物的渗透性[39]。
有研究用吐温-80和大豆卵磷脂作表面活性剂,制备了鬼臼毒素的固体脂质纳米药物。鬼臼毒素-固体脂质纳米透过皮肤的途径有两条,一是穿过角质层,二是通过毛囊。体外渗透研究表明,鬼臼毒素-固体脂质纳米可使猪皮肤中鬼臼毒素的累积量增加3.48倍[40]。在另一项大鼠体外透皮研究中,分别涂抹喷昔洛韦固体脂质纳米药物和市售喷昔洛韦外用药膏,12 h后,喷昔洛韦固体脂质纳米药物所渗透的喷昔洛韦浓度是市售外用药膏的2倍以上[41]。
4.3.4 减少药物在非作用区域的积累 一般情况下,药物随着血液循环扩散、分布到体内各个组织、细胞和组织液中。然而,大多数药物不能均匀地分布到全身,其中一些将局限于血浆或细胞间。固体脂质纳米可以通过减少药物分子在非作用区域的积累,从而促进药物的吸收。与树突状大分子、胶束、高分子纳米颗粒等纳米药物载体类似,固体脂质纳米在某些组织或器官中也有特定的积累[42]。例如,在静脉注射固体脂质纳米药物后,主要分布于肝脏(占注射剂量的60~90%)、脾脏(2~10%)、肺(3~20%以上)和骨髓(1%),这种在网状内皮系统器官的积累将严重限制固体脂质纳米药物对应作用区域的靶向作用。针对这种现象,可以通过减小粒径和加入表面活性剂,避免药物在非作用区域的大量积聚和过早清除[43]。
比如针对血脑屏障,据观察,较大的亲脂分子只能通过被动扩散进入大脑,因此传统的药物输送系统通常不能有效地将药物输送到大脑。在各种载体系统中,固体脂质纳米在脑内的靶向递送方面非常有前途[44]。一项生物分布研究表明,在鼻内使用链霉素固体脂质纳米药物后,与单纯使用链霉素相比,在小鼠的大脑组织和血液中链霉素的浓度分别高了3.15倍和11倍,在肝脏和脾脏这种易累积药物的器官中链霉素浓度分别降低了12倍和4倍[45],证明鼻内给药固体脂质纳米载体药物后药物在非作用区域的积累量下降,同时更多的积累于应作用区域。随着固体脂质纳米载体的不断研究,目前已经有基于抗体、热磁性、pH敏感性和阳离子等不同方法的固体脂质纳米靶向载体制备思路[46]。
除了不同碳链长度的脂质材料、表面活性剂和壳聚糖等影响因素,蛋白质结合被认为是影响纳米颗粒或药物分布的最重要的因素之一。在纳米颗粒蛋白结合的背景下,颗粒形态、大小、表面积等微观结构特性对单链蛋白结合能力有重要影响。蛋白质结合后的微观结构、表面积等性质可能发生变化,这些变化可能会影响蛋白结合纳米颗粒进入巨噬细胞的吸收过程,最终影响其生物分布[2]。

表3 链霉素固体脂质纳米相较于链霉素在各组织中的积累量变化
5 结 语
综合国内外研究,固体脂质纳米载体促进药物吸收的多种机制具有一定的创新性,不易被传统的吸收机制和给药途径限制,极大的避免了药物的损耗,优化了药物的利用率,具有良好的开发前景。但是,固体脂质纳米载体促进药物吸收作用的发挥将会受到自身材料性质和吸收过程中多种因素的影响[9],目前的研究中使用的材料和制备方法仍有很大的改进空间。因此,今后在固体脂质纳米药物的开发中,应当关注粒径的减小、表面活性剂的性质等,并考虑到主要吸收环境的影响和给药方式的选择。同时,固体脂质纳米载体仍有一些不足需要解决,如固体脂质纳米载体中含有大量的水、载药能力有限、存储中固体脂质可能形成晶体导致性能下降等[4]。这些问题都需要进一步的研究,以期开发出效果更好的固体脂质纳米药物,以使其更好地发挥促进药物吸收的作用。
