FaesAP2B基因在甜荞长雌蕊长雄蕊突变体lpls的表达分析
2020-04-08张良波刘志雄
张 娇 王 旋 张良波 刘志雄
(长江大学园艺园林学院,荆州 434025)
甜荞(FagopyrumesculentumMoench.)为蓼科(Polygonaceae)荞麦属(FagopyrumMill)食药同源的杂粮作物,是荞麦属中2个栽培种之一[1]。甜荞籽粒除含大量蛋白质、纤维素、脂肪、淀粉等营养成分外,还含硒、铜等矿物质元素及芦丁等生物活性成分[2~3],营养价值高,且具保健功效,现越来越受人们的青睐。
甜荞属特殊异花授粉植物,自然群体中pin型和thrum型花植株1∶1分离,同型花自交不亲和,异型花间才能正常授粉结实,人工杂交困难,产量低[4~5]。寻找同型花和异型花间均能正常授粉结实的甜荞新种质,对于开展甜荞杂交育种、提高甜荞产量、新品种培育等均具有重要的理论意义和实际应用价值。课题组在前期育种实践中,从甜荞品种“北早生”群体中发现了长雌蕊长雄蕊“lpls”(Long pistil and long stamen,lpls)自然变异的单株,通过隔离授粉和单粒传法获得了遗传性状稳定、亲和性好、同型花、异型花间均能正常授粉结实的自然变异株系,成为开展甜荞育种工作的重要种质资源(图1)。深入系统研究甜荞lpls突变体花、籽粒发育的过程与分子调控机制,对于该种质的可持续性利用有重要的意义。

图1 甜荞3种花型图 A.thrum型花(短花柱长雄蕊);B.pin型花(长花柱短雄蕊);C.lpls突变体花(长花柱长雄蕊)Fig.1 Three flower types of F.esculentum A.thrum flower with short pistil and long stamen; B.pin flower with long pistil and short stamen; C.lpls flower with long pistil and long stamen
在模式植物拟南芥中,AP2基因主要参与花器官和果实的发育调控,促进花分生组织形成[6~8]。本实验以甜荞长雌蕊长雄蕊突变体lpls为材料,通过同源克隆结合RACE技术从甜荞突变体lpls花芽中克隆出了1个甜荞AP2同源基因的cDNA序列,在分析其结构的基础上,通过实时荧光定量PCR技术(quantitative Real-time PCR,qPCR)检测其在甜荞突变体lpls不同营养组织和生殖结构中的表达,以期为后续验证该基因在调控甜荞花发育的生物学功能上提供一定实验基础,并为进一步分析甜荞籽粒及花发育分子机制,及遗传改良积累资料。
1 材料与方法
1.1 实验材料
2018年3月21日,挑选颗粒饱满的甜荞‘lpls’的籽粒播种于花盆中(21 cm×14 cm×20 cm)。待5月盛花期时,分别从不同植株(≥3)上采集根、茎、幼叶、同时剥离花被片、雄蕊和雌蕊,以及发育4 d的甜荞果实于液氮中速冻后置于-80℃冰箱保存备用。
1.2 实验方法
1.2.1 甜荞lpls型花植株总RNA的提取及cDNA合成
取100 mg左右植物材料采用EASY spin植物总RNA提取试剂盒(艾德莱北京)分别提取甜荞的根、茎、幼叶、花被片、雄蕊、雌蕊和发育4 d的果实的RNA。采用HiScriptⅡ 1st Strand cDNA Synthesis Kit(诺唯赞南京)试剂盒反转录合成第一链cDNA,方法参照说明书。
1.2.2 甜荞FaesAP2B基因的克隆
根据NCBI(https://www.nlm.nih.gov/)数据库中公布的本课题组前期克隆的甜荞FaesAP2基因序列(KM386628.1),在其5′非翻译区(5′UTR)设计克隆FaesAP2B基因的特异性扩增引物GSPAP2B,以甜荞花芽cDNA为模板,用3′-Full RACE Core Set Ver.2.0试剂盒(TaKaRa)扩增甜荞FaesAP2B基因的cDNA序列全长,扩增PCR程序为:95℃预变性3 min,95℃变性30 s,58℃退火30 s,72℃延伸60 s,30个循环,72℃延伸10 min。扩增产物经1%琼脂糖凝胶电泳分离、回收目的片段,经连接、转化、阳性克隆鉴定、测序获得甜荞FaesAP2B基因的全长序列,实验所用引物见表1。
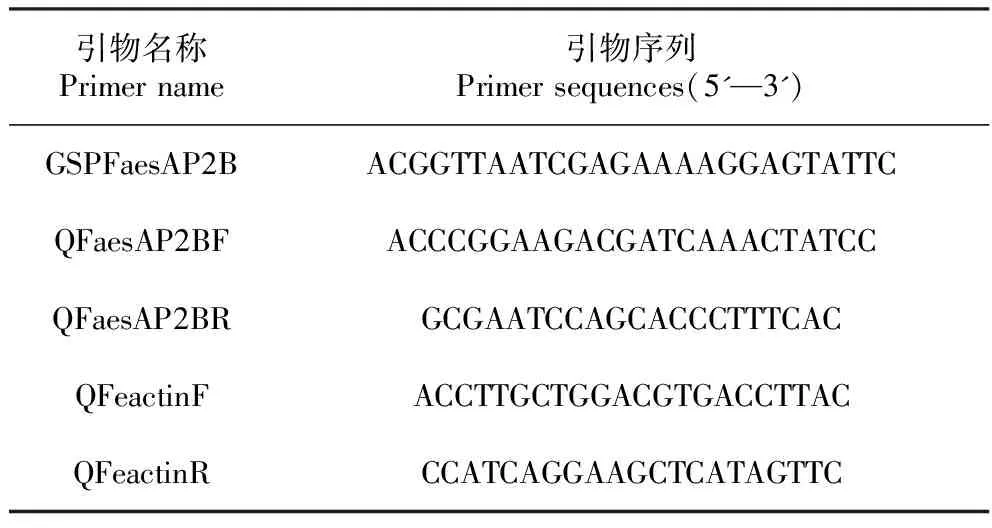
表1 引物名称及序列
1.2.3 蛋白序列比对与分子系统发育分析
将甜荞FaesAP2B基因开放阅读框(Open Reading Frame,ORF)编码的氨基酸序列在NCBI(https://www.ncbi.nlm.nih.gov/)数据库中进行BLAST同源搜索(https://blast.ncbi.nlm.nih.gov/Blast.cgi),下载甜荞FaesAP2B同源蛋白序列。选取其中已公布的22种来自不同植物的AP2同源蛋白(表2),用MEGA 5.0软件的ClustalW程序,对选取的序列进行同源比对,选Neighbor-Joining(邻位相连法,NJ法),采用1000次的自展(Bootstrap)重复,构建分子系统进化树(图2),用Bioedit7.0软件将甜荞FaesAP2B转录因子与大麦HvAP2、辣椒CaAP2、芍药PIAP2、苹果MadoAP2这4个AP2同源蛋白序列进行序列比对与结构分析。
表2 构建分析系统发育树的AP2同源蛋白
Table 2 AP2 homologous proteins for phylogentic tree construction

蛋白名称Protein种名SpeciesGenbank登录号Genbank accession numberLcAP2绿独行菜Lepidium campestre L.AGI62074.1HvAP2大麦Hordeum vulgare Linn.AGX92954.1OitaAP2意大利红门兰Orchisi talica Poir.AGV39618.1CaAP2辣椒Capsicum annuum Linn.AJC11183.1PIAP2芍药Paeonia lactiflora Pall.AGI61068.1MadoAP2苹果Malus pumila Mill.ADE41133.1ViviAP2葡萄Vitis vinifera Linn.NP_001267881.1DcOAP2木石斛Dendrobium crumenatum Sw.AAZ95247.1CiarAP2鹰嘴豆Cicer arietinum Linn.XP_004511904.1ZmAP2玉米Zea mays L.ABR19870.1MtAP2蒺藜苜蓿Medicago truncatula Gaertn.KEH31465.1 FaesAP2B甜荞Fagopyrum esculentum Moench.QCT84045.1OsAP2水稻Oryza sativa Japonica L.CAJ86049.1KjAP2棣棠Kerria japonica(Linn.) DC.AXR86367.1CacaAP2木豆Cajanus cajan(Linn.) Millsp.XP_020237263.1AtAP2拟南芥Arabidopsis thaliana(L.) Heynh.NP_001190938.1PtAP2L1黑松Pinus thunbergii ParlatoreBAD16603.1LmAP2L1落叶松Larix gmelinii(Ruprecht) KuzenevaABM26974.1NiatAP2烟草Nicotiana tabacum Linn.OIT36841.1AdAP2蔓花生Arachis duranensisXP_015963905.1CrAP2苏铁Cycas revoluta Thunb.BAE48512.1PsAP2牡丹Paeonia suffruticosa Andr.ALI57167.1
1.2.4 甜荞FaesAP2B基因的表达分析
用HiScript®Ⅱ QRT SuperMix for qPCR(+g DNA wiper)(Vazyme)试剂盒,除去上述7种组织总RNA中残存的基因组DNA再反转录合成第一链cDNA。具体操作步骤严格按照说明书进行。根据荧光定量引物设计的原则在甜荞FaesAP2B基因的特异性位置设计上下游引物QFaesAP2BF和QFaesAP2BR(表1),以荞麦Faesactin(GenBank登录号:HQ398855.1)为内参基因,内参基因引物分别为QFaesactinF和QFaesactinR(表1)。逆转录分别合成上述7种组织的cDNA,浓度稀释10倍后作为模板,使用ChamQ® SYBR® qPCR Master Mix(Vazyme)试剂盒,进行qPCR扩增,检测甜荞FaesAP2B基因在甜荞lpls突变体根、茎、幼叶、花被片、雄蕊、雌蕊以及发育4 d的果实中表达的组织特异性和相对表达量的变化。3个生物学重复,扩增体系及PCR程序参照说明书。基因的相对表达量利用2-ΔΔCT方法计算[9]。采用SPSS17.0软件对结果进行统计分析,采用最小显著性差异法(Least significant difference,LSD)对甜荞FaesAP2B基因的表达水平进行显著性差异分析,并用Microsoft Office Excel软件作图。
2 结果与分析
2.1 甜荞FaesAP2B基因全长cDNA克隆
同源克隆的方法结合RACE技术,从甜荞lpls突变体花芽中分离出一个AP2同源基因。其cDNA序列全长1 788 bp,其中5′UTR长51 bp,3′UTR长357 bp,其包含1个长1 380 bp完整的ORF,编码1个由459个氨基酸残基构成的AP2/ERF转录因子,命名为FaesAP2B(FagopyrumesculentumAP2B),GenBank登录号为MK290847.1。
2.2 蛋白序列比对与分子系统发育分析
系统发育分析如图2所示,结果表明甜荞FaesAP2B与其他被子植物AP2蛋白聚为一类,说明其属于AP2同源蛋白。且甜荞FaesAP2B与其他双子叶植物的AP2蛋白距离较近,表明其于双子叶植物AP2亲缘关系较近,而与禾本科、兰科等单子叶植物以及松科等裸子植物分隔较远,亲缘关系相对较远。与经典分类学研究结果基本一致。
蛋白序列比对结果如图3所示,该蛋白含有2个高度保守的AP2结构域,第1个AP2结构域位于第132~197号氨基酸之间,由66个氨基酸残基组成;第2个AP2结构域位于第223~279号氨基酸之间,由57个氨基酸残基组成。第1个AP2结构域前还存在1个由10个氨基酸残基组成的高度保守的核定位信号区,位于第121~130号氨基酸残基之间。该蛋白的氨基酸序列与其他4种植物的AP2同源蛋白的氨基酸序列除在2个AP2结构域和核定位信号区基本相同外,其编码的氨基酸与另外4种植物的AP2同源蛋白的氨基酸序列存在较大差异,这表明AP2同源基因的功能在不同植物中存在一定差异。
2.3 甜荞FaesAP2B基因的表达分析
利用实时荧光定量PCR检测甜荞FaesAP2B基因在甜荞长雌蕊长雄蕊突变体“lpls”的根、茎、叶、被片、雄蕊、雌蕊以及发育4 d的果实中的表达量。检测结果显示如图4,FaesAP2B基因在甜荞突变体lpls的7种不同组织中均有表达,且甜荞FaesAP2B在花被片、雌蕊、雌蕊和发育4 d的果实中的表达量均极显著高于其在根、茎和叶等营养器官中的表达量(LSD,P<0.01)。其中,甜荞FaesAP2B在雄蕊中的表达量最高,且极显著高于在其他6个器官中的表达量(LSD,P<0.01),但该基因在其根、茎、叶间的表达量无显著性差异。
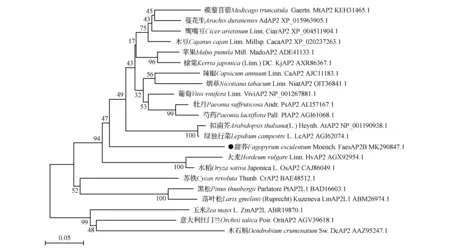
图2 FaesAP2B蛋白与其他植物AP2同源蛋白分子系统进化树 分支上的数字表示执行1 000次重复计算获得的自展百分比。Fig.2 Phylogenetic analysis of FaesAP2B with other AP2 like proteins Number represents the Bootstrap percentage values calculated by 1 000 replicates.
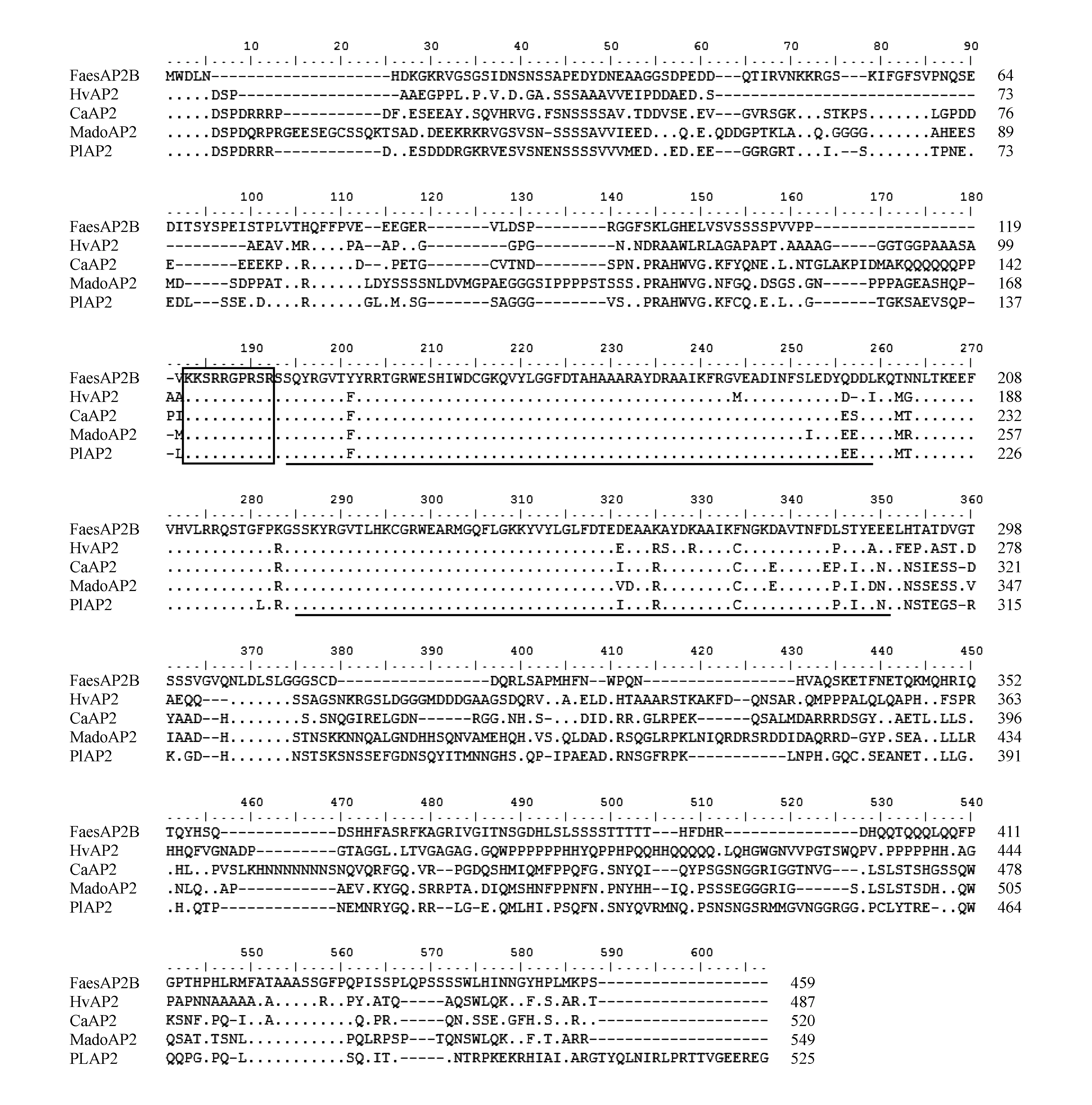
图3 FaesAP2B蛋白序列比对与结构分析 方框为核定位信号区,下划线表示AP2结构域。其中FaesAP2B、HvAP2、CaAP2、MadeAP2、PIAP2分别为甜荞、大麦、辣椒、苹果、芍药的AP2同源蛋白;点表示相同的氨基酸。Fig.3 Alignment of the putative amino acid sequence of FaesAP2B with other homologous proteins sequences Putative nuclear localization signals of FaesAP2 in front of the first AP2 domain are boxed; Underlined regions represent AP2domains. FaesAP2B,HvAP2,CaAP2,PIAP2,MadoAP2 of AP2 homologous proteins from Fagopyrum esculentum Moench.,Hordeum vulgare Linn.,Capsicum annuum Linn.,Malus pumila Mill.,Paeonia lactiflora Pall.,respectively; Dots represent the same amino acid.
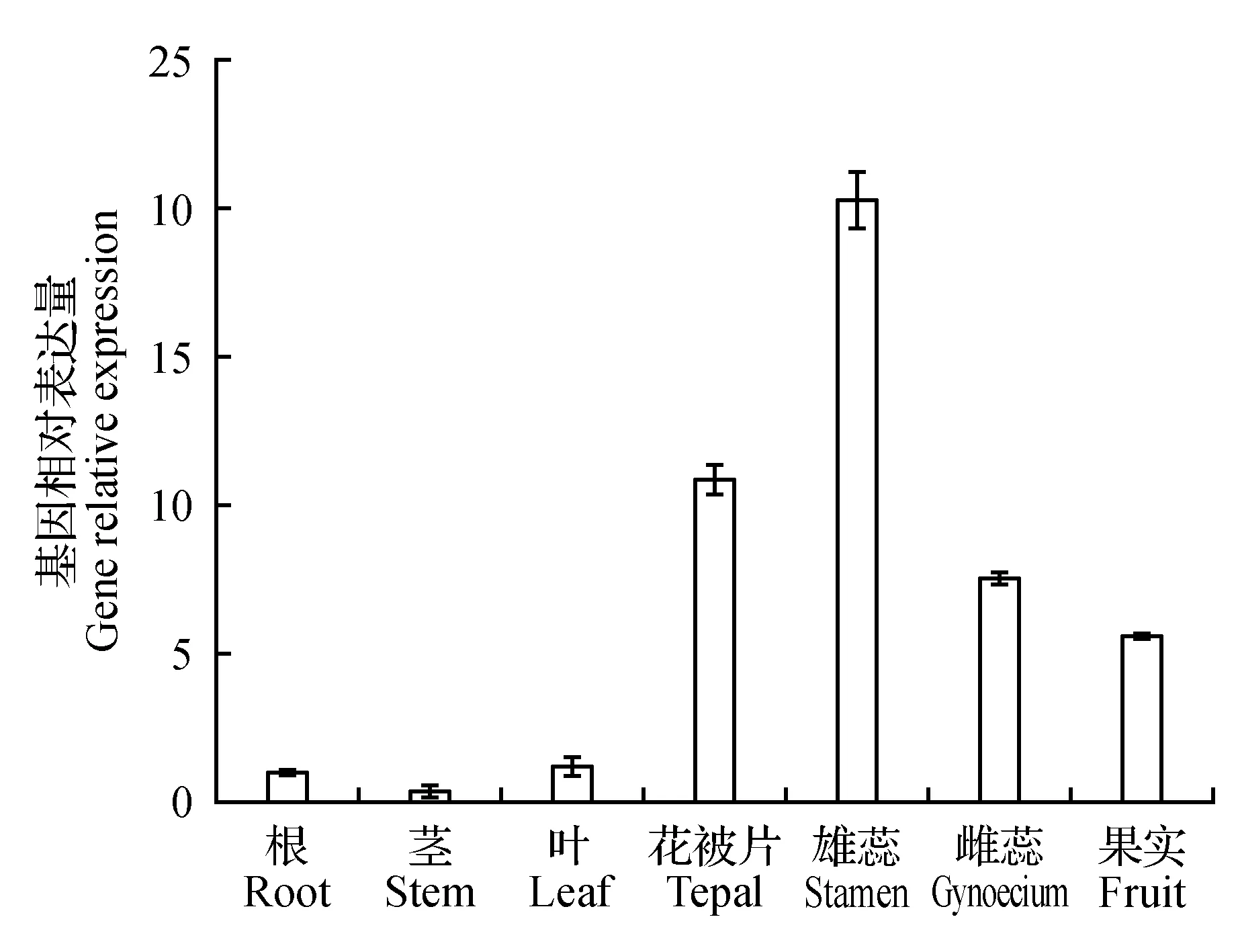
图4 FaesAP2B基因在甜荞不同组织器官中的表达量Fig.4 Expression of FaesAP2B in different organs of F.esculentum
3 讨论
在模式物种拟南芥中,AP2基因是典型的A功能基因,是唯一一类不属于MADs-box基因家族的花发育基因[10]。其控制第1、2轮(花萼、花瓣)花器官的发育,并抑制C类基因在外2轮花器官中表达[11~12]。拟南芥AP2基因具有编码AP2/ERF转录因子家族的特有的结构域,AP2/ERF超基因家族存在于所有植物中,其中,ERF亚类氨基酸序列中只包含1个高度保守的AP2结构域,而AP2亚类含有2个串联的AP2结构域,每个功能结构域有60~70个氨基酸组成,且高度保守[13~14]。AP2/ERF超级基因家族在植物花器官发育、花序分生组织发育的调控以及胚、胚乳、果实种子的发育,种子大小控制等方面发挥重要作用,与作物种子器官的产量与质量有密切关系[15~16]。同时,还参与植物生长激素的响应调节以及在逆境胁迫的信号转导中发挥作用[17~19]。
作为A类基因,AP2在植物花分生组织形成、花器官发育的调控网络中发挥重要作用。在强ap2突变体拟南芥中,其花瓣缺失,第1轮和第2轮花器官数量减少,并且第1轮花萼同源转变成心皮状结构,而在弱ap2突变体拟南芥中,其花萼叶化,花瓣雄蕊化[20~21]。这些现象说明AP2基因在控制拟南芥的花被(花萼和花瓣)发育起着重要的作用。此外也有研究发现AP2不仅仅在花器官中表达,在茎、叶中也有表达[22~23]。在辣椒中,AP2同源基因CaAP2在其叶、根茎、果皮中均检测到了该基因的表达,且主要在营养分生组织阶段发挥作用,而在成花过渡阶段表达量下降[24]。同样,AP2同源基因在美味猕猴桃(Actinidiadeliciosa(A.Chev.) C.F.Liang et A.R.Ferguson)和睡莲(NymphaeatetragonaGeorgi)的营养器官及生殖器官也都有表达,这与甜荞FaesAP2B基因的表达模式类似。且过表达的睡莲AP2基因NsAP2还可以影响GA的生物合成途径从而改变节间长度。另外,NsAP2异位表达也可使拟南芥花瓣数量增加[25~26];在芍药中,AP2的同源基因PIAP2主要调控心皮和萼片的发育,而在花瓣和雄蕊中维持低水平表达[27];矮牵牛(Petuniahybrida(J.D.Hooker) Vilmorin)的AP2同源基因PHAP2A过表达可以恢复拟南芥ap2-1突变体表型,但当该基因被敲除后发现并没有相应的突变体表型,这说明其可能存在功能冗余[28];而在玉米中,检测到AP2-like基因在18种组织中均有表达[29];在落叶乔木杂交落叶松中,AP2的同源基因LmAP2L1可调控体胚发生后期胚胎的萌发[30]。甘薯(Dioscoreaesculenta(Lour.) Burkill)中,AP2同源基因则作为转录因子在甘薯非生物胁迫抵抗能力上发挥重要作用[31];而在大麦中,HvAP2基因由mir172调控,参与穗分化以及节间长度的调控,并与大麦花序的大小以及形状,且过量HvAP2 mRNA可抑制节间生长并增加穗密度[32]。以上研究结果都表明AP2同源基因在不同物种中,其表达模式以及功能不尽相同。但总的来说主要在花和果实的发育中发挥重要作用。
在本研究中,我们通过实时荧光定量PCR发现甜荞FaesAP2B基因在花器官及果实中表达量较高,尤其是雄蕊中,另外在生殖器官外的组织中也检测到了甜荞FaesAP2B基因的表达,这些结果表明,甜荞FaesAP2B基因可能参与调控甜荞花及果实的发育,且主要在雄蕊的发育过程中发挥重要作用。另外,其作用不只局限于花发育,还可能参与了甜荞整个生长发育过程。其具体功能仍需进一步研究。
