大青杨PubZIP1基因的克隆及亚细胞定位与抗旱表达特性分析
2020-04-08马苗苗杨静莉
刘 晓 杨 佳 张 馨 马苗苗 杨静莉
(东北林业大学林木遗传育种国家重点实验室,哈尔滨 150040)
大青杨(PopulusussuriensisKom.)属杨柳科(Salicaceae)是一种速生落叶乔木,广泛分布于中国北方、朝鲜和西伯利亚。大青杨材质韧性较好,抗腐蚀性强,木质紧密净白,是造纸业和建筑业的优质原材料。随着自然环境的日渐恶化,大青杨表现出多种优良性状,比如其育种周期短,适应性强,因此广泛应用于人工造林和退耕还林。杨树在三北地区是主要的经济树种与绿化树种,但是其生长发育经常受到干旱、盐碱等逆境胁迫的限制[1]。因此对于研究大青杨抗逆的基因工程会越来越受到重视。
由于植物的固着性,它们无法移动以避免不利的环境,因此它们不得不应对各种恶劣的环境因素。为了在这些应激源中生存,植物发展出各种自我保护机制,例如合成具有不同功能的功能蛋白。功能蛋白的表达主要受特异性转录因子的控制。转录因子编码基因被认为是导致植物多样性和进化的重要原因之一。转录因子及其同源转录因子结合位点的鉴定对于操纵调控网络以获得目标分子所需的特性是十分必要的[2]。此外,转录因子通过对转录起始率的控制来调节基因表达,进而调节机体的生长发育[3]。
基本区域亮氨酸拉链(bZIP)家族是最保守的转录因子家族之一,并广泛分布于多数真核生物中。迄今为止,它们已被发现广泛存在拟南芥、水稻、番茄、玉米、高粱、胡萝卜等多种植物[4~10]。bZIP转录因子根据bZIP保守域命名,该域由60~80个氨基酸组成,包含两个功能区域:基本区域和亮氨酸拉链[11]。根据碱性结构域以及其他保守的结构域,同时依照拟南芥的77个bZIP类转录因子基因家族成员划分的A、B、C、D、E、F、G、H、I和S类10个亚家族[12],有报道将214条杨树bZIP转录因子根据其保守域氨基酸序列划分为A、B、C、D、E、F、G、H、I、S及其他等11个亚族[1]。
bZIP转录因子作为关键的调控因子在植物的各种生物过程和应激反应中起作用[13]。GEN研究发现bZIP转录因子参与了植物对生物胁迫和非生物胁迫的应激反应,包括病原体防御[14~15],激素和糖信号[16~17],光响应[18~19],耐盐耐旱[8,20]等。例如,在拟南芥(A.thaliana)中,转录因子AtbZIP1-AtbZIP75可以调控多种生物过程,如胁迫信号,光信号转导[21]。玉米ZmbZIP72基因在拟南芥中过表达提高了非生物胁迫的耐受性[22]。在大豆中GmbZIPs,表现出明显的抗盐性和抗旱性[23]。此外,bZIP转录因子家族bZIP73的提高了水稻在寒冷的气候条件下的适应性[24]。bZIP家族的FmABI5基因参与了水曲柳对高盐、干旱、低温与甘露醇的响应[25]。BebZIP2和BebZIP6基因参与了慈竹对冷和干旱等非生物胁迫的响应[26]。
近年来,关于bZIP转录因子的研究主要集中在农作物和草本植物中,但是对于木本植物的研究较少[1]。本文以木本植物大青杨为对象,利用生物信息学技术分析预测bZIP1基因的功能及结构,并分析了该基因在渗透胁迫下的表达模式。
1 材料与方法
1.1 植物材料
采用本实验室保存的无菌的大青杨组培苗,放置在25℃组培室,光周期为16 h/8 h,培养基为1/2MS培养基,直至株高8~10 cm用于以下试验。
1.2 实验方法
1.2.1 大青杨RNA的提取及cDNA的合成
将植物材料放入液氮中研磨,利用北京诺博莱德科技有限公司供应的QIAGEN RNeasy®Plant Mini Kit(50),提取大青杨总RNA,使用南京诺唯赞生物生产的HiScript® Ⅱ Q RT SuperMix for qPCR(+gDNA wiper)将其反转录成cDNA。反转录成功后的cDNA放置在-20℃冰箱内保存备用。
1.2.2 大青杨PubZIP1基因的克隆
根据本实验室前期对干旱胁迫下大青杨转录组测序分析,筛选获得多个干旱响应的bZIP转录因子成员。本研究对其中与毛果杨基因Potri.005G170500.1同源的一个成员做进一步的功能研究,并将其命名为PubZIP1(accession number:MG387125)。
在PubZIP1基因序列两端分别设计引物,由库美生物公司合成正向引物F:5′-GAGATTCTTTTAGAGCATG-3′以及反向引物R:5′-GACTAAGTGGGTTCACGAGG-3′。以提取的大青杨RNA反转录的cDNA为模版,利用购自北京全式金生物技术有限公司2×Easy Taq PCR SuperMix克隆试剂盒进行PCR,克隆出基因的全长片段。PCR总反应体系为20 μL,其中cDNA模版1 μL、正反向引物各1 μL、2×Easy Taq PCR SuperMix酶10 μL、去离子水7 μL。PCR反应条件为:94℃预变性2 min,94℃变性30 s,60℃退火30 s,72℃延伸30 s,共38个循环,72℃延伸2 min。电泳检测目的条带正确后,使用购自康为世纪的快速琼脂糖凝胶DNA回收试剂盒对PCR扩增产物进行胶回收,具体步骤见试剂盒说明书。
PCR产物经过1.2%琼脂糖凝胶电泳,使用DL2000 DNA Marker目的片段比对,利用购自北京康为世纪生物科技有限公司的快速琼脂糖凝胶DNA回收试剂盒胶回收目的片段。连接到PEASY-T1载体,利用热激法转化大肠杆菌,菌液涂板,次日挑取单克隆,摇菌送测序。
1.2.3 植物表达载体pCAMBIA1300-PubZIP1-GFP的构建
1.2.3.1 设计载体的双酶切引物
通过分析杨树PubZIP1基因全长序列及pCAMBIA1300-sGFP载体图谱设计带有酶切位点的引物。在载体图谱的多克隆位点中找出载体全部可用的酶切位点,以确定可供选择的限制性内切酶,然后将杨树PubZIP1基因全长CDS序列输入到BioEdit软件中,通过软件分析的结果得出该基因不可用的酶切位点,选取二者共有的限制性内切酶作为最终酶切位点。本实验选取BamHⅠ和SalⅠ两个酶切位点,正向酶切引物F:GCGGATCCATGAGCTCTACGTCAACTC,反向酶切引物R:GCGTCGACTAGTGGGTTCACGAGGACAAG。
1.2.3.2 目的基因PCR扩增及胶回收
酶切引物合成后,以连接PEASY-T1-PubZIP1阳性质粒为模板PCR扩增。在120 V电压下,电泳检测目的条带是否正确,若条带正确则利用购自北京全式金生物技术有限公司2×Easy Taq PCR SuperMix克隆试剂盒进行PCR扩增,然后使用快速琼脂糖凝胶回收试剂盒对其进行胶回收,并按照康为世纪公司的快速DNA产物纯化试剂盒说明书的操作步骤进行纯化。
1.2.3.3 pCAMBIA1300-GFP质粒的提取
在无菌的150 mL小瓶中加入20 mL含50 mg·mL-1的卡那霉素(Kan)LB液体培养基,再加入15 μL转入pCAMBIA1300-GFP质粒的大肠杆菌菌液,放置于37℃摇床上160 r·min-1震荡培养14 h,使用北京康为世纪生物科技有限公司的质粒小提试剂盒提取pCAMBIA1300-GFP质粒。
1.2.3.4 目的基因与载体的双酶切反应及纯化
将胶回收产物和pCAMBIA1300-GFP质粒同时进行BamH/SalⅠ双酶切,酶切体系如下表4(100 μL):反应条件为37℃,酶切反应时间为2~3 h。最后使用康为世纪公司的快速DNA产物纯化试剂盒对酶切产物分别进行纯化。双酶切总反应体系为100 μL,其中pCAMBIA1300-GFP质粒50 μL、0×T Buffer 10 μL、bamH 5 μL、SalⅠ 5 μL、去离子水30 μL。
1.2.3.5 大肠杆菌的转化及PCR检测
将连接产物通过热激法转化到大肠杆菌DH5α中,抽取200 μL菌液到无菌的含50 mg·L-1Kan的LB固体培养基平板中,用酒精灯烧过的无菌涂棒涂至均匀。在37℃摇床中倒置过夜培养后,用无菌的镊子夹取无菌的小枪头挑取单克隆菌落摇菌,然后进行菌液PCR及电泳检测,并将阳性的菌液抽取500 μL送去公司测序,剩余菌液和50%甘油按1∶1比例混匀加入无菌的1.5 mL离心管中,充分混匀放入液氮快速冷凝,-80℃冷冻保存。测序比对正确后的菌液使用高纯度质粒小提试剂盒提取质粒pCAMBIA1300-PubZIP1-GFP。
1.2.4 大青杨PubZIP1基因生物信息学及进化树分析
利用NCBI(https://www.ncbi.nlm.nih.gov/orffinder/)在线软件分析大青杨PubZIP1基因的开放阅读框;通过http://www.bio-soft.net/sms/index.html查询该基因的同源核苷酸及氨基酸序列;利用ExPASy服务器中的Protparam(https://web.expasy.org/protparam/)工具分析蛋白的理化性质;根据ExPASy(https://web.expasy.org/protscale/)服务器中的ProtScale程序分析大青杨PubZIP1蛋白的疏水性;通过在线软件NPS@(https://npsa-prabi.ibcp.fr/cgi-bin/secpred_gor4.pl)预测蛋白的二级结构。通过TMHMM Server v.2.0对蛋白进行跨膜区分析;使用SignalP 3.0 server(http://www.cbs.dtu.dk/services/SignalP-3.0/)对蛋白进行信号肽预测,并预测该蛋白质N端信号肽的有无及其酶切位点;使用COILS Server对肝蛋白卷曲螺旋预测分析;NCBI在线预测蛋白结构域;通过http://multalin.toulouse.inra.fr/multalin/multalin.html进行氨基酸多序列比对;通过http://multalin.toulouse.inra.fr/multalin/cgi-bin/multalin.pl网址进行氨基酸结构比对;利用MEGA5.05软件采用邻接法构建系统进化树。
1.2.5 亚细胞定位
构建PubZIP1基因融合绿色荧光蛋白(GFP)瞬时表达载体(pBI121-PubZIP1-GFP),并利用氯化铯—溴化乙锭超高速梯度密度离心方法进行质粒提取。将提取的质粒包裹金粉,用基因枪(PDS-1000/He Particle Delivery System)轰击洋葱表皮,并用激光共聚焦显微镜(Olympus-FV1000MPE)观察亚细胞定位情况。
1.2.6 大青杨PubZIP1基因的表达模式分析
采用1/2MS固体培养基,将大青杨幼苗培养24 d左右,选择生长良好且一致的5 cm高的组培苗作为试验材料。
分别提取3株未受胁迫的生长状况良好的大青杨的根茎叶的RNA,反转录成cDNA,以根为对照组,使用大青杨PtrActin基因作为内参基因,设计内参引物由库美生物公司合成正向引物PtrActin-F:5′-TGTTGCCCTTGACTATGAGCAGGA-3′以及反向引物PtrActin-R:5′-ACGGAATCTCTCAGCTCCAATGGT-3′,长度为165 bp。
将生长良好、状态相似的大青杨组培苗插入添加7% PEG6000的1/2MS固体培养基中模拟干旱胁迫,在胁迫0、6、12、24 h时分别提取根茎叶部位的RNA,反转录成cDNA(每个胁迫时间段选取3个独立植株)。以未处理的根部的表达量为对照组,分别用提取的各个胁迫时间段的cDNA为模版,通过荧光定量PCR仪(Applied Biosystems,Foster City,CA,USA)使用南京诺唯赞生物生产的ChamQTMUniversal SYBR® qPCR Master Mix进行qRT-PCR分析,用2-ΔΔCT计算法计算其相对表达量。PCR总反应体系为20 μL,其中cDNA模版1 μL、正反向引物各1 μL、2×Easy Taq PCR SuperMix酶10 μL、去离子水7 μL。
2 结果与分析
2.1 大青杨PubZIP1基因的克隆
以大青杨为材料分别提取根、茎、叶和总RNA(图1)。利用总RNA反转录成cDNA,以2000 Marker为对照,扩增该基因的CDS序列,扩增产物长度为1 083 bp(图2)。
图1 大青杨RNA的提取 M. DNA Mareker DL2000;1~5.RNA产物Fig.1 The RNA production of P.ussuriensis Kom. M.DNA Mareker DL2000;1-5.RNA production
图2 大青杨PubZIP1基因的克隆 M. DNA Mareker DL2000;1~5.PubZIP1克隆产物Fig.2 PCR production of PubZIP1 M.DNA Mareker DL2000;1-5.PCR production of PubZIP1
2.2 大青杨PubZIP1基因编码的氨基酸序列及其理化特性
2.2.1 大青杨PubZIP1基因编码的氨基酸序列
通过在线查询得知大青杨PubZIP1基因共编码360个氨基酸(图3)。利用ExPASy服务器中的Protparam工具分析蛋白的理化性质,发现氨基酸的数量为360,分子质量为40 645.82,理论等电子点为6.68,总共包括5 670个原子,分子式为C1772H2812N530O543S13,在组成蛋白的20种氨基酸中,亮氨酸(Leu)所占比例最高,占10.8%,(Cys)所占比例最低,占0.3%,不包括含硒半胱氨酸(Sec)和吡咯赖氨酸(Pyl)。蛋白的不稳定指数为47.52,脂肪指数为81.67,总平均亲水性为-0.531。
2.2.2 大青杨PubZIP1基因的理化特性2.2.2.1 大青杨PubZIP1基因编码的蛋白疏水性
根据ExPASy服务器中的ProtScale程序分析大青杨PubZIP1蛋白的疏水性,计算基于K-D法的蛋白质疏水性。分析结果发现,第285位的氨基酸为缬氨酸(Val),疏水性最大,分值为1.833;第70位的氨基酸为谷氨酸(Glu),亲水性最大,分值为-2.522。根据图4中数据,分值为负值的氨基酸数量大于分值为正值的氨基酸数量,表示亲水性大于疏水性,因而推测该蛋白为亲水性蛋白。
2.2.2.2 大青杨PubZIP1基因编码的蛋白的二级结构及功能结构域预测
通过在线预测蛋白的二级结构,如图5所示该蛋白的二级结构主要是由α-螺旋(62.50%),无规卷曲(29.72%),延伸链(5.56%),β-折叠(2.22%)组成。
2.2.2.3 对蛋白跨膜区进行分析
通过TMHMM Server v.2.0对蛋白进行跨膜区分析(图6)。发现细胞膜表面并没有典型的跨膜螺旋区,也没有氨基酸位于细胞膜内,参考该蛋白的疏水性区域分析结果,表明该蛋白并不是一个与细胞信号传导有关的膜受体蛋白。

图3 大青杨PubZIP1基因序列及其推导的氨基酸序列Fig.3 Nucleotide and deduced polypeptide sequences of PubZIP1

图4 PubZIP1蛋白的疏水性预测Fig.4 Hydrophobicity analysis prediction PubZIP1 protein
2.2.2.4 蛋白信号肽及蛋白卷曲螺旋预测分析
使用SignalP 3.0 server(http://www.cbs.dtu.dk/services/SignalP-3.0/)对蛋白进行信号肽预测,预测蛋白质N端没有信号肽。预测结果如图7所示。使用COILS Server对蛋白卷曲螺旋预测分析,分析结果如图8所示,检测不到该蛋白具有卷曲螺旋结构。
2.2.2.5 蛋白结构域预测
通过NCBI在线分析蛋白的功能结构域,分析结果如图9所示。经过分析得出该蛋白包括bZIP结构域和DOG1结构域。bZIP结构域由第163到239的77个氨基酸构成bZIP结构域,bZIP结构域广泛存在于植物蛋白中。它们在人属和异质二聚体的网络中起作用,调节一系列不同的细胞过程,包括细胞存活、学习和记忆、脂质代谢和癌症进展等。它们在对刺激或压力信号的反应中扮演重要角色,如细胞因子、基因毒性药物或生理应激。DOG1结构域由第77到129的53个氨基酸组成。
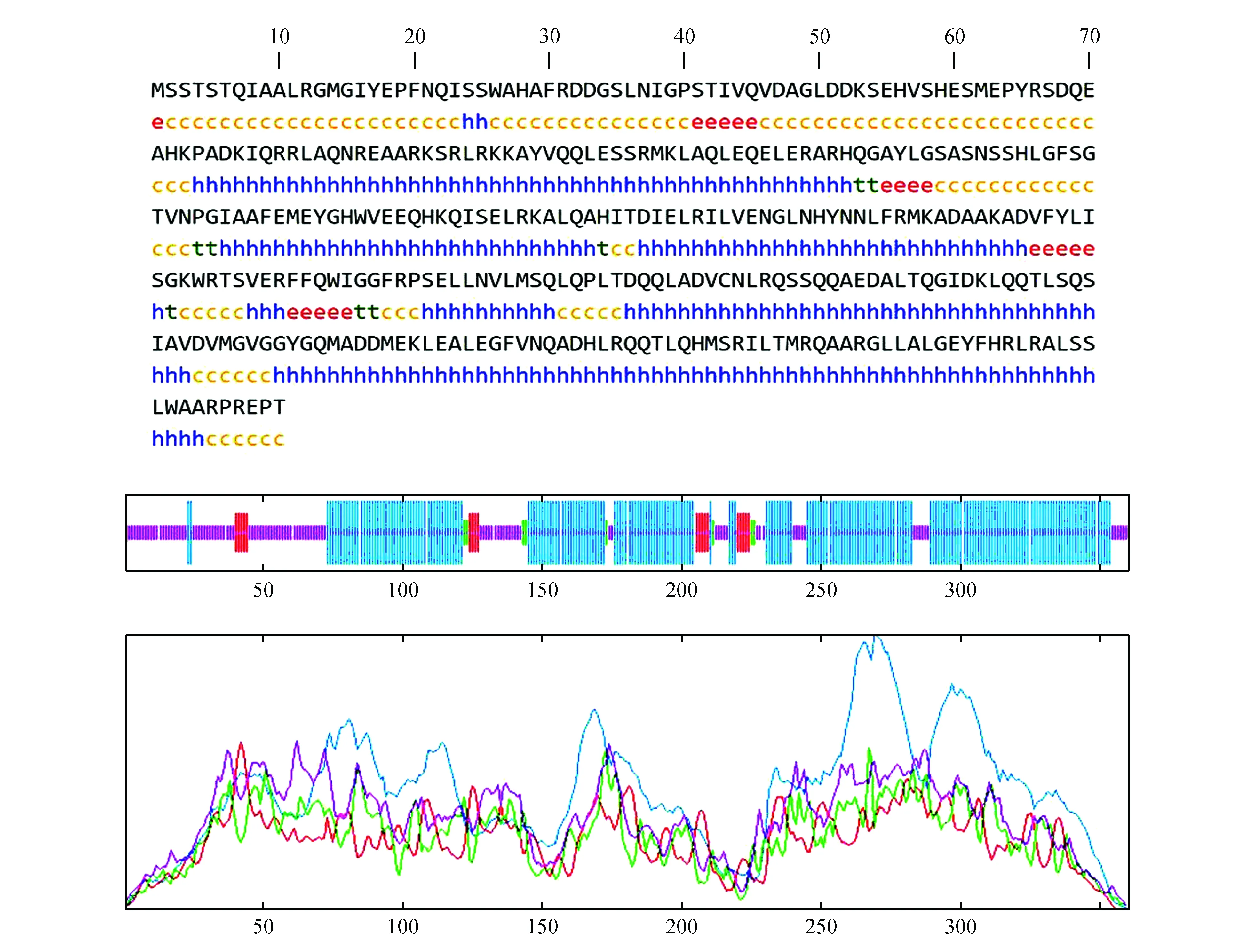
图5 PubZIP1蛋白的二级结构预测Fig.5 Predicted secondary structure prediction of PubZIP1 protein
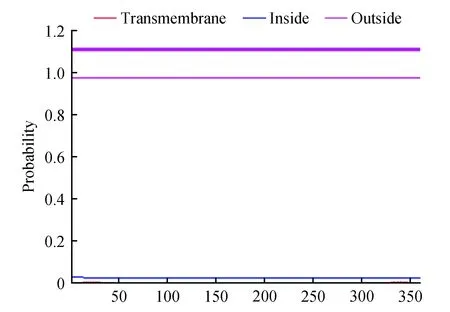
图6 PubZIP1蛋白的跨膜区分析Fig.6 Transmembrane region prediction of PubZIP1 protein
2.2.2.6 氨基酸序列比对及系统进化树的构建
通过在线比对氨基酸序列,将大青杨PubZIP1基因推导的氨基酸序列与其他植物相同基因的氨基酸序列进行同源性比对,结果显示,大青杨(Populusussuriensis)PubZIP1与棉花(Gossypiumhirsutum)、烟草(Nicotianatabacum)、甜椒(Capsicumannuum)、拟南芥(Arabidopsisthaliana)等物种同源蛋白序列有高度保守性(图10)。通过MEGA5.05软件进行系统进化树的构建(图11),大青杨(Populusussuriensis)与萝藦(Ricinuscommunis)、红茄苳(Rhizophoramucronata)有较近的遗传距离,所以预测他们有更近的亲缘关系。而与蒺藜苜蓿(Medicagotruncatula)、大豆(Glycinesoja)、桑树(Morusnotabilis)、烟草(Nicotianatabacum)、甜椒(Capsicumannuum)遗传距离较远,因此预测他们亲缘关系更远。
2.2.2.7 大青杨PubZIP1基因的亚细胞定位实验结果
利用基因枪分别将金粉包裹的pCAMBIA1300-PubZIP1-GFP质粒和pCAMBIA1300-GFP质粒通过基因枪轰击洋葱内表皮,将洋葱内表皮放置在1/2MS培养基上,暗培养24 h后,通过激光共聚焦显微镜观察发现(图12),对照pCAMBIA1300-GFP空载体在整个洋葱细胞均能看到绿色荧光,为组成型表达;pCAMBIA1300-PubZIP1-GFP的融合表达载体在35S启动下PubZIP1-GFP融合蛋白发出荧光,这进一步证明PubZIP1定位在细胞核中,具有转录因子的一般特征。
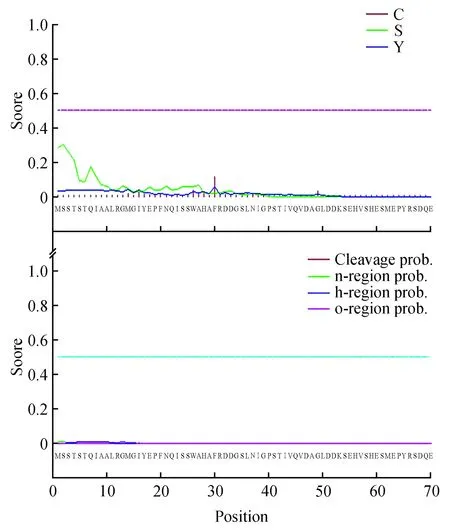
图7 PubZIP1蛋白的信号肽预测Fig.7 Signal peptide prediction of the PubZIP1 protein
图8 PubZIP1蛋白的卷曲螺旋预测Fig.8 Coiled coils prediction of PubZIP1 protein

图10 大青杨PubZIP1氨基酸与其他植物氨基酸序列比对(框选为保守区域)Fig.10 P.ussuriensis alignment analysis of PubZIP1 conservative structure domain in different plants(boxes selected as conservative areas)
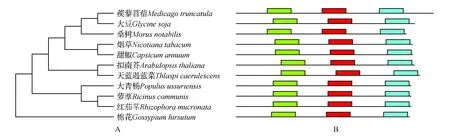
图11 不同植物PubZIP1基因的系统进化树(邻接法)及保守区域 A.系统进化树;B.氨基酸序列保守区域Fig.11 Molecular phylogenetic tree analysis of PubZIP1 in plant species A.Molecular phylogenetic tree; B.The conserved region of amino acid sequence
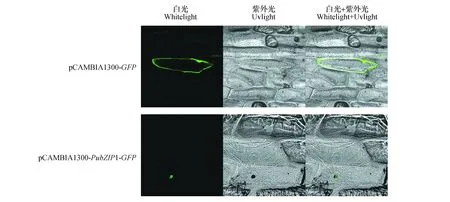
图12 大青杨PubZIP1基因的亚细胞定位Fig.12 Subcellular localization analysis of the PubZIP1 gene
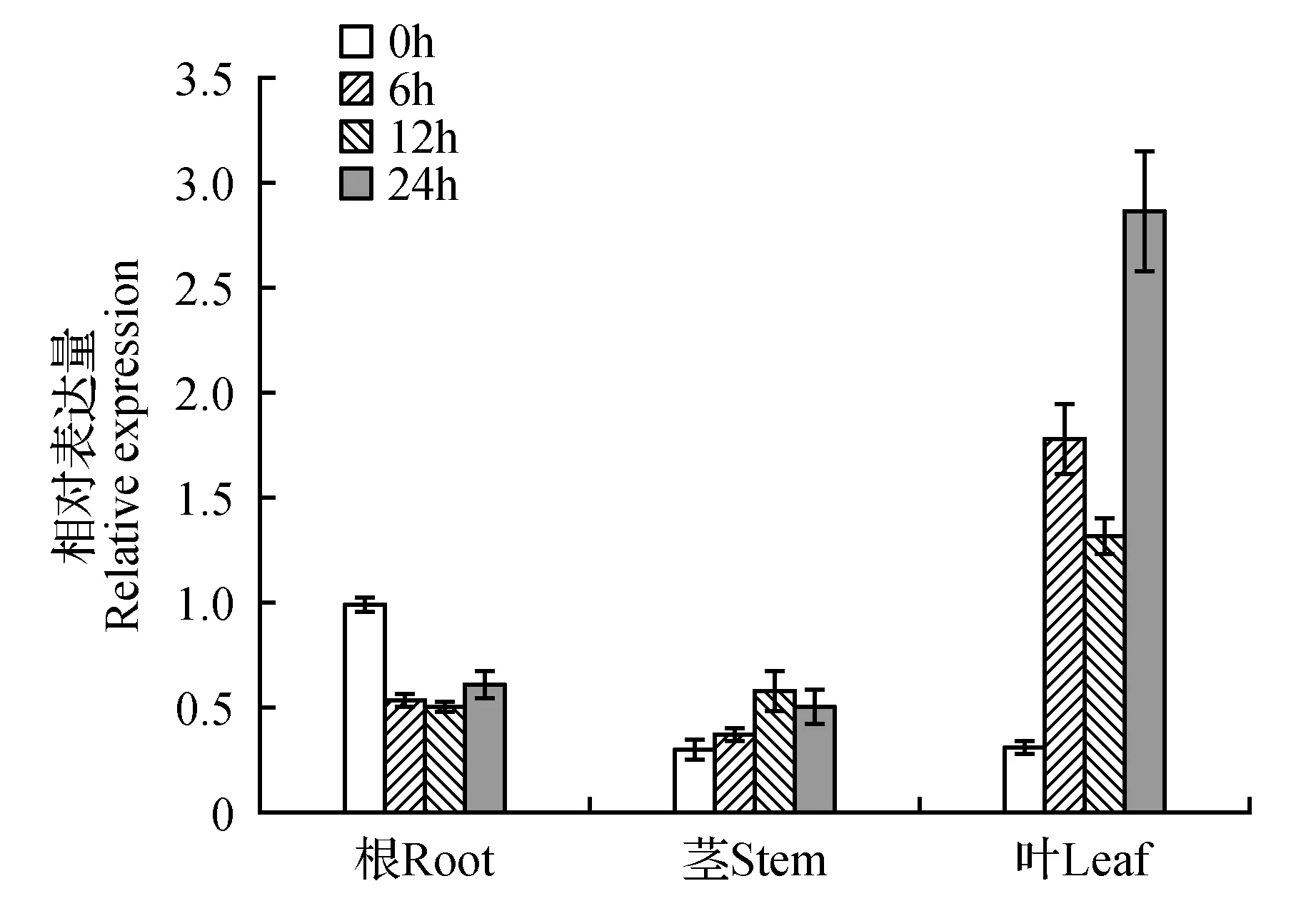
图13 大青杨PubZIP1基因在PEG6000处理下不同时间段的组织特异性表达情况Fig.13 Quantitative real-time PCR analysis of the expression pattern of PubZIP1 gene in different tissues after 7% PEG6000 treatment
2.2.2.8 大青杨PubZIP1基因的表达模式分析
分别检测PubZIP1基因在不同PEG6000胁迫时间下大青杨根、茎、叶中的表达量(图13),以胁迫0 h的PubZIP1基因在大青杨根部中的表达量为对照组,分析结果表明胁迫后PubZIP1基因在大青杨根中的表达量呈下降趋势。而在大青杨茎和叶片中的表达量呈上升趋势,尤其是在叶片中明显被诱导表达。预测该基因可能主要在叶片中表达并行使功能。
3 讨论
植物的生长和发育经常受到各种不利的生物和非生物胁迫(如干旱、高盐和低温)的影响。植物本质上是固着的,因此它们发展出一系列有效的机制来感知并对这些环境压力做出充分的反应,例如,通过转录因子与它们的启动因子中存在的特定顺式作用元件结合,对应激反应基因进行转录调控。本研究从大青杨中克隆获得PubZIP1转录因子,该基因包括有1 083 bp的CDS序列,共编码360个氨基酸。通过对PubZIP1氨基酸序列进行二级结构预测及保守区域可知,分析得出该蛋白包括bZIP结构域和DOG1结构域。通过预测不含有指导蛋白转移的信号肽和跨膜运输结构。蛋白的二级结构主要是由α-螺旋(62.50%)、无规卷曲(29.72%),构成,其次还有少量延伸链(5.56%),β-折叠(2.22%)。通过亚细胞定位技术,证明该基因位于细胞核中。
研究发现,bZIP在不同植物中参与抗旱胁迫,例如:小麦中bZIP类转录因子编码的基因Wa-bi5,其表达量在干旱胁迫下明显上调,转Wa-bi5基因的烟草对干旱的耐受性也显著增强[27];在拟南芥中bZIP转录因子ABF3/ABF4可以提高植株的抗旱性[28];在大豆中克隆的GmbZIP-32基因在干旱和高盐胁迫下表现出不同程度的响应应答[29];桑树MnbZIP基因属于bZIP转录因子,通过荧光定量PCR法对MnbZIP在干旱、高盐和低温条件下的表达量进行分析,结果表明,该基因表达量在这几种胁迫下都有上调[30]。我们对生长状态相同的大青杨分别使用模拟抗旱的7% PEG6000处理不同时间,通过实时荧光定量PCR法分析PubZIP1在PEG6000胁迫下的表达情况。结果表明,在PEG处理下PubZIP1在叶片部位和茎部的表达量明显被诱导上调,在根部的表达量明显被诱导下调。表明PubZIP1可能参与了大青杨对渗透胁迫的信号传导,属于逆境胁迫下的调控因子。
本研究初步证明大青杨PubZIP1基因具有一定的抗旱能力,但是关于其信号传导与调控机制的研究需进一步的研究。由于大青杨物种的基因组测序并未完成,所以需要进一步的研究发现更多的基因组信息及其结构和功能。本文从大青杨中克隆出PubZIP1基因,并通过生物信息学和非生物因素胁迫等方法预测基因结构和功能。不仅为大青杨基因组的测序完成提供更多的数据,同时为大青杨bZIP1基因的抗旱研究提供理论基础。
