一种茶树促生菌固化剂的研制及其施用效果
2020-04-08张永利夏先江孙宇龙苏有健廖万有王烨军
罗 毅,张永利,夏先江,孙宇龙,苏有健,廖万有,王烨军
(安徽省农业科学院茶叶研究所,安徽 黄山 245000)
茶树[Camellia sinensis(L.)O.Kuntze]是热带和亚热带地区重要的经济作物。在我国,茶树的种植面积超过266.7万hm2,干毛茶产值超过1 519亿元[1]。因此保持茶业产业持续健康发展,对我国农民增收和农业发展有重要意义。然而由于茶树为多年生木本植物,其生理特性和耕作管理措施有别于其它作物,因此土壤理化性状在植茶后会发生显著的变化,例如土壤pH值显著降低,钙、镁等盐基离子不断减少,铝、铁、锰等元素相对累积,土壤微生物区系受到破坏,土壤供肥能力下降。另一方面,有“喜铵”肥特性的茶树,每年的叶片采摘又会带走大量的含氮营养物质,使得土壤氮素供给的压力逐步增大[2]。有机肥料由于其养分种类全面,从而在改良土壤结构和改善作物品质方面具有化学肥料不可比拟的作用。但有机肥养分含量低,短期内有效养分少,难以满足当季作物生长的需求[3],因此,茶农为提高产量,每年向茶园中施入大量的化学肥料,从而进一步加剧了土壤的酸化和养分失衡。在此背景下,利用植物根际促生菌Plant-Growth-Promoting Rhizobacteria(PGPR)生产微生物有机肥的研究逐渐成为热点,前期报道较多的是利用芽孢杆菌属(Bacillus spp.)和假单胞菌属(Pseudomonas spp.)制备的微生物有机肥,其相关产品已在多种作物上起到良好的生物学效果[4-6]。这主要归功于促生微生物在植物根际的定殖和生长为植物提供了养分和促生物质。然而现有的微生物肥料多是针对中性土壤环境下筛选和应用,肥料中的促生菌对酸性土壤中铝毒害的耐受性很低。当土壤中的Al3+含量达到100 μ mol/L时就会引起细胞中毒[7],而茶园土壤的活性铝含量普遍超过 1 mmol/L(27 mg/kg)[8],微生物细胞在酸性土壤中定殖和促生能力有限。因此,有必要筛选和利用适用于茶园土壤的具有耐酸铝特性的促生菌株来研发生物肥料或其他形式的制剂。
此外,微生物产品在田间施用过程中,容易与土著菌产生恶性竞争,或者难以适应温度、水分、通气和pH值等环境因子的剧烈变化,或因降水或灌溉造成流失,导致原本的高效菌株在土壤中的种群密度下降,难以发挥生物功能[9]。细胞固定化技术是通过物理或化学手段将游离的微生物或酶,定位于限定的空间区域并使其保持活性[10]。与其他应用游离微生物的过程相比,固定化微生物技术可以使微生物在某一固定区域具有较高的密度,从而改变微环境,减轻或消除微生物的损失,提高微生物的使用效果[11-12]。例如姜天翔等[13]利用聚乙烯醇、1%的海藻酸钠和活性炭作为包埋剂包埋石油降解菌在含油海水中使用,对石油的降解率较游离菌提高了22.6%。Bramhachari等[14]利用邻苯二酚为唯一炭源,筛选到一株氧化木糖无色杆菌(Achromobacter xylosoxidans 15DKVB),游离菌体降解500 mg/L邻苯二酚污染物需60 h,而利用海藻酸钠包埋后42 h可去除相同浓度的邻苯二酚,目前已被用于造纸厂污水和污染土壤处理方面。但是,目前利用该技术在茶园土壤上开展养分活化方面的相关报道尚少。
本试验以筛选得到的适应茶园酸性土壤环境的促生微生物为材料,通过活性炭、海藻酸钠和琼脂的吸附和包埋作用制备固化菌球,结合茶园有机肥施用措施,比较和评价功能菌在土壤中的定殖状况及其对茶园土壤养分转化的作用,为改善茶园土壤养分状况和肥料的高效利用提供新的方法。
1 材料与方法
1.1 土壤样品采集和培养基
本研究筛菌所用的土壤为黄山、霍山、武夷山、东至和南京等地的茶园土壤。所用培养基有:S-LB培养基:蛋白胨0.5 g,酵母提取物0.2 g,NaCl 10 g,用土壤浸提液定容至1 L,固体加入2.5%的琼脂,加AlCl3至不同的浓度;GM培养基:葡萄糖10 g,NaCl 5 g,酵母提取物0.2 g,蛋白胨0.5 g,MgSO4·7H2O 0.2 g,固体加入2.5%的琼脂,蒸馏水1 L;阿须贝无氮菌培养基:KH2PO40.2 g,MgSO4·7H2O 0.2 g,NaCl 0.2 g,CaCO35.0 g,甘露醇 10.0 g,CaSO4·2H2O 0.1 g,琼脂粉18~20 g,蒸馏水1 L,pH值7.0。
1.2 耐酸铝促生菌的筛选和鉴定
称取5 g土壤放入45 mL的S-LB液体培养基(铝离子浓度50 mmol/L)30℃培养过夜,静置后取上清液100 μL,涂布于含相同铝离子浓度的S-LB固体培养基上,倒置培养,将长出的菌落,划线到铝浓度100 mmol/L(pH=3.0)的S-LB固体培养基上,倒置培养。将分离纯化的菌株,点接于阿须贝无氮培养基上,30°C恒温培养,挑选菌落较大的菌株。将初筛获得的耐酸铝促生菌,活化后用Salkowski比色法[15]对其生长素分泌能力进行检测。挑选生长素分泌较高的菌株接入含10 mL蛋白胨的无菌水(10 g/L)试管中,28℃培养3 d后,每管加入0.5 mL Nessler’s试剂,测定其有无有机质矿化后的产氨能力,出现红褐色沉淀视为矿化产氨的阳性反应[16]。菌株鉴定采用分子生物学方法进行,菌株送生物(上海)公司测序鉴定。使用BLAST将测序结果在 NCBI(http://www.ncbi.nlm.nih.gov/)上比对,根据同源性搜索结果,使用MEGA 5.0生物学软件对测试菌株和相关菌株的多个序列进行比对分析及Neighbor-Joining方法构建系统发育树。
1.3 固定化菌剂的制备
以终体积的0.25%添加活性炭到步骤1.2筛选出的菌株生长对数期的培养液中,10~12℃,转速130 r/min过夜,分别称取一定质量的海藻酸钠、琼脂和30%甘油,煮沸溶解,配成一定含量的混合溶液,冷却至40℃左右加入一定量的活性炭吸附的菌悬液包埋,搅拌均匀后用注射器滴入4%的CaCl2溶液与饱和硼酸溶液组成(用NaCO3调节pH值至6.7)的交联剂中进行交联,完成后用蒸馏水冲洗2~3次,保存于生理盐水(0.9%)中待用。对其溶胀性、完整性和菌体生长传质性进行测定,依此优化包埋剂和包菌量。溶胀性测定:取一定数目的固定化菌剂放入烧杯中,加入蒸馏水后进行持续曝气,观察小球溶胀、破损情况。完整性:取一定数目的固定化菌剂放入烧杯中,加入蒸馏水后利用搅拌器进行搅拌(200 r/min),查看搅拌后剩余结构完整的小球数量。传质性:取一定数量固定化菌剂投入盛有200 mL GM液体培养基(含10 mmol/L铝离子)中培养,48 h后测定培养液中OD600值。
1.4 田间试验设计
田间试验于2018年6月布置于安徽省黄山市屯溪示范茶场,地处118.27°E,29.69°N,海拔143.4 m,年平均降水量1 670 mm,年平均气温15.8℃,属北亚热带湿润性季风气候。试验茶园0~20 cm土层土壤的基本理化性质为:pH值4.68,有机质15.6 g/kg,总氮1.05 g/kg,碱解氮86.50 mg/kg,有效磷(Olsen-P)32.76 mg/kg,速效钾47.97 mg/kg,铵态氮43.8 mg/kg。茶树品种为当地群体种。试验共设置4个处理:分别为CK(空白对照)、T1(2 250 kg/hm2商品有机肥+WYS2菌悬液,108cfu/g有机肥)、T2(2 250 kg/hm2商品有机肥+WYS2固定化菌剂,108cfu/g有机肥)、OM(2 250 kg/hm2商品有机肥对照)。试验开始于2018年6月上旬,距茶树行20 cm处开沟施肥,开沟深度为15~20 cm,2018年7月中旬取样。采用完全区组设计,3次重复,小区面积3 m×5 m=15 m2。整个试验于2018年8~10月重复一次,试验结果相似。
1.5 土样采集和指标测定方法
土壤取样时间为试验处理40 d后,采集0~20 cm土壤样品,每个小区随机取5点,同小区混合后过2 mm筛,平均分成两份,一份新鲜保存以测微生物性状,一份风干后测土壤养分性状。土壤微生物区系采用高通量测序法,测序采用Miseq(Illumina,美国)高通量平台,选用的引物针对真菌ITS1-2区。前引物序列为5’-CTTGGTCATTTA GAGGAAGTAA-3’,后引物序列为5’-GCTGC GTTCTTCATCGATGC-3’[17]测序后的DNA序列拼接,同时对序列的质量和拼接效果进行质控过滤,然后按照barcode标签序列识别并区分样品得到有效数据。采用Usearch软件(vsesion 7.1 http://qiime.org/),设置97%相似性,对有效DNA序列数据进行操作分类单元(OTU)统计和分类[18]。测定土壤有机质含量采用重铬酸钾氧化容量法-外加热法;测定全氮含量采用半微量凯式定氮法;测定碱解氮含量采用碱解扩散法;测定有效磷含量采用碳酸氢钠提取-钼锑抗比色法(Olsen-P);测定速效钾含量用乙酸铵浸提-火焰光度法;测定铵态氮含量用氯化钾提取-靛酚蓝比色法[19]。
1.6 数据处理
试验数据用SPSS 22.0进行统计和方差分析,用LSD法比较处理间的差异显著性,用Origin 8作图。Miseq测序后的物种分类是利用blastn将OTU序列与对ITS真菌核糖体数据库(http://rdp.cme.msu.edu/misc/resources.jsp)进行比对,筛选出OTU序列的最佳比对结果,并对比对结果进行过滤,满足相似度>90%且coverage>90%的序列被用来分类,不满足条件的序列则被归为unclassified,样本聚类树图是根据物种多样性距离矩阵进行层次聚类(Hierarchical cluatering)分析,再使用非加权组平均法UPGMA(Unweighted pair group method with arithmetic mean)算法构建,反映出样品间的相似性和差异,以上分析均利用R软件(version2.15.1,http://www.r-project.org/)完成。
2 结果与分析
2.1 耐酸铝促生菌的筛选与鉴定分析
用S-LB培养基逐级提高铝离子浓度降低pH值,分别从5个地区的茶园土壤中纯化、筛选到4株耐酸铝能力较强的菌株。由于茶树对氮素的需求较大,占干物质重的3.5%~5.8%[20]。因此对这4株菌进行促生特性复筛时以无氮生长和对有机质矿化的产氨特性为主要参考。其相关促生指标如表1所示,其中菌株WYS2可在无氮培养基中生长,同时具有产氨和较强生长素分泌能力,因此选择该菌为材料进行下一步试验。
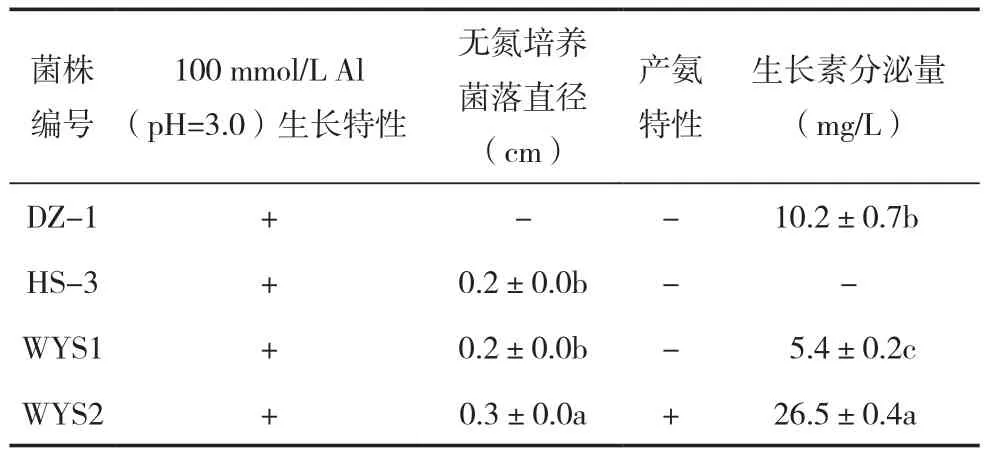
表1 4株耐酸铝菌株的促生特性
菌株WYS2在S-LB平板表面生长的菌落呈圆形、红色,表面光滑、边缘整齐(图1),通过分子生物学鉴定发现,其26S rRNA D1/D2序列与红酵母菌(Rhodotorula spp.)26S D1/D2区核糖体序列相似度达100%,其系统发育树如图2所示。因此将菌株WYS2命名为Rhodotorula sp.WYS2,将其序列保存于美国国立生物技术信息中心(NCBI)的GeneBank中,登录号为KY670833。
2.2 固化菌剂特性研究
由表2可知,4%海藻酸钠(SA)+1%琼脂(AG)+2%包菌量制备的1#固定化小球的溶胀率最低、完整性最高,表明其机械强度最高,但生长传质性能较差,培养48 h后培养液中的菌体浓度较低;同样包埋剂浓度条件下增加包埋菌量的2#固定化小球其生长传质性能也较差,表明包埋剂浓度影响菌株从球体到外部的穿通性。降低SA并升高AG浓度后发现,球体的生长传质性能提高,但包菌量较大处理(4#)的球体稳定性较差,在水中曝气一定时间后容易发生溶胀现象。而使用1%SA+2%AG包埋2%菌体制作的小球(3#),在水中曝气时的溶胀率变化较低,200 r/min搅拌4 h过程中所有小球表面保持光滑完整,溶液保持澄清,同时其生长传质性能也较好。因此选择3#小球作为下一步试验的材料,其外表形状如图3所示。
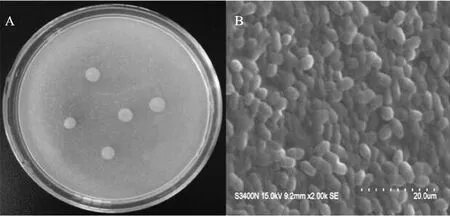
图1 菌株WYS2形态特征

图2基于26S序列构建的菌株WYS2系统发育树
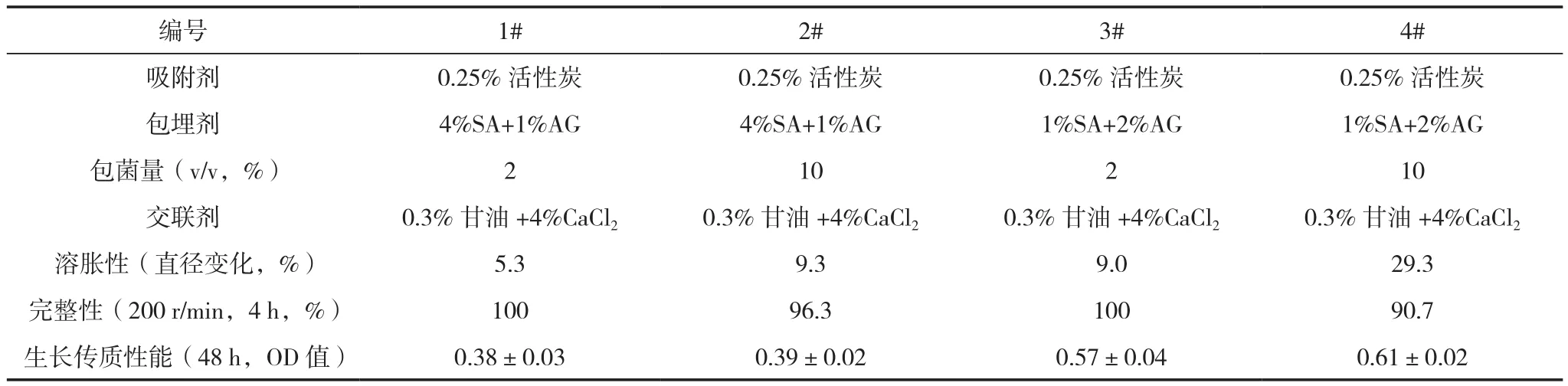
表2 不同包埋剂量制备出的固定化小球性能测试

图3 固定化菌剂
2.3 促生菌的土壤定殖效果
对土壤真菌宏基因组高通量测序以探究施用固化菌剂后菌株Rhodotorula sp.WYS2在茶园土壤中的定殖效果和对土壤真菌的影响。从土壤定殖效果来看,有机肥+固化菌剂处理(T2)的土壤中Rhodotorula(红酵母菌)基因序列数量约为有机肥+菌悬液处理(T1)的293倍(表3),表明T2处理在较长的时间内可以保持红酵母菌的种群密度。从真菌的区系组成(图4)来看,在T2处理的土壤中红酵母菌基因丰度比例占土壤真菌总和的35.33%,是最为主要的真菌类群;而T1处理的红酵母菌基因丰度仅占真菌总量的0.12%;纯有机肥处理(OM)和空白对照(CK)中均没有检测到红酵母基因序列。其结果表明固定化技术使用后菌株WYS2在茶园土壤中具有良好的定殖效果,同时也增加了土壤青霉菌(Penicillium,占30.41%)、踝节菌(Talaromyces,占13.87%)和裸伞菌(Gymnopilus,11.04%)等在土壤真菌中的丰度比,而其它各处理及对照的真菌区系主要是由未分类的真菌属组成。从区系组成的相似度聚类结果来看,T1处理和纯施有机肥处理(OM)的真菌群落组成极为相似,同时与对照组真菌群落组成也较为相似,这可能由于直接将菌悬液与有机肥接种后WYS2在土壤中的定殖效果不佳,未对土壤原著菌群造成影响有关;另一方面,T2处理的真菌群落结构与其他处理间存在较大差异。
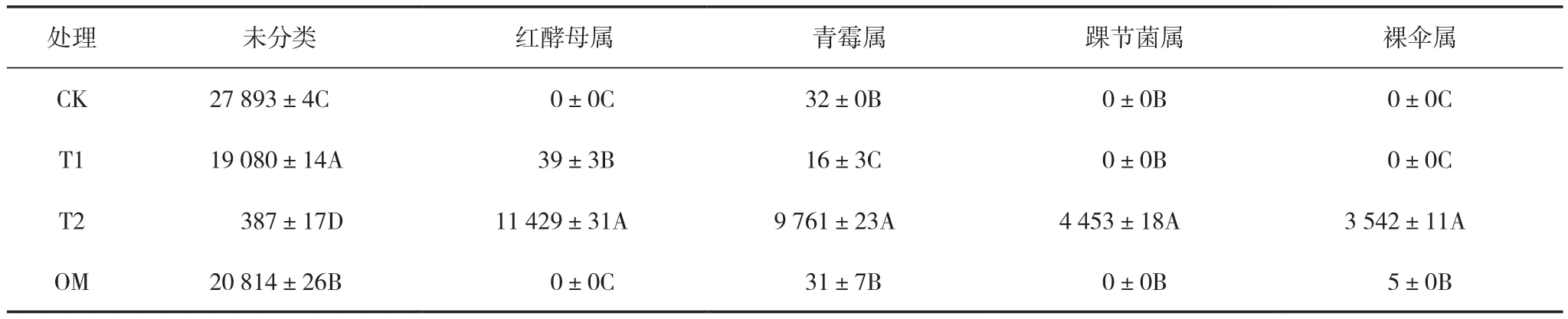
表3 各样本主要菌种属水平上序列数(前5) (条数/g土)
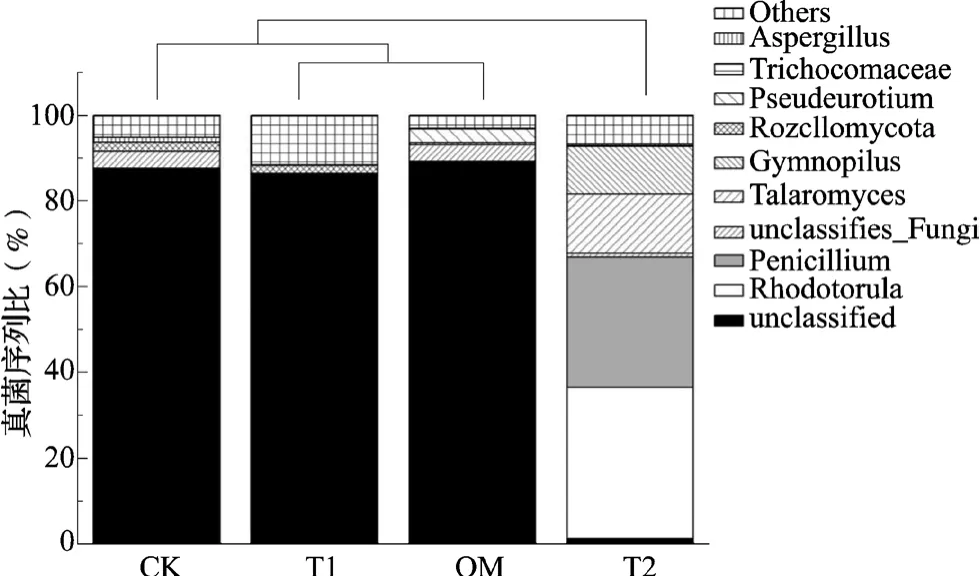
图4 土壤真菌区系及聚类图
2.4 施用固定化菌剂对茶园土壤养分性状的影响
如表4所示,有机肥+固定化菌剂处理(T2)、有机肥+菌悬液处理(T1)和有机肥施用处理(OM)与空白对照(CK)相比,土壤养分均有显著增加,但施用有机肥的3个处理之间的土壤有机质、全氮含量无显著差异。此外,T2处理显著提升了茶园土壤的碱解氮、速效钾和铵态氮含量,其碱解氮含量与T1相比增加了23.4%,与OM处理相比增加了39.8%;其速效钾含量较T1和OM处理分别提高了25.1%和18.1%;对于茶树最易吸收利用的氮素形态(铵态氮)含量,T2处理较T1处理增加了36.4%,较OM处理增加了45.1%,而有效磷的含量T2与T1处理无显著差异。因此从茶树的需肥规律和施肥效果来看,含红酵母菌WYS2的固定化菌剂+有机肥的处理有助于茶园土壤肥力的提升。在该处理中红酵母菌WYS2基因在土壤中有较高的丰度比,土壤中有效态氮、磷和钾的养分含量最高,其中碱解氮、铵态氮和速效钾含量均显著高于其它处理,而有机肥接种红酵母菌WYS2菌悬液的处理,红酵母菌WYS2基因在土壤中的丰度比较低,同时除土壤有效磷外,氮和钾的有效态养分含量与纯有机肥处理无显著差异。
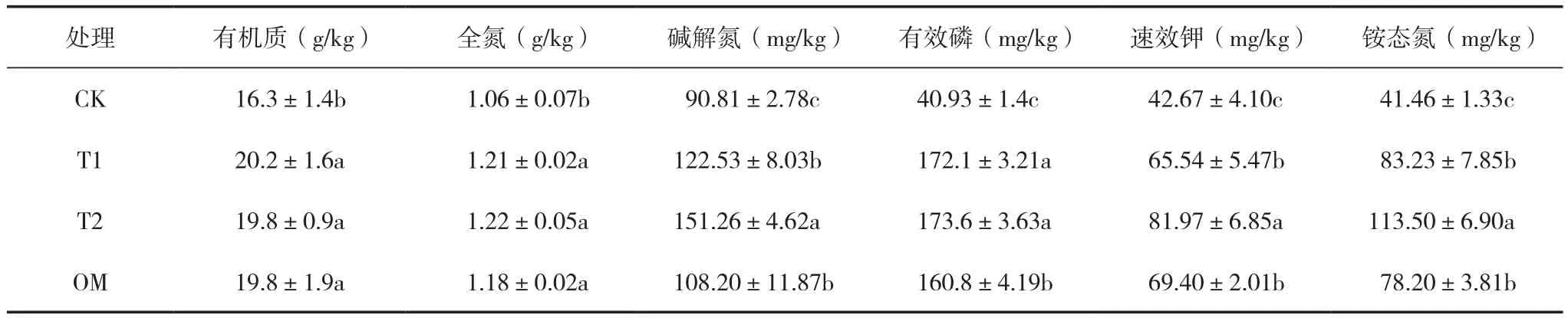
表4 施用固定化菌剂对土壤养分的影响
3 讨论
本研究筛选获取了红酵母菌属的一株酵母菌,其具有良好的耐酸铝特性,是酸性土壤中常见的土壤真菌,也是对植物生长有促生作用的一类菌群[21-22]。红酵母属在生长过程中能合成大量的不饱和脂肪酸、类胡萝卜素和生长因子等高附加值和营养价值的代谢产物,因此已被工业化培养用于油脂生产[23]、保健品生产[24]和水产养殖[25]等领域,而对红酵母属真菌在茶园土壤中的定殖利用和养分转化作用方面的研究报道尚少。植物促生功能菌结合有机肥的施用在一定程度上具有促进有机肥中养分的转化效率、增加产量、提升品质和保护环境等优势和特点,被认为是提高肥料利用效率、减少化肥施用的有效措施之一[6]。但由于功能菌群需在土壤中定殖、繁殖后方可发挥效用,而菌群的生长又具有周期性,肥效见效过程较长,同时,微生物活性受很多因素影响,导致施用后的短时期内(25 d)功能菌数量就急剧减少,效果不稳定[4,26],这与本研究中利用游离菌剂结合有机肥施用的结果相类似,本研究中40 d后红酵母菌WYS2在土壤中定殖数量较低,基因丰度仅占土壤真菌比例的0.12%。而固定化后配合有机肥施用的结果表明,在施用40 d后可显著提高红酵母菌WYS2在土壤中的定殖效果,同时可改变土壤真菌群落结构。
氮素和钾素是茶树生长发育不可或缺且需求量最大的两类矿质元素,在高产优质茶园中,土壤碱解氮和速效钾均应≥100 mg/kg,同时研究表明茶树吸收利用铵态氮能力较强,而对硝态氮的利用能力较差[27]。吴志丹等[28]认为纯有机肥施用会提升土壤碱解氮和速效钾含量,但会降低土壤铵态氮含量,而配合50%~75%化肥(以氮素投入量计)可显著提高土壤铵态氮含量9.5~11.3倍。本试验中施用红酵母菌WYS2固定化菌剂后对土壤碱解氮含量的提升作用高于前者的试验结果,对铵态氮含量的提升作用低于前者的试验结果,这种差异可能是两地土壤性状和有机肥种类等因素造成,例如,其有机肥处理中土壤铵态氮含量仅为7.61 mg/kg,而本试验有机肥处理土壤铵态氮含量为78.2 mg/kg。此外与任轶等[29]报道的木霉微生物肥相比,木霉对土壤有机质矿化为铵态氮的过程无显著作用,而本试验中红酵母菌WYS2固定化菌剂加有机肥处理可显著提升土壤铵态氮含量,因此本试验菌株更适合于茶树生长的养分需求。本试验有机肥接种红酵母菌WYS2固定化菌剂后对土壤有效磷和速效钾含量也有显著提升,其对土壤速效钾(与纯有机肥处理相比)含量的提升率为18.1%,较付学琴等[30]报道的硅酸盐细菌肥料对水稻土速效钾41.5 %的提升率而言略低,这可能是与硅酸盐细菌和红酵母菌两种微生物间不同的解钾特性有关。
4 结论
红酵母属的菌株WYS2具有良好的耐酸铝性和促生特性。
利用0.25%活性炭吸附2% WYS2菌体后,再用1%海藻酸钠+2%琼脂包埋制作的促生菌固化菌剂具有良好的机械强度和生长传质性。
制成的固定化菌剂配合有机肥施用,不仅提高了促生菌株在茶园土壤中的定殖效率,还可以影响土壤微生物群落结构,从而提高茶树可利用的氮素和钾素养分含量,改善土壤肥力状况。
