抗结核药物体外药代动力学/药效学研究模型的建立及应用
2020-04-07赵皎洁付雷王彬张蕾胡明豪陆宇
赵皎洁 付雷 王彬 张蕾 胡明豪 陆宇
结核病是由结核分枝杆菌(Mycobacteriumtuberculosis,MTB)引起的一种长期以来威胁人类健康的传染性疾病。据WHO[1]估算,2018年我国结核病新发患者约87万例,仅次于印度,高居全球第2位,其中耐多药/利福平耐药结核病患者6.6万例。由于抗结核药物的不合理使用造成的治疗效果不佳、耐药菌株的大量出现都对人类造成极大的生命威胁。在这样的形势下,我们迫切需要新的、更有效的药物来缩短和简化结核病尤其是耐药结核病长期而复杂的治疗过程,并且进一步提高疗效。
药代动力学/药效学(pharmacokinetics/pharmacodynamics,PK/PD)是将药物浓度与时间、抗菌作用结合起来,阐明抗菌药物在特定剂量/浓度和特定给药方案下抑菌或杀菌效果的时间过程,对有效剂量的选择和给药方案的制定有着十分重要的作用。近年来,抗结核药物PK/PD研究受到高度重视,并取得了重大成就,已被广泛应用于新药研发的全过程,为各期临床试验给药方案的制定、药物群体量效关系的探索、特殊患者群体和特定患者个体给药方案的调整等提供支持性数据,在药品审评、审批和监管决策等方面将发挥重要作用。
结核分枝杆菌中空纤维模型(hollow-fiber pharmacodynamic model of tuberculosis,HFM-TB)是一种可以模拟在体内的药代动力学和药效学过程的体外PK/PD模型。该模型可以承受更高的结核分枝杆菌负荷,模拟极端的给药剂量,是一个可以动态观察药物对细菌作用的方法。但国内对该模型的研究较少[2]。2019 年笔者在国内首次建立HFM-TB,并对异烟肼的PK/PD参数及目标靶值进行研究,对模型进行验证。
资料和方法
一、 实验菌株
结核分枝杆菌标准菌株H37Rv(ATCC27294)为北京市结核病胸部肿瘤研究所药物研究室保存的菌株。
二、 实验药物
异烟肼[Sigma公司(美国);批号:MKBW9046V;质量:5 g;纯度:≥99%]。
三、 仪器与试剂
C3008中空纤维培养筒(美国Fibercell 公司)、Infinite 200多功能酶标仪(瑞士Tecan公司)、IMH750-S SS恒温培养箱(美国Thermo Fisher Scientific公司)、Masterflex蠕动泵(美国Cole-Parmer公司)、双向泵(美国Fibercell公司)、Micro 21R高速冷冻离心机(美国Thermo Fisher Scientific公司)、安捷伦高效液相色谱(美国安捷伦科技有限公司)、Agilent Eclipse Plus C18色谱柱(填料粒径:3.5 μm;色谱柱内径:2.1 mm;色谱柱长度: 50 mm;美国安捷伦科技有限公司)。肉桂醛(北京伊诺凯科技有限公司;批号:KCDJ915)、7H9液体培养基干粉(美国BD公司;批号:6075662)、7H10培养基干粉(美国BD公司;批号:262710)、Middlebrook OADC增菌液(美国BD公司;批号:212351)、吐温80(北京索莱宝科技有限公司;批号:301C052)、丙三醇(国药集团化学试剂有限公司;批号:20180223)。
四、最低抑菌浓度(MIC)测定
Alamar blue法。异烟肼用蒸馏水溶解制成初溶液(储备液),灭菌后,使其终浓度为10 μg/ml,并进行2倍稀释11次。选取结核分枝杆菌H37Rv标准株将其培养2~3周的培养物制成菌悬液,接种到含0.05%吐温80、10% OADC(氯化钠、牛血清白蛋白、葡萄糖、过氧化氢酶、油酸混和物)营养添加剂的7H9培养基中,37 ℃静止培养1~2周,生长至浊度为McFarland 1[相当于108菌落形成单位(CFU)/m1]时稀释接种到含药的7H9液体培养基(含10% OADC)中,菌液的终浓度为106CFU/ml。实验设无药对照,置37 ℃培养7 d后每孔加入20 μl Alamar blue、12.5 μl 20%吐温80。将添加好指示剂的96孔板37 ℃培养过夜。观察颜色,并用多功能酶标仪测定96孔板Alamar blue荧光值,计算MIC(MIC值定义为荧光值的抑制≥90%的最低药物浓度)[3]。
五、HFM-TB的建立
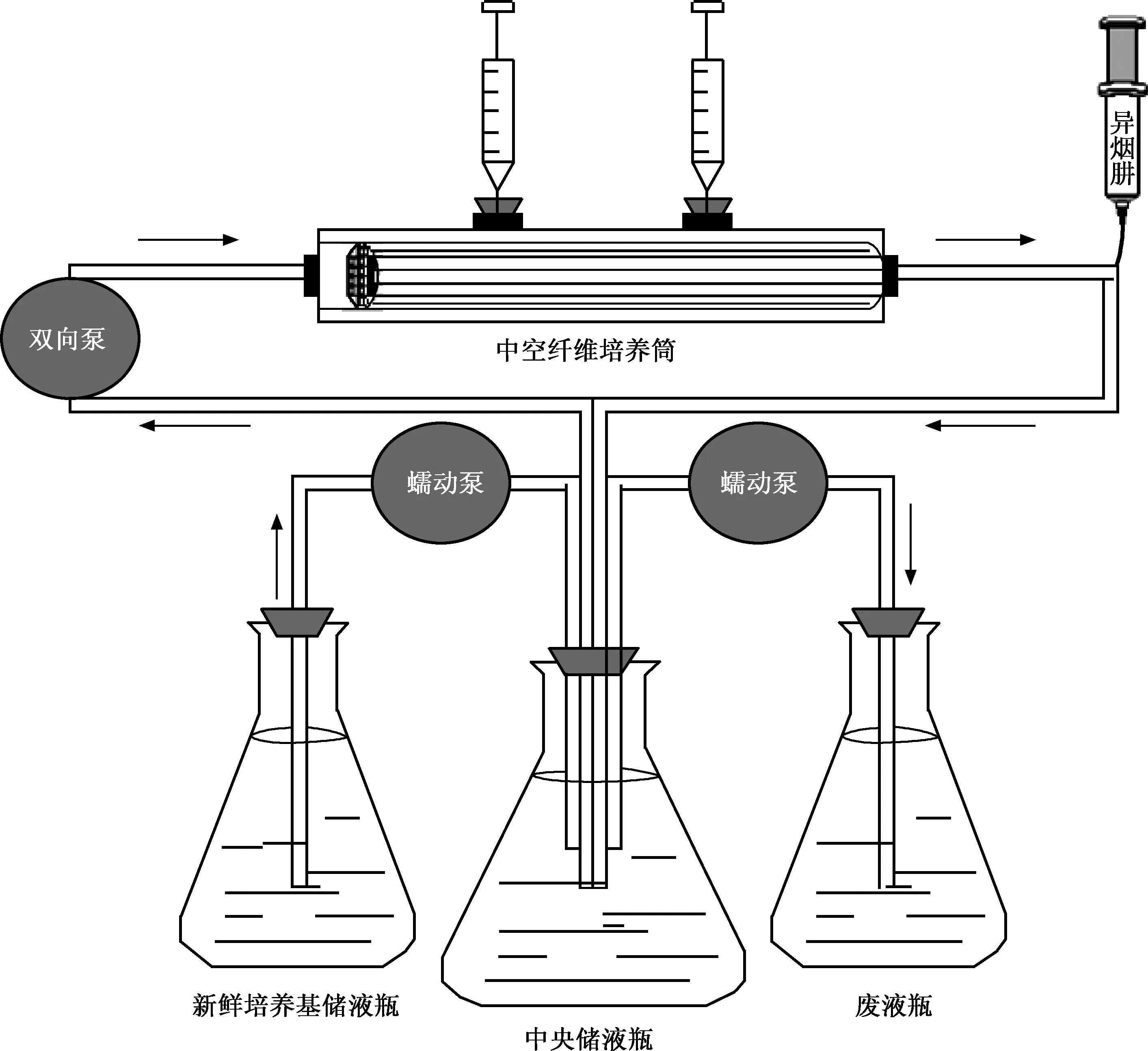
图1 HFM-TB示意图
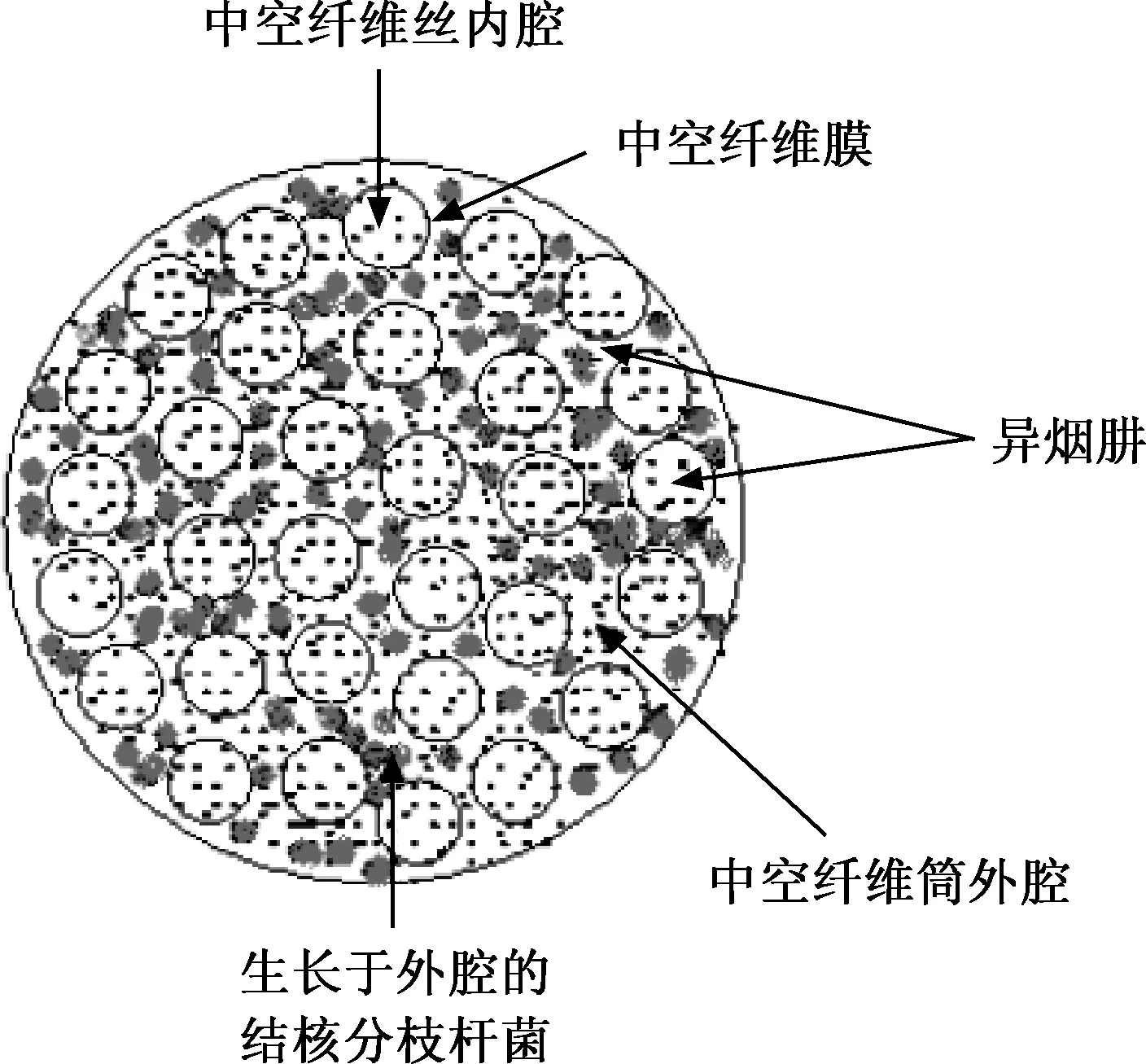
图2 中空纤维培养筒横截面示意图
该模型由中央室、新鲜培养基储液瓶及废液瓶3个部分组成。其中中央室由中央储液瓶、中空纤维培养筒和连接中央贮液瓶和中空纤维反应器的软管通路构成 (图1)。在人体中存在于血液中的药物穿过毛细血管壁到达病灶,与结核分枝杆菌接触并发挥作用,该系统正是模拟了这个过程。中空纤维是一种装在塑料外壳里的毛细半透性管,可以模拟肺部毛细血管 (图2)。中空纤维腔外的腔隙称为中空纤维培养筒外腔,结核分枝杆菌即培养于此腔隙。结核分枝杆菌由于体积太大无法通过中空纤维上的孔隙因而无法进入中空纤维内腔。采用蠕动泵将新鲜的培养基从储液瓶中泵入中央室,将废液以相同的流率泵出至废液瓶,保持中央室内培养基总体积不变,使药物不断稀释,药物浓度随着时间的延长而逐渐降低,以模拟药物在体内代谢的过程。培养基在中央室内循环,营养物质(小分子)从中空纤维内腔扩散到外腔。药物通过注射泵泵入中央室进行给药,并通过中空纤维上的孔隙弥散进入和排出外腔。在实验过程中中央室均置于37 ℃孵箱中,以模拟结核分枝杆菌在体内生长时的环境温度。
将中央室的容积设置为250 ml,采用慢乙酰化型人群异烟肼的血浆半衰期(t1/2),约为2.2~4.4 h[4]。通过改变培养基进出HFM-TB的流率来控制异烟肼在体内的消除速率。为了模拟4.1 h的半衰期,使用流率公式(流率=中央室容积×ln2/t1/2)进行计算后,将蠕动泵泵入新鲜培养基的流率设置为42.3 ml/h。
六、异烟肼剂量范围研究
将结核分枝杆菌标准株H37Rv接种到含0.05%吐温80、10% OADC营养液的7H9培养基中,37 ℃静止培养14 d至对数生长期。将菌液接种到不含药7H10培养基上进行菌落计数,在添加了0.2 mg/L异烟肼的7H10培养基上测定自发突变频率。然后取部分菌液进行稀释,向6个系统中每个中空纤维培养筒内接种15 ml终浓度为1×106CFU/ml的菌液。
接种后24 h开始给药,实验模拟了0、25、50、150、300和1200 mg/d的异烟肼剂量的血清浓度时间分布(表1)。

表1 异烟肼给药剂量与模拟Cmax表
选择这些剂量是为了能够测试剂量范围更充足,考虑到急性摄入1500 mg的异烟肼对患者是不安全的,所以本次实验设定了1200 mg作为最高剂量。给药每日1次,共给药7次。
在异烟肼给药后的48 h内对每个HFM-TB的中央隔室采样14次,测定7H9液体培养基中异烟肼浓度,以验证系统可以达到预期的血药浓度时间分布。在次日给药前采集中空纤维培养筒外腔的结核分枝杆菌培养液1 ml,以离心半径8.6 cm,8000 r/min 离心10 min,弃800 μl上清,再加入800 μl 生理盐水,以减少异烟肼残留。将处理好的菌液接种在不含药7H10培养基上进行菌落计数,接种在含0.2 mg/L 异烟肼的7H10培养基上测定耐药发生情况。
七、异烟肼浓度测定
1. 样品前处理方法:取400 μl样品,加入800 μl浓度为50 μg/ml的丙硫异烟胺-乙腈溶液,涡旋振荡3 min,充分混匀后,以离心半径8.6 cm,14 000 r/min离心10 min。取1 ml上清经氮吹浓缩后加入60 μl 0.5%肉桂醛甲醇溶液,超声溶解。于60 ℃水浴锅中衍生化反应30 min。以离心半径8.6 cm,14 000 r/min 离心10 min,取上清置于高效液相色谱进样瓶中。
2.高效液相色谱检测方法: 设置进样体积6 μl,流动相流率0.22 ml/min,流动相比例B(乙腈)∶C(10 mmol乙酸铵-水溶液,pH=5)=25∶75;检测波长:335 nm;色谱柱:Agilent Eclipse Plus C18色谱柱(填料粒径:3.5 μm;色谱柱内径:2.1 mm;色谱柱长度:50 mm)。
八、PK/PD参数计算方法
使用PKSolver[5]以及GraphPad软件进行PK/PD 参数的计算,以及图像绘制。
结 果
一、HFM-TB中PK参数
将取得的7H9培养基样本中的异烟肼浓度进行测定,根据获得的结果绘制HFM-TB中异烟肼给药后达到的药物浓度-时间曲线图,如图3所示。实验中HFM-TB内异烟肼测定浓度与预测浓度的拟合直线公式为y=0.99x-0.07,斜率为0.99,r2>0.99。因此系统中达到的异烟肼浓度与预测值相同(图4)。
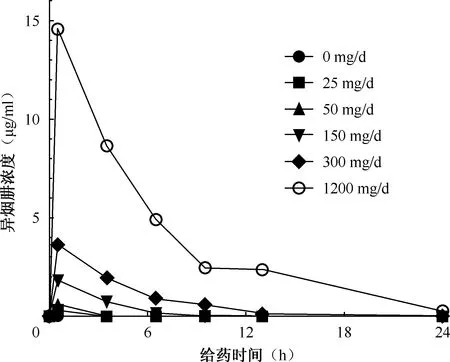
图3 HFM-TB中异烟肼药物浓度-时间曲线

图4 异烟肼药物浓度预测值与实测值准确度关系
二、异烟肼对H37Rv结核分枝杆菌标准菌株MIC及自发突变频率测定结果
异烟肼对H37Rv的MIC为0.038 mg/L。本实验所用菌株对0.2 mg/L异烟肼耐药的自发突变频率为2.2×10-5。
三、不同异烟肼给药剂量对结核分枝杆菌作用结果
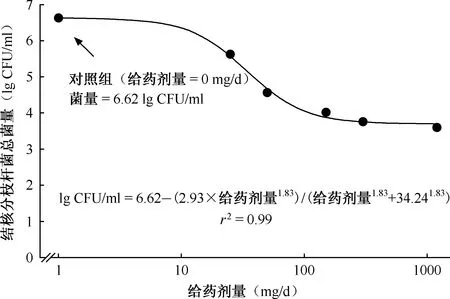
图6 第2天异烟肼剂量与杀菌作用关系图
如图5所示,在异烟肼给药前每个HFM-TB中的初始菌量为(6.06±0.07) lg CFU/ml。在整个实验过程中,对照组的菌量始终处于上升的阶段。在给药第3天后各剂量组总菌量几乎不再降低,随着治疗时间的延长而菌量出现回升的现象。当异烟肼的早期杀菌作用停止时,25~1200 mg/d组的剩余菌量分别为5.63、4.57、4.03、3.76、3.60 lg CFU/ml,并没有降至“0”。
四、 异烟肼早期杀菌活性(early bactericidal activity,EBA)及耐药情况
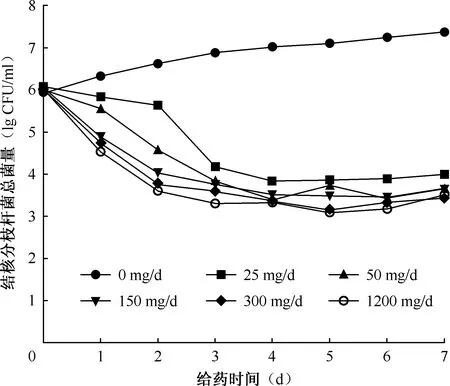
图5 不同给药剂量下结核分枝杆菌菌量随时间变化曲线图
由于给药3 d后早期杀菌作用几乎停滞,故采用各组异烟肼给药剂量和治疗前2天的结核分枝杆菌总菌量进行计算。利用抑制效应的Sigmoid Emax模型对异烟肼的给药剂量与早期杀菌作用效果关系进行模拟,本研究采用的是Hill模型:E=Econ-{Emax×(C)H/[(C)H+(C50)H]},其中E为某时间点结核分枝杆菌菌量,Econ为对照组菌量,C为异烟肼暴露浓度,C50为50%最大杀菌效应时的异烟肼暴露量,H为Hill常数。结果如图6所示。
早期杀菌效应曲线下降最明显的部分发生在25~150 mg/d的剂量范围内,而在150~1200 mg/d的剂量范围内杀菌作用基本停止,随着剂量提高杀菌效果并没有明显提高。
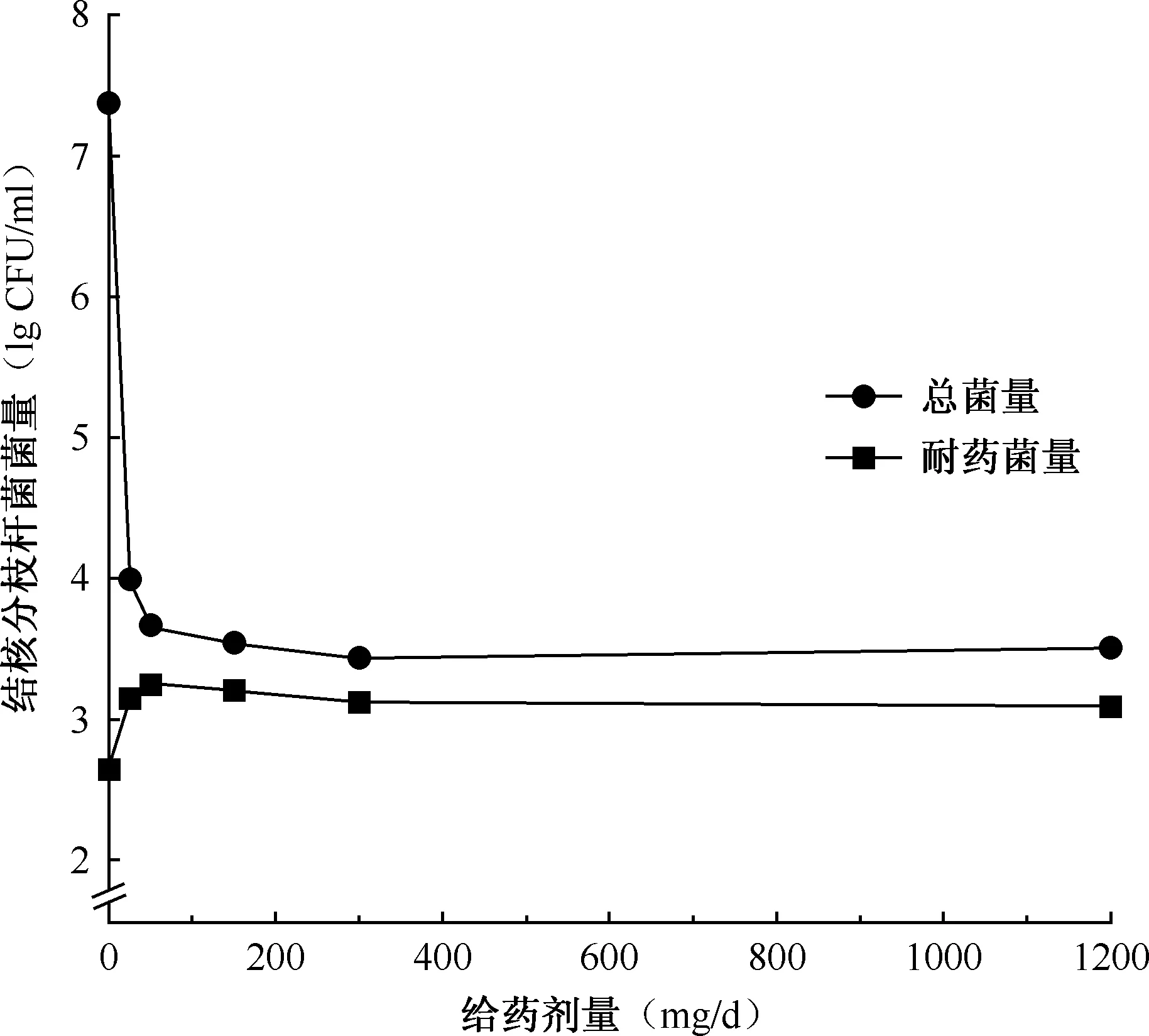
图7 第7天总菌量和0.2 mg/ml异烟肼耐药菌量与给药剂量作用关系图
由于在实验后期,菌量出现回升,所以对HFM-TB内的结核分枝杆菌耐药性进行评估,以分析导致菌量增加可能的原因。经过7 d的给药,HFM-TB内对照组的结核分枝杆菌耐药率为1.92×10-5,与第0天相比没有太大差异。而与对照组相比,所有异烟肼处理的HFM-TB的耐药率均有较大升高,50~1200 mg/d剂量组结核分枝杆菌耐药菌群在所有菌群中所占比例≥39%,尤其在异烟肼剂量为150、300 mg/d时分别为4.6×10-1和4.9×10-1(图7)。总菌量的上升可能是耐药菌群的菌量增长导致的。
五、异烟肼抗H37Rv的PK/PD参数计算结果
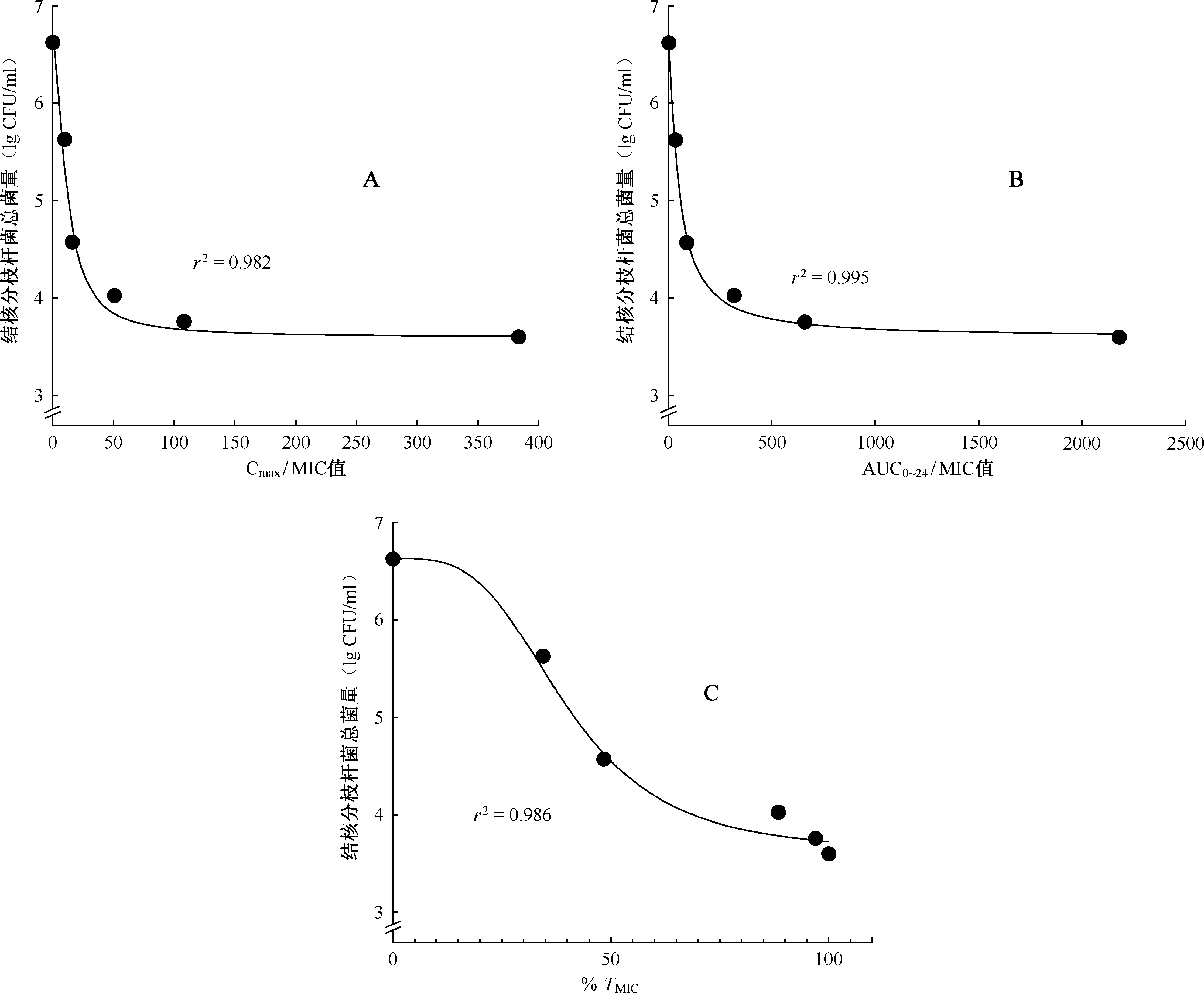
A:游离药物峰浓度与MIC的比值(Cmax/MIC);B:游离药物的血浆药物浓度-时间(0~24 h)曲线下面积(AUC0~24)与MIC的比值(AUC0~24/MIC);C:游离的药物浓度高于MIC的时间占给药间期的百分比(% TMIC)图8 给药第2天各PK/PD参数与杀菌作用关系图
同上根据Hill模型,对3个PK/PD参数与异烟肼杀菌作用效果的关系进行模拟。从图8可以看出,在给药第2天3条曲线中游离药物的血浆药物浓度-时间(0~24 h)(AUC0~24)/MIC与杀菌作用关系拟合效果最好,r2值最高为0.995。拟合曲线公式为lg CFU/ml=6.62-[3.02×(AUC0~24/MIC)1.213/[(AUC0~24/MIC)1.213+52.231.213]。其中Emax为3.02 CFU/ml,半最大效应浓度(EC50)为AUC0~24/MIC=52.23。除此之外,其赤池信息量准则(Akaike information criterion,AIC)值也最低(为-15.18)。所以认为AUC0~24/MIC是与异烟肼杀菌作用效果拟合最好的PK/PD参数。
讨 论
抗结核药物PK/PD研究贯穿于抗结核药物研发的各个阶段,PK/PD参数的确定已经成为新型抗结核药物开发过程中的重要组成部分[6]。临床前PK/PD模型是评价单独使用不同剂量的抗结核药物或与其他抗结核药物联合使用的疗效的有力工具。主要的PK/PD参数有Cmax/MIC、AUC0~24/MIC、%TMIC,在新药开发的临床阶段PK/PD研究的数据可用于蒙特卡罗模拟,以预测抗结核药物的最佳剂量,防止耐药性出现,并建立敏感性断点[7]。为最佳的给药方案提供参考,并可以更好地预测药物开发项目成功与否[8-9]。
PK/PD研究分为非临床阶段和临床阶段两部分,而非临床研究又包括体外PK/PD研究和实验动物体内PK/PD研究。体外PK/PD模型主要包括扩散模型和稀释模型,中空纤维系统模型是一种常用的扩散模型。体外PK/PD研究可以借助一些体外装置来模拟药物在体内的药代动力学和药效学过程,中空纤维系统就是其中一种模型。由于具有多种优点,与动物模型相比,体外模型更适合于测试和鉴定药物的时间或浓度依赖性。除此之外,与其他临床前模型相比,HFM-TB模型的独特之处是可以发现耐药性的出现,研究中得到的与耐药性抑制相关的浓度可用于设计更有效的剂量方案[10]。HFM-TB作为药物开发工具被欧洲药品管理局认可,得到的实验数据可以用于临床申报[11]。
体外中空纤维模型PK/PD研究中需要依据不同给药剂量在体内的血浆浓度进行PK参数的模拟,根据药物半衰期计算并设置新鲜培养基及废液的流出速度。于给药后48 h内进行PK样品的取样,可根据药物的代谢特点进行取样时间的设置,在给药前期由于药物浓度变化较快,应该增大取样密度。由于药物是存在于7H9液体培养基中,所以在PK样品取样结束后应尽快进行药物浓度测定,以防止药物结构不稳定而发生降解。目前的研究是以假设血浆浓度与药物作用位点浓度相似为前提,然而在大多数情况下体内效应位点浓度很难确定,这可能是本模型的局限性之一。
异烟肼在抗结核药物中具有最强的EBA[12],是抗结核治疗中最常用的抗结核药物,对其相关研究也较多。故本实验采用异烟肼作为实验药物对构建的HFM-TB 模型进行验证。临床上患者行抗结核治疗的前2~5 d内,联合治疗方案中的EBA主要来源于异烟肼对对数生长期结核分枝杆菌的杀菌作用[13-14]。在本研究中,异烟肼导致的结核分枝杆菌菌量的降低与在人体中EBA停止的时间点是相似的。但是即便在给药第3天异烟肼EBA结束后,系统内仍然存在未被杀灭的结核分枝杆菌。在最初的3 d内,敏感菌群被迅速杀灭导致细菌总数的降低。随着给药时间的延长,药物诱导产生的耐药菌群不断增殖,所以在给药第4天之后,各剂量组的菌量先后产生了不同程度的回升。除此之外,从图5看出,在给药7 d后,50~1200 mg/d剂量组结核分枝杆菌耐药率明显上升,耐药菌群在所有菌群中占比≥39%。因此,我们推断,异烟肼杀菌作用的停止在很大程度上是由耐药性的出现引起的,而这也与其他几种体外药敏试验中发现的结果一致[15-16]。体外测定细菌对药物的自发突变频率,一般采用静态系统。然而Srivastava等[17]的研究证明,由于适应性进化的一般原则,与暴露于静态系统中相比,动态系统更有可能引发耐药性的产生。这也解释了本研究采用的HFM-TB在较短时间引起明显耐药的原因。有研究表明,抗结核药物、氧化应激和其他环境应激导致的不稳定的表型突变可能比稳定的基因型突变更常见[18-19],治疗早期在外排泵的作用下,结核分枝杆菌对异烟肼表现出了耐受性或表型抗性,为其复制赢得了时间,直到特定基因发生突变[20]。所以本研究后续还应对耐药菌株进行基因测序,以确定耐药频率较高的根本原因。
EBA的临床研究表明,剂量-效应曲线斜率最大的部分位于0~150 mg/d之间[21],这与我们在HFM-TB中观察到的结果是相同的(图4)。但当剂量>150 mg/d时,随着给药剂量的增加,早期杀菌效果并没有大幅度提高。本研究中,在7 d给药治疗的早期阶段与异烟肼对结核分枝杆菌的杀菌作用最相关的PK/PD参数是AUC0~24/MIC。这与Jayaram等[22]使用结核分枝杆菌小鼠气溶胶感染模型的研究结果相似。对于结核病患者,异烟肼的AUC与EBA有很强的相关性[23],这也从另一个方面验证了本实验模型的构建成功。本次实验给药前2 d的Emax为3.02 CFU/ml,EC50为AUC0~24/MIC=52.23。而之前研究的参数估计为61.6[24],与本研究稍有差异,这种差异可能是由于测试菌对异烟肼(结核分枝杆菌减毒株H37Ra与结核分枝杆菌标准菌株H37Rv)敏感性的差异,或进行参数计算时采用的数据时间点不一致造成的。
本研究是在引进HFM-TB装置的条件下,进行了异烟肼抗结核分枝杆菌标准菌株H37Rv的体外PK/PD研究,确定了PK/PD靶值,通过与国外实验结果对比,验证了HFM-TB的构建成功。本研究首次在国内建立该模型,可以为后续国内抗结核新药早期的PK/PD研究奠定基础并提供方法学参考。
