癌细胞来源的外泌体携miR-205在鼻咽癌进展中的作用
2020-04-07汪庚明郭术楠张雷周燕营巧玲丁建明张亚军江浩项平
汪庚明, 郭术楠, 张雷, 周燕, 营巧玲, 丁建明, 张亚军, 江浩, 项平
(1.蚌埠医学院第一附属医院肿瘤放疗科,安徽 蚌埠 233000;2.蚌埠医学院癌症转化医学安徽省重点实验室;3.蚌埠医学院第一附属医院肿瘤胸外科;4.蚌埠医学院第一附属医院中心试验室)
鼻咽癌是一种源自于鼻咽部上部的鳞状细胞癌,在东南亚及我国南方地区呈高发状态。流行病学研究表明,近20年来,随着人们生活方式改善,高危人群的筛查,影像学及治疗技术的进步,鼻咽癌发病率呈下降趋势,但对高发地区来说仍是一项重大挑战[1-2]。目前研究认为遗传因素、环境因素及EB病毒 (EBV)是鼻咽癌发生的主要原因,在几乎所有低分化及未分化鼻咽癌中均检测到EBV的表达[1-4]。外泌体是一种能被多种细胞分泌的小囊泡,直径30~150 nm,刚开始被认为是一种细胞的废弃物,后续研究逐渐发现并证实外泌体的作用。来源于EBV感染细胞的外泌体在EBV感染及致病过程中发挥着重要作用,而EBV在鼻咽癌的发生发展过程中起着重要作用,提示外泌体在鼻咽癌的发生发展过程起着重要作用[5]。miRNAs是一类长度约为23 nt的来自真核生物的小分子非编码RNA,其作为致癌miRNAs或抑癌miRNAs,在肿瘤的发生发展过程中发挥着重要作用[6]。研究显示外泌体能够携带功能性蛋白、mRNA和miRNAs到邻近和远处的靶细胞,调节靶细胞的免疫功能,在血管生成、细胞增殖、肿瘤浸润和细胞间的信息交流中起着重要的作用[7-9]。进一步提示外泌体在鼻咽癌中的作用可能是通过miRNAs实现的[10-11]。而其中 miR-205参与了多种肿瘤的发生发展,例如乳腺癌、肾癌、胰腺癌[12-14]等,且miR-205是新发现的与鼻咽癌相关的miRNAs[15-16]。因此,本研究首先提取来自鼻咽癌细胞中的外泌体,并进一步检测miR-205在鼻咽癌细胞外泌体中的表达。
1 材料与方法
1.1 细胞系 SUNE-1-5-8F、SUNE-1-6-10B、SUNE-1鼻咽癌细胞系购于上海酶联生物科技有限公司,正常鼻咽上皮细胞NP69购于北纳生物公司。
1.2 主要试剂和仪器 培养细胞外泌体提取试剂盒 (E1310)购自于北京唯辉生物技术有限公司;Trizon Reagent、Ultrapure RNA超纯RNA提取试剂盒,HiFiScript cDNA第一链合成试剂盒,BCA试剂盒购于北京康为世纪生物技术有限公司;兔抗CD63及Flotillin多克隆抗体购于美国Abcam公司,批号分别为ab59479、ab41927;小鼠抗GAPDH单克隆抗体、辣根过氧化物酶标记山羊抗兔IgG(H+L)、辣根过氧化物酶标记山羊抗鼠IgG (H+L)均购于北京中杉金桥生物技术有限公司,批号分别为TA-08、 ZB-2301、 ZB-2305。
MF53倒置显微镜购于广州市明美光电有限公司;RT-6000酶标分析仪购于Rayto公司;UV-1600PC紫外可见分光光度计购于上海美谱达仪器有限公司;CFX ConnectTM实时荧光PCR仪购于伯乐生命医学产品 (上海)有限公司。
1.3 外泌体的提取 收集细胞培养基,2 000 g,4℃,离心10 min去除细胞和细胞碎片;转移2 ml清澈的上清液 (无细胞的培养基)到新的玻璃管1并放于冰上;在玻璃管2中,按照下列顺序依次加入外泌体提取试剂盒内溶液;涡旋混匀玻璃管2溶液5~10 s;将玻璃管2中的混合液添加到玻璃管1中;紧紧盖住玻璃管1,剧烈涡旋混匀30 s,在4℃静置20 min;混合液分层,用移液器小心移除丢弃培养基层,留下外泌体层;将管中的外泌体层转移到新的1.5 ml离心管中,然后5 000 g离心3 min,立刻移出并丢弃上层培养基颜色层,同时插入吸头直到管的底部将 “底层无色液体”完全吸出,管中只保留外泌体;重复5 000 g离心3 min,然后重复上一步骤。在室温下将管盖打开5~10 min晾干;加入约外泌体层4倍体积的1×PBS到管中。用移液器上下剧烈吹打40次使外泌体层重悬。在水平摇床上高速摇动管子10 min。在这中间,重复用移液器上下吹打几次;将管子5 000 g离心5 min,将上清液小心地转移到过滤柱中,不要碰到沉淀;将柱子1 000 g离心5 min,收集所有流出的液体;流出的是分离后的纯外泌体。
1.4 电子显微镜检测外泌体 将分离纯化得到的外泌体等体积加入PBS稀释,将稀释后的外泌体滴加于2 nm的铜网上,静置10 min,用滤纸轻轻吸干多余液体,后转移到4%的醋酸双氧铀溶液中10 min;取出铜网用滤纸吸干后,转移到1%甲基纤维素液滴上5 min,PBS洗涤后,室温晾干30 min,后于80 kV的透射电子显微镜下观察并拍照。
1.5 实时荧光定量PCR法检测外泌体中miR-205的表达 收集细胞,根据Trizon Reagent提取细胞总RNA,紫外分光光度计检测总RNA浓度及纯度(OD260/OD280说明RNA纯度良好),将RNA通过逆转录HiFiScript cDNA第一链合成试剂盒合成cDNA,70℃ 10 min,再迅速冰浴2 min,50℃ 15 min,85℃ 5 min。实时荧光定量PCR法进行扩增,操作体系:RNase Free dH2O29.5 μl,模板1 μl, 上游引物 1 μl, 下游引物 1 μl, 2×ULtraSYBR Mixture 12.5 μl;反应程序:预变性 95℃,10 min,变性95℃,10 s,退火60℃ 30 s,延伸72℃ 30 s,30次循环。扩增结果利用2-ΔΔCt法进行分析, △△Ct= △Ct试验-△Ct对照, △Ct试验= Ct目的-Ct内参, △Ct对照=Ct目的-Ct内参。 内参上游引物: 5′-GCTTCGGCAGCACATATACTAAAAT-3′,下游引物: 5′-CGCTTCACGAATTTGCGTGTCAT-3′, 产物长度89 bp;miR-205上游引物:5′-TCCTTCATTCCACCGGAGTCTG-3′,下游引物:北京康为世纪生物技术有限公司提供通用引物。
1.6 Western blot法检测CD63及Flotillin蛋白的表达 将适量的RIPA裂解液加入细胞中,裂解,离心收集上清液,获得总蛋白。BCA试剂盒对蛋白浓度进行测定。蛋白上样,进行凝胶电泳,后湿法转PVDF膜。一抗溶液 (兔抗CD63及Flotillin多克隆抗体、小鼠抗GAPDH单克隆抗体,稀释度1∶100)孵育,4℃过夜;二抗溶液 (羊抗鼠IgG、羊抗兔IgG,稀释度1∶1 000)中室温孵育1~2 h。滴加ECL曝光液,在凝胶成像系统中曝光。
1.7 统计学方法 采用SPSS 17.0软件进行统计学分析,计量资料采用均数±标准差表示,采用t检验,P<0.05为差异有统计学意义。
2 结果
2.1 外泌体形态 从SUNE-1-5-8F、SUNE-1-6-10B、SUNE-1鼻咽癌细胞系中分离出椭圆状、或圆形的泡状物。其中SUNE-1-5-8F细胞来源泡状物大小不均,直径40~130 nm,有完整的包膜;SUNE-1-6-10B细胞来源泡状物大小较为均一,直径约80 nm,有完整的包膜,且泡状物内电子致密物多;SUNE-1细胞来源泡状物大小均一,直径约100 nm,有完整的双层包膜,包膜光滑清晰,且泡状物内电子致密物较多;NP69细胞来源泡状物直径约为30~150 nm的膜性囊泡,有典型的“杯盘”形态。见图1。
2.2 外泌体特异性分子标志物的表达 来源于SUNE-1-5-8F、 SUNE-1-6-10B、 SUNE-1鼻咽癌细胞外泌体中的CD63及Flotillin蛋白表达量均显著高于来源于正常鼻咽上皮细胞 NP69(P<0.05),进一步证实此泡状物为外泌体。见图2。
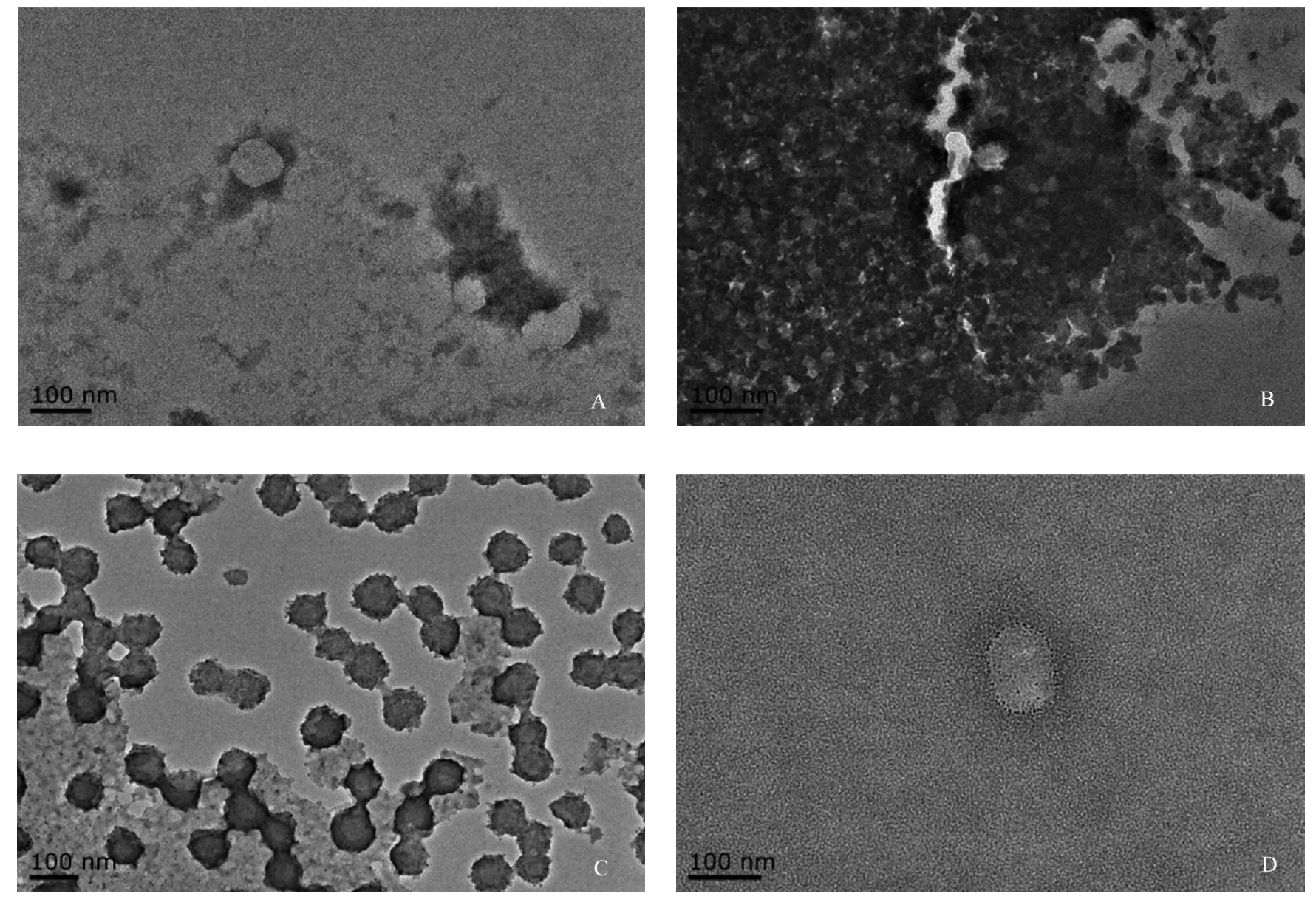
图1 电镜下观察鼻咽癌细胞及正常鼻咽上皮细胞中外泌体的形态 (×100)
2.3 来源于鼻咽癌外泌体中miR-205的表达 来源于SUNE-1鼻咽癌细胞外泌体中的miR-205表达量显著高于来源于正常鼻咽上皮细胞NP69(P<0.05)。 见图 3。
3 讨论
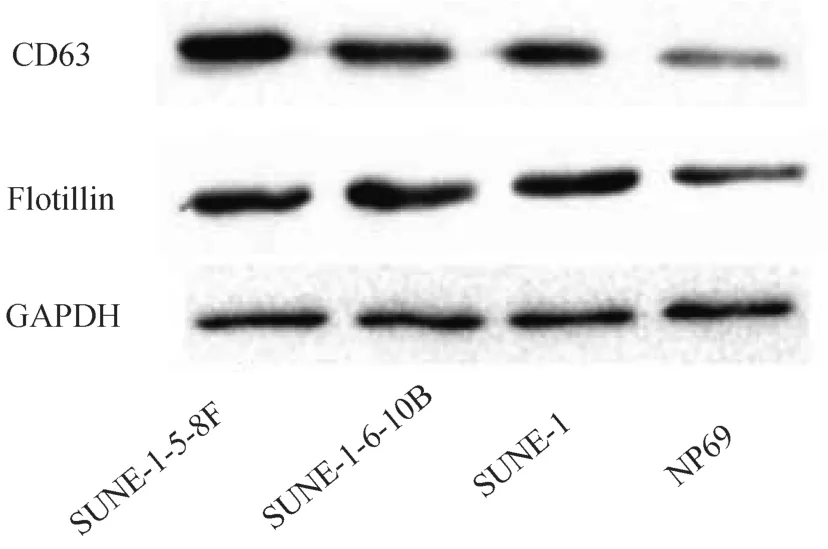
图2 外泌体特异性分子标志物的表达
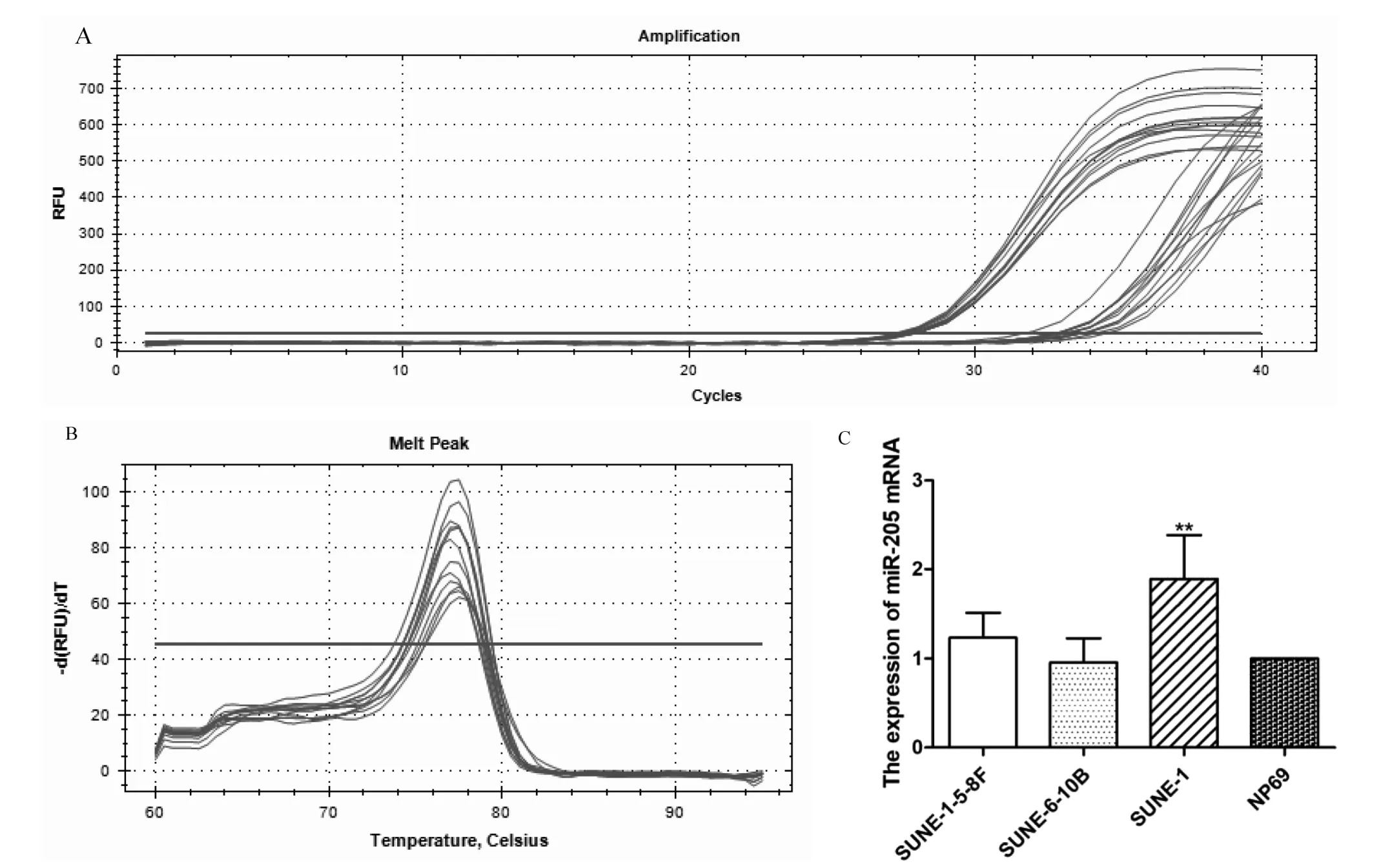
图3 来源于鼻咽癌外泌体中miR-205的表达
外泌体是一种起源于细胞内涵体的具有双层膜结构的囊性小泡,直径约30~150 nm,在电镜下呈椭圆形或球形。肥大细胞、树突状细胞、肿瘤细胞等多种细胞均能够分泌外泌体,外泌体能够稳定地表达CD63、CD8、TSG101等蛋白参与抗原的呈递,能够广泛存在于血液、唾液、精液等多种体液中。1993年发现外泌体时,仅仅认为外泌体是细胞代谢物的垃圾,后续研究发现外泌体含有独特的蛋白质、核酸和脂质等,具有独特的生理功能[7-9]。外泌体能够通过携带功能性蛋白、mRNA及miRNAs到靶细胞,对靶细胞的增殖、血管生成、细胞间的信息交流起着调节作用,进而作为新型的分子标志物参与肿瘤、心血管、肝、肾、脾等多种脏器相关疾病的诊断及预后[17-19]。最近研究发现癌细胞来源的外泌体所携的miRNAs参与鼻咽癌、乳腺癌等肿瘤组织中的发生、血管生成及侵袭转移等过程[10-11]。譬如,研究发现miR-483-5p、miR-29c-3p等miRNAs在鼻咽癌外泌体中高表达,miR-29b-3p、let-7d-5p、miR-100-5p及 let-7g-5p在鼻咽癌外泌体中低表达[11]。携带miR-21的外泌体进入受体细胞后能激活 STAT3,进而上调血管内皮生长因子(VEGF)表达,促进细胞恶性转化及血管生成,这一发现为肿瘤的治疗提供新的思路[20]。另外研究也发现MDA-MB-231乳腺癌细胞外泌体中miR-10b高表达,当此外泌体被非转移性的乳腺癌细胞HMLE摄取后,能够通过下调HOXD10及KLF4蛋白表达进而增强HMLE细胞的侵袭性[21]。miR-23a在鼻咽癌组织中高度被富集,其表达水平与微血管密度呈正相关,另外过表达的miR-23a促进了人脐静脉内皮细胞的增殖、迁移与血管生成,同时还促进了斑马鱼模型血管的生成;同时CNE2鼻咽癌细胞外泌体过表达miR-23a,并通过靶向调控TSGA10表达,进而介导血管生成,促进鼻咽癌转移[22]。在T细胞增殖和分化过程中,外泌体miR-214-24-3p增加了p-ERK、p-STAT1和p-STAT3的表达,同时降低了p-STAT5的表达。此外,通过体内和体外研究证实FGF11是miR-214-24-3p的直接靶点,外泌体miR-214-24-3p阻碍了腺病毒FGF11转染的T细胞的增殖、Th1细胞及Th17细胞分化,但诱导了Treg细胞分化,最终导致肿瘤的免疫抑制,影响鼻咽癌的疾病进程[23]。
miR-205最初是通过计算机软件在红鳍东方鲀和鼠的同源序列中被预测发现的,后在人和斑马鱼中被证实。人体 miR-205定位于染色体lq32.2的LOC642587基因中,具有显著的组织特异性,能够特异性地表达于人的胸腺、乳腺、前列腺等组织中,能够通过调控多种靶基因表达,参与肿瘤细胞的增殖、凋亡、分化、血管生成、耐药、侵袭转移等过程。而且miR-205在不同的肿瘤组织中表达具有差异性,在膀胱癌、卵巢癌、肺癌中高表达,而在乳腺癌、前列腺癌中低表达,在结肠癌组织中表达不具有差异性,说明miR-205既可以作为致癌miRNAs促进肿瘤的发生与发展,也可以作为抑癌miRNAs参与肿瘤的发生与发展[24-25]。研究发现肺癌组织中外泌体miR-205高表达[26]。另外通过miRNAs序列分析发现3株胆管癌细胞及1株正常人胆管细胞,发现胆管癌细胞外泌体中有38个miRNAs表达明显上调,460个miRNAs表达明显下调。从而说明外泌体miR-205参与了肿瘤的发生发展,但在鼻咽癌发生发展过程中的作用未知,因此本研究将对此展开探讨。
本研究首先采用试剂盒法提取了SUNE-1-5-8F、SUNE-1-6-10B、SUNE-1鼻咽癌细胞系及正常鼻咽上皮细胞NP69中的外泌体,并采用电镜及Western blot法来证实外泌体的存在。电镜结果表明鼻咽癌细胞中的泡状物大小较为均一,直径在30~150 nm,有完整包膜,同时囊泡内含有电子致密物。另外Western blot结果表明SUNE-1-5-8F、SUNE-1-6-10B、SUNE-1鼻咽癌细胞外泌体中的CD63及Flotillin蛋白表达量均显著高于来源于正常鼻咽上皮细胞NP69,进一步证实此泡状物为外泌体。紧接着本研究采用实时荧光定量PCR法检测来源于鼻咽癌细胞及正常鼻咽上皮细胞外泌体中miR-205的表达,结果表明来源于SUNE-1鼻咽癌细胞外泌体中miR-205表达量显著高于来源于NP69正常鼻咽上皮细胞外泌体,此结果与miR-205在鼻咽癌组织中的表达[27]趋势一致。
综上所述,鼻咽癌细胞和正常鼻咽上皮细胞均提取出外泌体,来源于鼻咽癌细胞及正常鼻咽上皮细胞外泌体中均有miR-205的表达,但是来自于鼻咽癌细胞的外泌体中miR-205高表达,提示miR-205可能作为外泌体携带物参与了鼻咽癌的发生发展,具体的作用机制有待于进一步探讨。
