棉铃虫鞣化激素基因克隆及分子特性分析
2020-04-07马星宇嵇玉洁薛玉莹杜孟芳魏纪珍尹新明刘晓光安世恒
马星宇,嵇玉洁,薛玉莹,杜孟芳,魏纪珍,尹新明,刘晓光,安世恒
(河南农业大学植物保护学院/省部共建小麦玉米作物学国家重点实验室,郑州 450002)
0 引 言
【研究意义】棉铃虫Helicoverpaarmigera,是棉花、玉米、番茄和烟草作物上危害较为严重的一类杂食性害虫。近年来,国内玉米等夏季作物种植结构的调整,棉铃虫抗药性有加重趋势,用药不规范及过量用药等问题突出,其对农业生产造成的损失逐年增加[1-2]。鞣化激素(bursicon)是由异源二聚体蛋白组成的一类神经肽类激素,在昆虫表皮发育及鞣化过程中扮演重要角色。了解昆虫体内重要激素的功能机制,对田间害虫绿色防控提供新靶标有重要意义。【前人研究进展】昆虫的体壁(外骨骼)不但能够避免虫体内水分的散失,而且能够有效抵御外界病原微生物的入侵、降低虫体遭受的环境机械物理伤害程度[3]。真皮细胞分泌形成的新表皮通常柔软脆弱,虫体得以延伸后,新表皮在短时间内被迅速鞣化,保护昆虫免受外界伤害[4]。Fraenkel和Hsiao[5](1962)对刚羽化的红头丽蝇Calliphoraerythrocephala颈部结扎,结果发现其胸部和腹部表皮不能正常黑化,Fraenkel 和Hsiao(1965)随后将导致这一现象的鞣化因子命名为鞣化激素(Bursicon,burs)[6]。除昆虫外,有关鞣化激素在甲壳类动物[7]、蛛形纲[8]和棘皮动物中也有报道[9]。昆虫在幼(若)虫各龄期及变态期均需蜕去旧表皮,形成新表皮,最终形成完整的外骨骼。此过程包含两个阶段,即前蜕皮期(pre-ecdysis)和蜕皮期(ecdysis)。其间有众多荷尔蒙(激素)参与蜕皮和新表皮的鞣化形成。蜕皮前期,虫体血淋巴中蜕皮激素(ecdysone,Ecd)滴度急速下降,蜕皮触发激素(ecdysis-triggering hormone,ETH)随之也释放出来[10]。Ecd与ETH的滴度变化进一步促进了羽化激素(eclosion hormone,EH)EH合成与释放,同时EH又促进ETH的分泌,这些激素共同作用,形成一个正调控循环,协同促进昆虫进行蜕皮[11]。EH又促进了甲壳类动心肽(crustacean car-dioactive peptide,CCAP)转录与活性多肽的释放,随着CCAP滴度的升高,预示着激素参与前蜕皮阶段进入尾声,蜕皮前期信号途径关闭。接下来昆虫进入蜕皮期,CCAP促进了鞣化激素达进,分泌的鞣化激素入血淋巴,与靶标受体结合后,迅速引起cAMP水平上升,进而并增强昆虫心脏的脉动,开启鞣化激素调控昆虫表皮鞣化的蜕皮后阶段[12-15]。在参与昆虫蜕皮过程众多激素中,鞣化激素较为特殊,它是一类天然异源二聚体肽类激素,由α亚基(Bursicon,burs)和β亚基(partner of burs,pburs)组成,可形成胱氨酸结构[16-17]。研究发现,其在脑、心侧体、咽侧体、胸神经节以及腹部神经节等中枢神经系统部位的匀浆中均检测到具有活性多肽[18]。利用鞣化激素特异性抗体和DNA探针,Dewey等[19](2004)发现,其在烟草天蛾Manducasexta、黑腹果蝇Drosophilamelanogaster等昆虫咽下神经节、胸神经节以及腹神经节均能够合成burs和pburs。除中枢神经系统外,鞣化激素在黑腹果蝇D.melanogaster中肠内分泌细胞也有表达,且在功能上与中枢神经互相独立。在激素水平上,几乎所有昆虫鞣化激素均由中枢神经系统合成并释放到血淋巴中,经由血淋巴循环到达目标组织或细胞,发挥功能[20]。【本研究切入点】影响棉铃虫幼虫生长发育的一些重要基因仍有待挖掘,如鞣化激素在棉铃虫中尚未报道。目前,国内外对鞣化激素的研究主要集中于烟草天蛾M.sexta[21]、黑腹果蝇D.melanogaster[22]、赤拟谷盗Triboliumcastaneum[23]、小菜蛾Plutellaxylostella[24]、禾谷缢管蚜Rhopalosiphumpadi[25]、桃蚜Myzuspersicae[26]、南亚实蝇Zeugodacustau[27]等模式昆虫,对棉铃虫幼虫生长发育调控功能的研究相对薄弱。研究利用分子生物学与生物信息学技术,获取棉铃虫鞣化激素相关序列。【拟解决的关键问题】以棉铃虫为材料,研究该基因的分子特性。利用分子生物学与生物信息学技术分析棉铃虫鞣化激素的2个亚基全长序列。利用qRT-PCR技术,研究鞣化激素α与β亚基在棉铃虫不同发育阶段和不同组织中的转录水平,为研究鞣化激素相关基因的分子特性和功能,以及激素引起的昆虫代谢通路和分子调控机制提供理论依据。
1 材料与方法
1.1 材 料
1.1.1 供试昆虫
棉铃虫为室内人工饲料饲养,饲养温度(26±1)℃,相对湿度65%,光周期16L∶8D。
1.1.2 主要试剂
总RNA提取试剂(Trizol Reagent)购自Invertrigen公司;体外转录试剂盒购自ABI公司;2×TaqDNA聚合酶、限制性内切酶(EcoRⅠ、HandШ等)、pMD19-T载体、DNA Marker、荧光定量试剂盒(SYBR Primer Script RT-PCR Kit)、反转录试剂盒(Prime ScriptTM1st Strand cDNA Synthesis Kit)购自宝日医生物技术(北京)有限公司;DNA凝胶回收试剂盒、产物纯化试剂盒和质粒提取试剂盒、IPTG(异丙基-β-D-硫代半乳糖苷)以及X-gal(5-溴-4-氯-3-吲哚-D-半乳糖苷)为生工生物工程(上海)股份有限公司产品,使用的其它试剂均为国产或进口分析纯。
1.2 方 法
1.2.1 棉铃虫鞣化激素基因的获得及同源序列
实验室前期获得的棉铃虫转录组unigene建立本地数据库,利用家蚕鞣化激素氨基酸序列(GenBank登录号,α亚基NP_001091845.1;β亚基NP_001037289.1)作为诱饵蛋白分别进行本地核苷酸tBlastn检索比对,钓取棉铃虫候选基因核苷酸序列,将e值<1的序列逐个在线同源比对,将序列同源比对结论为鞣化激素的候选序列进一步分析,获得棉铃虫鞣化激素α与β亚基候选cDNA序列,与棉铃虫基因组数据库比对,验证其正确性;搜集其他已知昆虫鞣化激素氨基酸序列,根据搜集到的鞣化激素氨基酸序列,在MEGA 7(7. 0.14)软件中,选择Jones-Taylor-Thornton(JTT)模型,利用最大相似法(maximum likelihood method)构建系统进化树进行聚类分析[27]。
1.2.2 棉铃虫不同发育期组织样品解剖
在棉铃虫卵期至成虫期收集不同发育期虫体(卵),包括雌性成虫新产下的卵(2 h内)作为第1 d,其余依次后推(卵期1~3 d),幼虫期各龄(包含蜕皮期)、蛹(包含预蛹期)与成虫(羽化后前2 d成虫),卵期取整卵(50粒为1组,其余5头1组,共3次重复)。
1.2.3 棉铃虫5龄幼中枢神经组织样品解剖
脑与神经组织样品解剖选择在5龄幼虫第3 d,在“T”视镜(莱卡)视野下下将幼虫用昆虫针固定,显微解剖镊解剖中枢神经系统,分别解剖脑、咽下神经节(1节)、胸神经节(3节)、腹神经节(7节),立即置于Trizol试剂中(30头为1组次,共3次重复)。
1.2.4 鞣化激素α与β亚基基因不同发育期与神经组织表达
获得的棉铃虫α与β亚基基因序列设计特异性引物,以棉铃虫内参引物18S rRNA(GenBank: KT343378)为研究中内参引物[28]。设计棉铃虫其它引物及对照引物,引物由生工生物工程(上海)股份有限公司合成。将不同发育期和5龄幼虫第3 d中枢神经组织样品取出备用,对于不同发育期样品的处理,先用液氮在研钵里充分研磨,取混匀后适量样品分别放入含有400~900 μL不等Trizol Reagent的PE管中;对于中枢神经组织的处理,直接在无RNA酶的离心管中加液氮迅速冷冻,充分研磨。分别提取得到相应的总RNA,取1 μL用NanoDropTM检测,依次记录其浓度和RNA质量,保证OD260/OD280比值在2.0左右。获得的各组织总RNA按照反转录试剂盒操作步骤合成cDNA: g DNA Eraser Buffer 2 μL, 1 μL g DNA Eraser, 0.8 μg不同组织的总RNA, 6.2 μL RNase free dH2O,配制成10 μL体系,42℃反应2 min,冰上加入5×PrimeScript©Buffer 2 μL, PrimeScript®RT Enzyme MixⅠ1 μL, RT Primer Mix 1 μL, RNase free dH2O4μL。混合均匀后在37℃反应15 min,85℃反应5 s,样品-80℃保存以备qRT-PCR使用。不同基因表达水平检测采用ABI7500 qRT-PCR仪(ABI, Carlsbad, CA, 美国)。以18S rRNA作为内参基因,反应体系10 μL: SYBRPremixExTaqTM(2×)5 μL,正反向引物(10 μmol/L)各0.5 μL, cDNA模板0.5 μL, DEPC处理过的灭活ddH2O 4.5 μL。扩增条件: 95℃预变性3 min; 95℃变性15 s, 60℃退火30 s,72℃延伸30 s,共计40个循环,溶解曲线分析后除去非特异性样品数据,每样品次3个技术重复,重复3次。利用2-△△Ct方法分析基因转录的差异,△Ct=Ct目的基因-Ct内参基因;△△Ct=△Ct处理-△Ct参考基因[28-29]。 表1

表1 设计引物Table 1 Primers designed for research
1.3 数据处理
数据结果参照Yue等(2016)和Du等(2017)统计学分析方法[30-31],即取3次生物学实验重复,误差计算3次重复的标准差;数据处理首先采用DPS软件(DPS7.05单机版)进行分析处理,不同时间点两两间的差异显著采用独立样本t检验,不同数据间差异显著采用单因素方程分析。
2 结果与分析
2.1 棉铃虫鞣化激素基因序列及系统进化
利用棉铃虫转录组unigene序列建立核苷酸本地BLAST数据库,以家蚕鞣化激素不同亚基氨基酸序列为诱饵蛋白,从转录组数据库中分别调取棉铃虫鞣化激素α与β亚基同源基因cDNA序列。通过与棉铃虫基因组核苷酸序列比对,分别确认并获得棉铃虫鞣化激素α与β亚基基因cDNA全长序列。其中α亚基cDNA全长为694 bp,其中开放阅读框全长480 bp,编码159个氨基酸残基,预测该蛋白质分子量分别为17.7 kDa;β亚基cDNA全长为779 bp,其中开放阅读框全长420 bp,编码139个氨基酸残基,预测其蛋白质分子量为15.9 kDa。将棉铃虫鞣化激素α与β亚基基因核苷酸序列提交GenBank,分别获得序列登录号: AHM0247472.1和AHM0247473.1。图1,图2
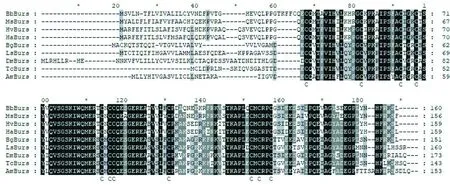
注(Note):黑色阴影表示100%一致,灰色为50%~90%,白色为50%以下
Amino acids 100% identical are in black box, 50%-90% identical in grey box and identi cal below 50% in white box
Bb家蚕Bombyxmori(NP_001091845.1); Ms烟草天蛾Manducasexta(XP_030027854.1);Hv烟芽夜蛾Heliothisvirescens(PCG80721.1);Ha棉铃虫Helicoverpaarmigera(AHM02472.1) ;Bg德国小蠊Blattellagermanica(PSN41953.1);Ls灰飞虱Laodelphaxstriatellus(AXF48185.1);Dm黑腹果蝇Drosophilamelanogaster(NP_650983.1);Tc赤拟谷盗Triboliumcastaneum(ABA40402.1);Am意大利蜜蜂Apismellifera(NM_001098234.1)
图1 棉铃虫与其他昆虫鞣化激素α亚基氨基酸同源比对
Fig. 1 Multiple sequence alignment of Bursicon-αfromH.armigerawith the homologs in other insects

注(Note):黑色阴影表示100%一致,灰色为50%~90%,白色为50%以下
Amino acids 100% identical are in black box, 50%-90% identical in grey box and identical below 50% in white box
Bb 家蚕Bombyxmori(NP_001037289.1); Ms烟草天蛾Manducasexta(XP_030027856.1);Hv烟芽夜蛾Heliothisvirescens(PCG80722.1);Ha棉铃虫Helicoverpaarmigera(AHM02473.1) ;Ls灰飞虱Laodelphaxstriatellus(AXF48186.1);Dm黑腹果蝇Drosophilamelanogaster(NP_609712.1);Am意大利蜜蜂Apismellifera(NP_001035352.2);Tc赤拟谷盗Triboliumcastaneum(NP_001107780.1);Bg德国小蠊Blattellagermanica(PSN41954.1)
图2 棉铃虫与其他昆虫鞣化激素β亚基氨基酸同源比对
Fig. 2 Multiple sequence alignment of Bursicon-βfromH.armigerawith the homologs in other insects
研究表明,棉铃虫鞣化激素α亚基与其它昆虫中该基因所编码氨基酸序列一致性在53%以上,其中与烟蚜夜蛾Heliothisvirescens氨基酸序列一致性最高,为94%,其次是家蚕Bombyxmori一致性为74%,与家蚕Bombyxmori一致性为69%,与德国小蠊Blattellagermanica、灰飞虱Laodelphaxstriatellus、黑腹果蝇Drosophilamelanogaster、赤拟谷盗Triboliumcastaneum和意大利蜜蜂Apismellifera等氨基酸序列一致性较低,分别为59%、56%、53%、56%和53%。棉铃虫鞣化激素α亚基与家蚕等鳞翅目昆虫该基因很好地聚在一起,以果蝇D.melanogaster为代表的双翅目、以赤拟谷盗为代表的鞘翅目、以白蚁和蟑螂为代表的蜚蠊目同时分别很好的聚在了一起,而意大利蜜蜂单独聚为一支。图3

注(Note):Bb家蚕Bombyxmori(NP_001091845.1); Ms烟草天蛾Manducasexta(XP_030027854.1);Cs二化螟Chilosuppressalis(ALM30306.1); Hv烟芽夜蛾Heliothisvirescens(PCG80721.1);Tn粉纹夜蛾Trichoplusiani(XP_026733509.1); Ha棉铃虫Helicoverpaarmigera(AHM02472.1) ;Gm蜡螟Galleriamellonella(XP_026749033.1);Px小菜蛾Plutellaxylostella(AJM76770.1);Cp苹果蠹蛾Cydiapomonella(QDK59883.1);Zn湿木白蚁Zootermopsisnevadensis(XP_021930557.1);Bg德国小蠊Blattellagermanica(PSN41953.1);Ls灰飞虱Laodelphaxstriatellus(AXF48185.1);Bd橘小实蝇Bactroceradorsalis(XP_029409224.1);Zt南亚实蝇Zeugodacustau(QBE90576.1);Nl褐飞虱Nilaparvatalugens(XP_022197712.1);Dm黑腹果蝇Drosophilamelanogaster(NP_650983.1);Agl光肩星天牛Anoplophoraglabripennis(XP_018569360.1);Tc赤拟谷盗Triboliumcastaneum(ABA40402.1);Aga冈比亚按蚊Anophelesgambiae(Q66Q82.1); Ld马铃薯甲虫Leptinotarsadecemlineata(XP_023014168.1);So米象Sitophilusoryzae(XP_030754853.1);Aa埃及伊蚊Aedesaegypti(P85316.1);Rm禾谷缢管蚜Rhopalosiphummaidis(XP_026815117.1);Am意大利蜜蜂Apismellifera(NM_001098234.1); Mp桃蚜Myzuspersicae(XP_022171710.1)
图3 最大相似法构建的基于昆虫鞣化激素α亚基氨基酸序列系统进化树 (MEGA ver. 7.0.14, 1 000次重复)
Fig. 3 Molecular phylogenic analysis of the burs-αfrom different insect species based on amino acid sequences by maximum likelihood method (MEGA ver. 7.0.14, 1,000 replicates)
而棉铃虫鞣化激素β亚基与其它昆虫中该基因所编码氨基酸序列一致性也在在43%以上。序列比对还发现,与烟蚜夜蛾H.virescens氨基酸序列一致性最高,达97%,家蚕B.mori和烟草天蛾M.sexta,一致性69%。与α亚基序列分析一致,鞣化激素β亚基在夜蛾科中首先聚在一起,然后再螟蛾科大拉螟G.mellonella和二化螟C.suppressalis聚在一起。其次与同属蚕蛾科的家蚕B.mori、天蛾科的烟草天蛾M.sexta聚在一起,最后与卷蛾科的苹果蠹蛾C.pomonella、菜蛾科小菜蛾P.xylostella等其它鳞翅目害虫聚在一起,形成一个庞大的鳞翅目家族。以赤拟谷盗为代表的鞘翅目、以果蝇为代表的双翅目、以白蚁和蟑螂为代表的蜚蠊目等昆虫均很好的聚在了一起。以蜜蜂为代表的膜翅目单独聚为一支。这与鞣化激素氨基的酸序列同源联配分析结果相一致。图4
在棉铃虫鞣化激素α与β亚基氨基酸序列中也发现具有典型的鞣化激素胱氨酸蛋白结构,其中半胱氨酸C1与C7,C2与C8,C3与C9,C4与C10,C5与C11可通过二硫键相连接。图4

注(Note):Bb 家蚕Bombyxmori(NP_001037289.1); Ms烟草天蛾M.sexta(XP_030027856.1);Hv烟芽夜蛾H.virescens(PCG80722.1);Ha棉铃虫H.armigera(AHM02473.1) ; Tn粉纹夜蛾T.ni(XP_026733510.1);Gm蜡螟G.mellonella(XP_026749002.1);Cs二化螟C.suppressalis(ALM30307.1); Px小菜蛾P.xylostella(AJM76771.1);Cp苹果蠹蛾C.pomonella(QDK59884.1);So米象S.oryzae(XP_030754854.1);Ld马铃薯甲虫L.decemlineata(XP_023014169.1);Ls灰飞虱L.striatellus(AXF48186.1);Agl光肩星天牛A.glabripennis(XP_018569361.1);Nl褐飞虱N.lugens(XP_022190952.1);Aa埃及伊蚊Aedesa.(XP_001663910.1);Dm黑腹果蝇D.melanogaster(NP_609712.1);Mp桃蚜M.persicae(XP_022171709.1);Zn湿木白蚁Z.nevadensis(XP_021930558.1);Rm禾谷缢管蚜R.maidis(XP_026815130.1);Zt南亚实蝇Z.tau(QBE90577.1);Bd橘小实蝇B.dorsalis(XP_011213771.1);Am意大利蜜蜂A.mellifera(NP_001035352.2); Aga冈比亚按蚊A.gambiae(CAH74225.1);Tc赤拟谷盗T.castaneum(NP_001107780.1);Bg德国小蠊B.germanica(PSN41954.1)
图4 最大相似法构建的基于昆虫鞣化激素β亚基氨基酸序列系统进化树 (MEGA ver. 7.0.14, 1 000次重复)
Fig. 4 Molecular phylogenic analysis of the burs-βfrom different insect species based on amino acid sequences by maximum likelihood method (MEGA ver. 7.0.14, 1,000 replicates)
2.2 棉铃虫鞣化激素基因在不同发育期相对表达模式
研究表明,棉铃虫鞣化激素α基因在卵期第3 d、1龄幼虫第2 d、2龄幼虫第1 d、3~5幼虫第1 d;2龄和3龄末蜕皮期(3M、4M)、蛹期第0 d、第3 d和第7 d表达量相对较高,自蛹期第7 d至成虫羽化后相对表达量开始下降。图5
而棉铃虫鞣化激素β基因在卵期至2龄末蜕皮期(3M)持续高水平表达。自3龄第1 d始迅速下降,但在3龄幼虫第2 d、4与5龄幼虫第1 d相对表达量较高;自蛹期第1 d开始至羽化前表达量相对较高,羽化后成虫体内相对表达量开始下降。图6
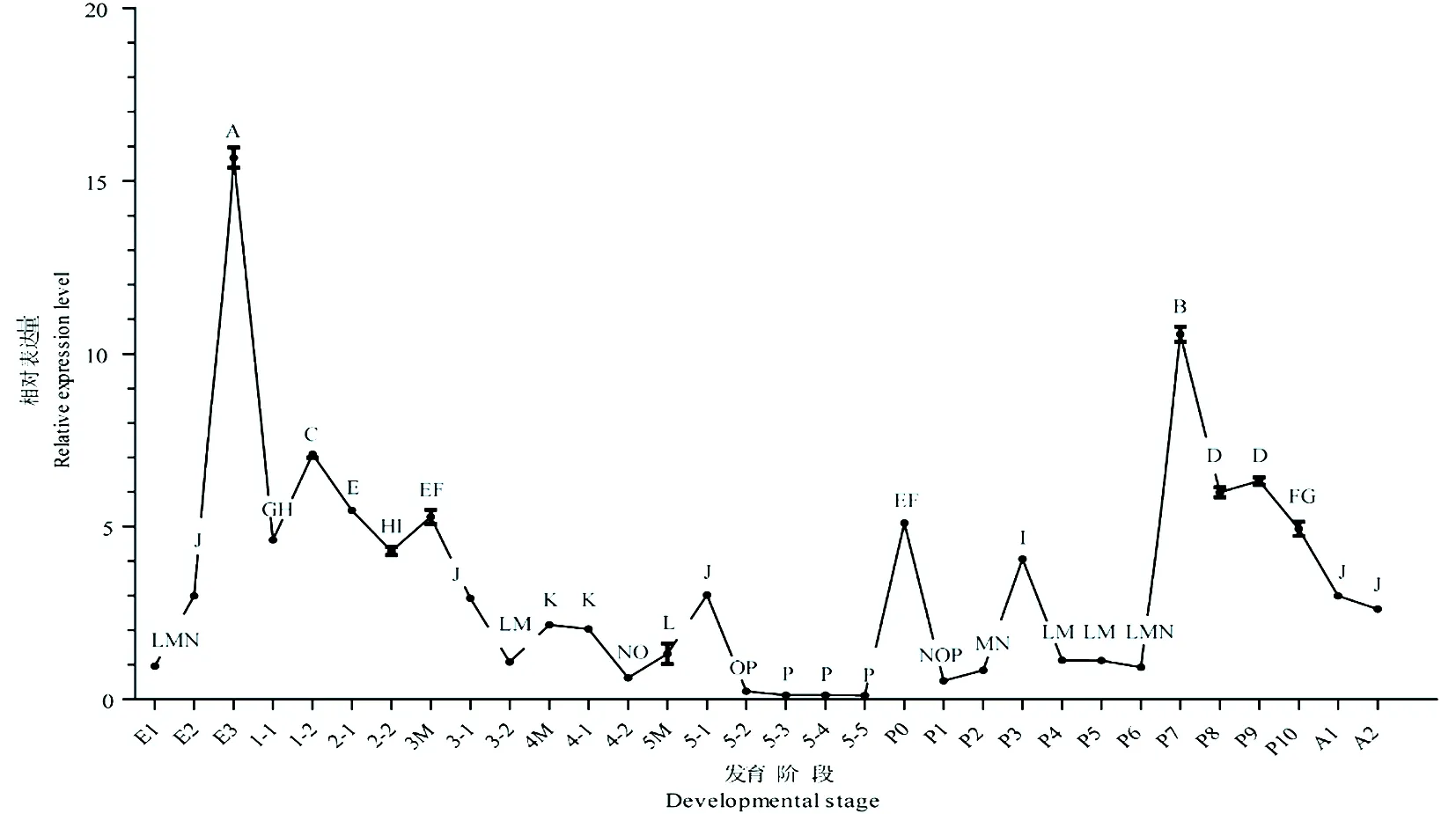
注(Note):E1~ 3: 分别为1~ 3日龄卵1~3-d~ay-old egg, respectively; 1-1~2: 分别为1龄幼虫第1~ 2 dDay 1~ 2 1st instar larva, respectively; 2-1~ 2: 分别为2龄幼虫第1~ 2 dDay 1~ 2 2nd instar larva, respectively; 3-1~ 2:分别为3龄幼虫第1~ 2 dDay 1- 2 3rd instar larva, respectively; 4-1~ 2:分别为4龄幼虫第1~2 dDay 1~2 4th instar larva, respectively; 5-1~5:分别为5龄幼虫第1~5 dDay 1~5 5th instar larva, respectively; M: 蜕皮期Molting stage; PP: 预蛹期Pre-pupal stage; P0~10: 化蛹后0~10 d0~10 d after pupation; A1~2: 分别为1和2日龄成虫1~2-day-old adult. 图中数据为平均值±标准误,不同小写字母代表基因表达差异显著(P<0.01; ANOVA和Tukey氏检验)。Data in the figure are mean±SE. Statistically significant differences are denoted by different capital letters (ANOVA and Tukey's test,P<0.01)
图5 鞣化激素-α亚基基因在棉铃虫不同发育阶段的表达水平
Fig. 5 Developmental expression profiles of bursion-αin H. armigera

注(Note): E1-3: 分别为1~3日龄卵1-3-day-old egg,respectively; 1-1~2: 分别为1龄幼虫第1~2 dDay 1~2 1st instar larva, respectively; 2-1~2: 分别为2龄幼虫第1~2 dDay 1~2 2nd instar larva, respectively; 3-1~2:分别为3龄幼虫第1~2 dDay 1~2 3rd instar larva, respectively; 4-1~2:分别为4龄幼虫第1~2 dDay 1~2 4th instar larva, respectively; 5-1~5:分别为5龄幼虫第1~5 dDay 1~5 5th instar larva, respectively; M: 蜕皮期Molting stage; PP: 预蛹期Pre-pupal stage; P0~10: 化蛹后0~10 d,0-10 d after pupation; A1~2: 分别为1和2日龄成虫1~2-day-old adult. 图中数据为平均值±标准误,不同小写字母代表基因表达差异显著(P<0.01; ANOVA和Tukey氏检验)。Data in the figure are mean±SE. Statistically significant differences are denoted by different capital letters (ANOVA and Tukey's test,P<0.01)
图6 鞣化激素-β亚基基因在棉铃虫不同发育阶段的表达水平
Fig. 6 Developmental expression profiles ofburs-βin H. armigera
2.3 棉铃虫鞣化激素α亚基、β亚基在棉铃虫中枢神经系统的相对表达量
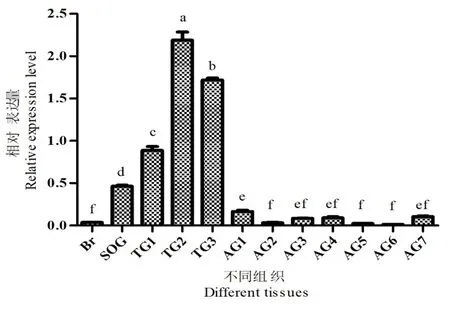
研究表明,在棉铃虫胸神经节中的相对表达量较高,尤其是在胸神经节第2节中表达量最高,其次是第3节,第1节也有较高水平;咽下神经节相对表达量低于胸神经节前相对表达量,但显著高于脑部与腹部表达量,腹神经节也有不同程度表达,但总体相对较弱。图7

注;Br:脑;SOG:食管下神经节;TG:胸神经节;AG:腹神经节。图中数据为平均值±标准误,不同小写字母代表基因表达差异显著(P<0.05; ANOVA和Tukey氏检验)
Note:Data in the figure are mean±SE. Statistically significant differences are denoted by different capital letters (ANOVA and Tukey's test,P<0.05)
图7 鞣化激素-α在棉铃虫中枢神经系统的相对表达水平
Fig. 7 Relative expression levels of bursion-αin nervous system ofH.armigera
注;Br:脑;SOG:食管下神经节;TG:胸神经节;AG:腹神经节。图中数据为平均值±标准误,不同小写字母代表基因表达差异显著(P<0.05; ANOVA和Tukey氏检验)
Note:Data in the figure are mean±SE. Statistically significant differences are denoted by different capital letters (ANOVA and Tukey's test,P<0.05)
图8 鞣化激素β亚基基因在棉铃虫中枢神经系统的相对表达水平
Fig. 8 Relative expression levels of bursion-βin nervous system ofH.armigera
对于β亚基而言,表达模式与α亚基具有一致性,β亚基在胸神经节中相对较高,咽下神经节次之,脑部和腹部相对表达量较弱,其中腹部第1节与第3节、第4节和第7节差异不显著,但与脑部表达量有显著差异;除腹部第1节外,其余腹部相对表达量差异不显著。图8
3 讨 论
昆虫在不同虫态及生长发育过程中,离不开旧表皮的蜕去和新表皮的的形成。在此过程中,鞣化是一个必不可缺的复杂的生理过程,鞣化包括黑化和硬化两个相对独立的过程,硬化的表皮既可以维持昆虫的形态,也可以抵御外界病原物的入侵[3]。鞣化激素的发现及研究至今已经有50多年的时间,目前,对鞣化激素的研究多集中于果蝇、赤拟谷盗、烟草天蛾等模式昆虫,而且有关同聚体的功能还未完全清楚。
以重要农业害虫棉铃虫为研究材料,依据幼虫神经组织转录组unigene建立了本地核苷酸数据库,根据同源克隆的方法,利用生物信息学技术获得了棉铃虫α亚基和β亚基的全长序列,其α亚基基因全长为694 bp,其中开放阅读框全长480 bp,编码160个氨基酸残基,β亚基基因全长为779 bp,其中开放阅读框全长420 bp,编码140个氨基酸残基。对氨基酸序列分析发现,α亚基和β亚基均含有保守的半胱氨酸残基,其它氨基酸序列也相对比较保守,鞣化激素在鳞翅目昆虫之间不仅保守,也可能具有一定的跨物种活性,对昆虫的生长发育有不可替代的作用。
通过qPCR检分析鞣化激素α亚基和β亚基在棉铃虫体内的时空表达模式,结果表明,二者在棉铃虫各个发育阶段均有表达,但在卵期和蛹期表达量相对较高,这与之前在果蝇和家蚕中的鞣化激素在蛹期表达量较高的研究中得到的结论基本相符[19,32]。鞣化激素在蛹期较高水平表达,可能与棉铃虫羽化后成虫体壁的鞣化和翅的延展有关;鞣化激素在棉铃虫卵期高水平表达,可能为卵壳的硬化和黑化做准备。此外,检测棉铃虫神经系统的各个神经节发现,鞣化激素主要是由胸部神经节合成的,但是在脑和腹部神经节中表达量极低,有研究表明,美洲大蠊和烟草天蛾的胸神经节和腹部神经节均检测到鞣化激素的较高表达[16,21],这可能与物种间的的个体差异有关,棉铃虫鞣化激素α亚基和β亚基在幼虫及成虫期的生理与生化功能还需进一步验证。
4 结 论
鞣化激素在昆虫之间具有较高的保守性,与其它已知昆虫发表序列类似,棉铃虫鞣化激素α与β亚基氨基酸序列中也发现具有典型的鞣化激素胱氨酸蛋白结构,其中半胱氨酸C1与C7,C2与C8,C3与C9,C4与C10,C5与C11可通过二硫键相连接。鞣化激素在棉铃虫各个发育阶段均有表达,其中α亚基在卵期第3 d、1龄幼虫第2 d、2龄幼虫第1 d、3~5龄幼虫第1 d; 2龄和3龄末蜕皮期(3M、4M)、蛹期第0 d、第3 d和第7 d表达量相对较高。而β亚基在卵期至2龄末蜕皮期(3M)持续高水平表达,在3龄幼虫第2 d、4与5龄幼虫第1 d和蛹期表达量相对较高。鞣化激素主要是由棉铃虫幼虫胸部神经节合成的,在脑和腹部神经节中表达量极低。
