淫羊藿苷对兔充血性心力衰竭引起室性心律失常的影响及其电生理机制
2020-04-06汪晶晶董蔚蒋博李丹丹张威王晶穆洋陈思李泱陈韵岱
汪晶晶,董蔚,蒋博,李丹丹,张威,王晶,穆洋,陈思,李泱,陈韵岱
中国人民解放军总医院第一医学中心心血管内科,北京100853
前言
充血性心力衰竭(Congestive Heart Failure,CHF)为众多心血管疾病发生发展迁延至终末阶段,其本质是交感神经系统兴奋过度失常和心室机械做功系统产生压力负荷失代偿[1],使β 肾上腺能受体作用异常失调,引起心脏和血液循环中肾素-血管紧张素系统分泌醛固酮以及儿茶酚胺类物质堆积并持续升高,造成除心功能减弱、结构重构外的心脏电活动不稳定性,出现电重构,表现为动作电位时程(Action Potential Duration,APD)整复性和电交替显著增加,心脏对室性心律失常的发生具有显著易感性,从而诱发室性心律失常。所以,心律失常是致CHF 患者死亡最主要原因,而在因CHF 置于心脏辅助机械装置的患者中有超过45%患者出现室性心律失常[2],其终极原委是单个心肌细胞内Ca2+交换的形成增加,通过心肌细胞上L-型钙电流(L-type Calcium Current,ⅠCa-L)增多,造成细胞内Ca2+超载,引起心肌细胞内Ca2+振荡,进而诱发延迟后除极及其触发电活动。也正如此,改善CHF 患者的心功能,防止室性心律失常发生成为药物治疗CHF的关键。而目前治疗CHF最佳手段是心脏移植,但鉴于供体器官受限,绝大部分CHF 仍依赖药物治疗,主要针对交感神经信号传递通路中终极靶点β肾上腺受体,包括单独或联合使用β 受体阻断剂、血管紧张素转化酶抑制剂和血管紧张素ⅠⅠ受体阻断剂以及交感神经阻断药物,但对交感神经调控通路中下游环节中抑制Ca2+异常增加的药物还有待进一步开发,以期从更多途径改善CHF 症状,降低CHF患者死亡率和住院率[3]。
淫羊藿苷(Ⅰcariin, ⅠCA)是从中药淫羊藿中提取的一种黄酮类化合物,为淫羊藿总黄酮中的重要活性单体成分,分子式为C33H40O15,分子量为676.66。现代药理及心脏电生理实验研究表明,以ⅠCA为主要成分的淫羊藿总黄酮能选择性阻断离体及整体动物心肌β1受体,其本身能改善心血管系统功能,调节内分泌,对异丙肾上腺素(Ⅰsoproterenol,ⅠSO)所致的心肌细胞损伤具有直接的保护作用,但对ⅠSO诱发心律失常没有显著作用[4],只是对心室肌细胞的ⅠCa-L具有浓度依赖性阻滞作用,推测其具有抗心律失常作用[5]。所以,CHF 的形成和发展可以引起心室电重构,容易诱发室性心律失常,而ⅠCA 的药理作用表明对CHF 诱发室性心律失常可能起到预防作用,只是目前尚不清楚ⅠCA 对CHF 引起的室性电生理不稳定性和易感性是如何作用的,其抗CHF 性室性心律失常作用及其细胞电生理机制仍待探讨。本研究通过ⅠSO诱导制造家兔CHF模型,采用记录在体单相动作电位(Monophasic Action Potential,MAP)以及全细胞膜片钳等技术记录相关主要电生理指标,在体电生理水平探讨ⅠCA 对CHF 所致室性心律失常的影响,从细胞电生理水平发现这种作用机制[6],从而为临床深入开发中药有效成分用于治疗CHF 患者出现的室性心律失常提供理论基础和实验证据。
1 材料与方法
1.1 动物分组、药物试剂和仪器
实验分为对照组、CHF 组和CHF+ⅠCA 组(ⅠCA组),ⅠCA 组是在CHF 模型建立后根据实验方案以不同途径给予相应实验剂量ⅠCA 组成。动物为健康成年雄性新西兰大耳白兔,购于北京生物制品实验动物中心,起始体质量2.5~3.0 kg,共50 只。对照组12只,用于制备CHF 模型38 只。ⅠCA 购于中国食品药品检定研究院,为国家药品标准物质,纯度>98%。实验前用二甲亚砜(DMSO,其终浓度<0.01%)经超声助溶,然后根据实验需要临时用0.9%生理盐水或记录ⅠCa-L的细胞外液经超声助溶配制成40 mg/L 溶液供静脉滴注或灌流单个心肌细胞。ⅠSO、戊巴比妥钠、肝素钠、胶原酶Ⅰ、蛋白酶E、小牛血清白蛋白、CsCl、CsOH、HEPES、Na2-ATP 、EGTA、TEA 等试剂购于Sigma 公司,其它购于国内相关试剂公司,均为分析纯。Tyrode 液成分(mmol/L):NaCl 135.0、KCl 5.4、CaCl21.8、MgCl21.0、NaH2PO40.33、HEPES 10.0、Glucose 10.0,pH 用NaOH 调至7.35。无Ca2+Tyrode液和含有0.2 mmol/L Ca2+的Tyrode 液分别为Tyrode液中无CaCl2和仅加0.2 mmol/L CaCl2。记录ⅠCa-L电极外液成分(mmol/L):NaCl 147.0、KCl 5.4、CaCl22.0、Glucose 10.0、MgCl21.05、NaH2PO40.42、HEPES 10.0,pH 用NaOH 调至7.35。记录ⅠCa-L电极内液成分(mmol/L):CsCl 135.0、MgCl24.0、HEPES 10.0、Na2-ATP 2.0、EGTA 10.0、TEA 20.0,pH 用CsOH调至7.30。主要仪器有婴幼儿超声仪(主机Vivid 7,探头S4,美国GE 公司);16 导电生理记录系统(PowerLab 16/30,ADⅠnstruments,Australia);兔的标准化记录和分析模块(LabChart Pro V7, ADⅠnstruments,Australia);开睑器(WPⅠ公司, USA);刺激器(Grass S88,USA);倒置显微镜(ⅠX70-122,Olympus,Japan);Pulse+Pulsefit 软件(version8.31, HEKA, Germany);EPC-9放大器(HEKA,Germany)。
1.2 建立成功的CHF模型
CHF 组动物模型建立参照文献[7]并做改良,具体方法为:兔经耳缘静脉注射ⅠSO(0.3 mg/kg/d),连续不间断注射3周,注射前后注意剃毛、消毒和止血;对照组动物注射相同体积的0.9%生理盐水并作同样对待。造模后继续喂养6个月,整个饲养过程充分提供动物生活所需要的湿度、温度和光线,自由进食和饮水。6 个月后比较仍然存活用于制备CHF 模型兔和对照组兔的临床表现、M 型超声心动图和清醒状态下记录Ⅱ导联ECG,以确定CHF模型建立成功。临床表现是连续观察动物体质、状态和病情反应;M 型超声心动图检查心脏彩超,图像深度3.0~5.0 cm,频率为2.5 MHz,主要观察指标包括左心室舒张末期内径(LVDD)、舒张期室间隔厚度(ⅠVSD),根据改良的Simpon's 公式计算出左心室射血分数(LVEF)及短轴缩短率(LVFS);清醒状态下用生理记录仪记录2 h标准ⅠⅠ导联ECG(ECG-ⅠⅠ),然后通过生理记录仪自带适用于兔的标准化记录和分析模块对ECG-ⅠⅠ进行记录、测量和分析,主要观察参数包括心率、PR 间期、QT 间期和ST 段。纳入造模过程的家兔经上述各项检测,与对照组相比出现消瘦、无力、气促和肌肉萎缩等临床症状,且LVEF 和LVFS 均明显减小,左心室腔明显扩大,室间隔显著变薄,心率减慢,PR和QT间期均显著延长,ST 段明显上移,预示造模成功,适合进行下一步电生理实验。
1.3 记录在体心室MAP
分别将对照组和CHF 组兔经耳缘静脉注射戊巴比妥钠(300 mg/kg)麻醉后开胸,用开睑器撑开胸廓充分暴露心脏,小心剪开心包膜,用改制的接触微电极记录自律心率下左心室前壁靠近心尖部MAP,记录心电信号经MAP 膜电位放大器放大后经16 导数模转换器转换并由滤波器(0.3 Hz~1 KHz)滤过形成动作电位图形,输入计算机保存,然后用分析软件对实验数据进行测量、分析和统计。ⅠCA 组是在完成CHF 组观察指标后,间隔30 min 及以上(消除心脏记忆对后续实验数据影响),静注ⅠCA(12 mg/kg)20 min,然后继续维持静滴并记录上述提到的MAP。分析比较的主要参数包括静息电位(RP)、动作电位幅度(APA)、动作电位最大上升速率(Maxdv/dt)、动作电位复极化恢复到10%、20%、50%、90% 时程(APD10、APD20、APD50、APD90)。
1.4 测量心室有效不应期(Effective Refractory Period,ERP)和室性心律失常诱发
分别给对照组和CHF 组兔依照手术步骤开胸暴露心脏,利用程控电刺激(Programmed Electrical Stimulation, PES)检测不同基础刺激周长(Basic Cycle Length,BCL)的心室ERP。将刺激电极置于右室心外膜,由刺激器发放刺激对心脏进行起搏,刺激方波均为2 ms,刺激强度为2 倍舒张阈值,按8:1 的S1S2程控刺激法,即每8 个基础起搏S1后紧跟一个期前刺激S2,BCL为150 ms,S1S2偶联间期分别从150 ms开始,以5 ms 步长递减,直到S2不能诱发心室激动,此时的S1S2偶联间期定义为BCL=150 ms 的ERP150。记录心电信号经放大器放大并经滤波器过滤(10 Hz~1 kHz)后存于计算机,用自带分析软件进行测量和分析。观察指标为ERP150以及ERP150离散度(dispersion of ERP150, dERP150,即在BCL=150 ms时,记录到最长ERP150与最短ERP150的差值)。
室性心律失常诱发是在完成ERP 测定后经过30 min(消除心脏记忆对后续实验数据影响)再进行。采用短阵快速刺激法(Burst-pacing),刺激波宽2 ms,BCL 从200 ms 到20 ms,每次持续10 s,观察各组兔被诱发室性心律失常情况,包括室性早搏、室性心动过速或心室颤动,图形存于计算机,用自带的分析软件测量和分析诱发室性心律失常的刺激周长和诱发率。ⅠCA组是在完成CHF组各项记录后,间隔30 min及以上(消除心脏记忆对后续实验数据影响),静注ⅠCA(12 mg/kg)20 min,然后继续维持静滴并重复上述提到的ERP和Burst-pacing方案。
1.5 分离心室肌细胞并记录ⅠCa-L 及其电流-电压(Current-Voltage,Ⅰ-V)曲线
分别对完成在体MAP实验并恢复到基础心率的对照组或CHF 组兔注射戊巴比妥钠(300 mg/Kg)麻醉和肝素钠(500 ⅠU/kg)抗凝,10 min 后开胸剪取心脏行Langendorff离体心脏灌流,先用无Ca2+的Tyrode液灌流10 min(流速18~20 mL/min,37 ℃,100%O2饱和),再用双酶和小牛血清白蛋白(胶原酶Ⅰ0.33 mmol/L;蛋白酶E 0.25 mmol/L;BSA 0.25 g/L)以及含有0.2 mmol/L Ca2+的Tyrode液灌流10 min消化心脏,然后用正常Tyrode 液灌流10 min,获得含单个心室肌细胞悬液。将各组分离的细胞悬液加于倒置显微镜载物台上细胞记录槽中,10 min 后用记录ⅠCa-L细胞外液循环灌流,然后借助膜片钳控制程序Pulse+Pulsefit软件,将指令程序和记录信号经EPC-9放大器转换和放大导入到心肌细胞,在显微镜辅助下,用充灌ⅠCa-L电极内液玻璃微电极(电阻2.5~3.5 MW)吸附心肌细胞并形成高阻抗封接,直至电阻抗达到1 GW以上,补偿快电容,施加负压吸破细胞膜并作慢电容和漏电容补偿,形成膜片钳记录模式。将膜电位钳制在-60 mV,指令电位由-50 mV 到+50 mV,跃阶10 mV,钳制时间300 ms,可记录到一缓慢的内向电流,此电流在-40 mV 开始激活,在+10 mV 附近达到最大,然后随钳制电压的增加而逐步减小。给予钙通道阻滞剂维拉帕米(20 μmol/L)可以明显抑制该电流,表明此电流为ⅠCa-L。经Pulse 软件采集ⅠCa-L并存储于计算机。ⅠCA 组ⅠCa-L记录是用含4.0 mg/L ⅠCA 记录ⅠCa-L细胞外液灌流CHF 心室肌细胞10 min,再重复上述实验过程。为消除细胞大小对统计影响,电流大小用电流密度(pA/pF)表示。Ⅰ-V 曲线绘制是以各自指令电位为横坐标,相对应的电流密度为纵坐标拟合形成。
1.6 统计学处理
数据以均数±标准差表示,计量资料的组间比较采用t检验,计数资料以率或构成比表示,多组间比较用方差分析,率的比较运用卡方检验。采用Origin 6.0(Microcal公司,USA)统计学软件对各组数据进行分析,以P<0.05为差异有统计学意义。
2 结果
2.1 实验兔数丢失及成功建立CHF兔模型
在建模和开展电生理技术过程中,除因不明原因或病情严重死亡、检测结果没有达到CHF 指标以及实验过程中死亡而没有完成全程实验被剔除等,最后进入实验并纳入统计的兔数为对照组10 只;符合CHF 条件,进入CHF 组及其ⅠCA 组分别为10 只。与对照组比较,CHF 模型组出现消瘦、脱毛、打喷嚏、食欲减退、无力、嗜睡、气促和肌肉萎缩等临床症状。M 型超声心动图测定的LVEF和LVFS均明显减小,左心室腔明显扩大,室间隔显著变薄(P均<0.01);心电图上可见室性早搏,心率减慢(P<0.05),PR和QT间期均显著延长(P<0.01),ST段明显上移(P<0.05)。结果表明本实验制造的CHF 模型成功,适合进行下一步电生理实验。两组兔M 型超声心动图和心电图主要指标比较结果见表1。
表1 两组兔M型超声心动图和Ⅱ导联心电图主要指标比较结果(±s,n=10)Tab.1 Comparison of main parameters of M-type echocardiogram and Ⅱ-lead electrocardiogram in two groups(Mean±SD,n=10)
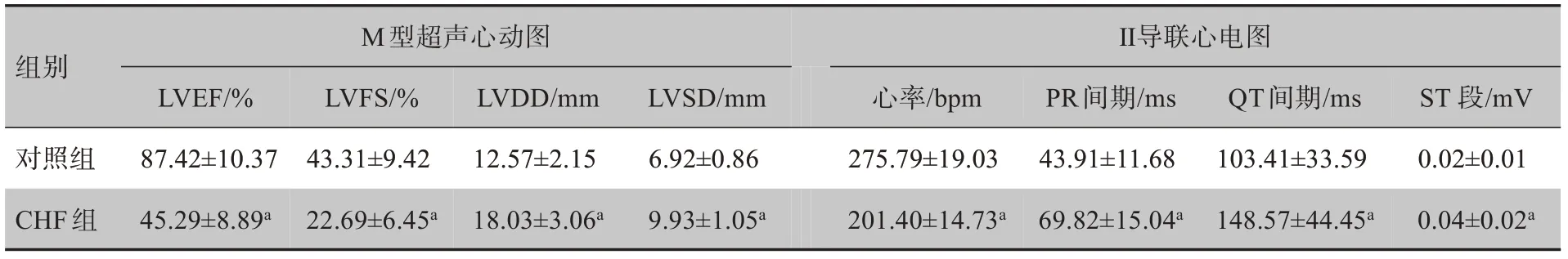
表1 两组兔M型超声心动图和Ⅱ导联心电图主要指标比较结果(±s,n=10)Tab.1 Comparison of main parameters of M-type echocardiogram and Ⅱ-lead electrocardiogram in two groups(Mean±SD,n=10)
a表示与对照组比较,P<0.05
?
2.2 ⅠCA对CHF兔心室MAP主要参数的影响
与CHF 组比较,ⅠCA 使APA 增加,Maxdv/dt加快,APD10、APD20、APD50和APD90均明显缩短(P均<0.01);但与对照组比较,上述各参数虽有改变,但没有显著性差异(P均>0.05);另外,各组的RMP 没有明显改变(P>0.05)。详见表2。
表2 ICA对CHF兔心室MAP主要参数的影响(±s,n=10)Tab.2 Effects of icariin on the main parameters of ventricular monophasic action potential in rabbits with congestive heart failure(Mean±SD,n=10)
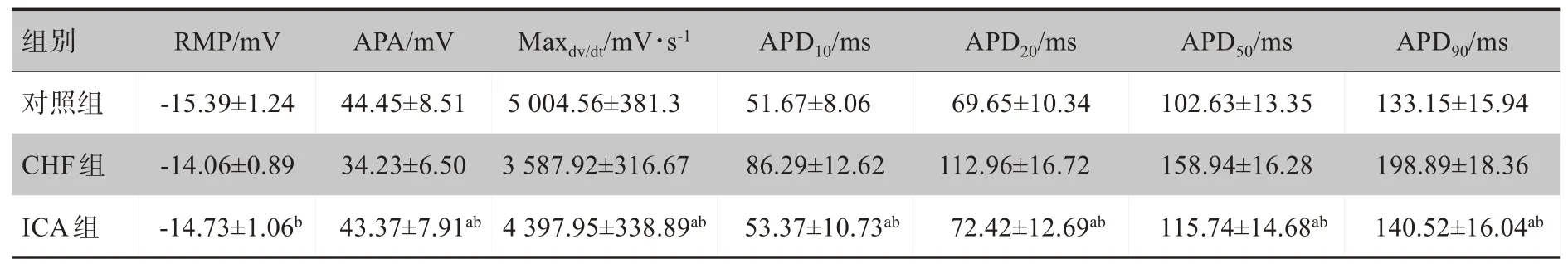
表2 ICA对CHF兔心室MAP主要参数的影响(±s,n=10)Tab.2 Effects of icariin on the main parameters of ventricular monophasic action potential in rabbits with congestive heart failure(Mean±SD,n=10)
a表示与CHF组比较,P<0.01;b表示与对照组比较,P>0.05
?
2.3 ⅠCA 对CHF 兔心室ERP 和诱发室性心律失常的影响
与CHF 组比较,ⅠCA 组ERP 在BCL 为150 ms 时显著缩短(P均<0.01),接近对照组相关的测量值,但没有显著差异(P>0.05);而ⅠCA 组dERP 在BCL 为150 ms 时亦均显著缩短(P均<0.01),且明显长于对照组相关观察值(P均<0.05);经Burst-pacing,在ⅠCA作用下,CHF 兔被诱发室性心律失常的BCL 明显缩短,室性心律失常诱发率明显减少(P均<0.01),但与对照组比较,上述2 项观察值依然增大,具有显著差异性(P<0.05)。详见表3。
表3 ICA 对CHF兔心室ERP和诱发心律失常的主要参数的影响(±s)Tab.3 Effects of icariin on the main parameters of ventricular effective refractory period and induced ventricular arrhythmias in CHF rabbits(Mean±SD)
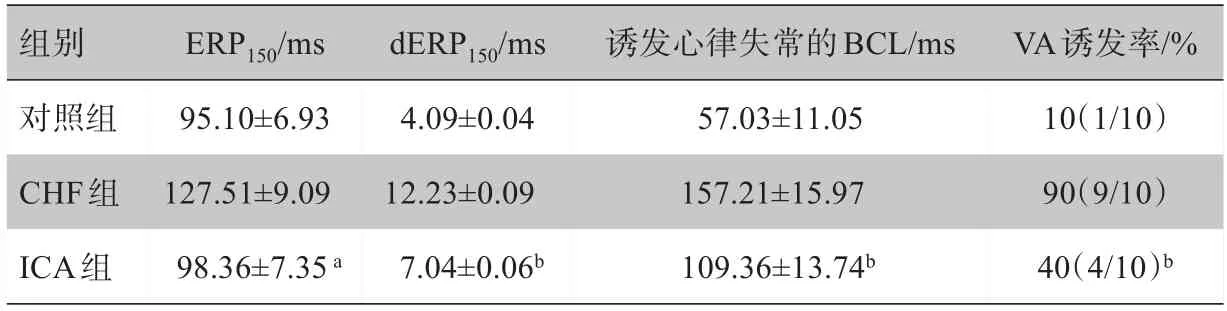
表3 ICA 对CHF兔心室ERP和诱发心律失常的主要参数的影响(±s)Tab.3 Effects of icariin on the main parameters of ventricular effective refractory period and induced ventricular arrhythmias in CHF rabbits(Mean±SD)
a表示与对照组比较,P>0.05;与CHF组比较,P<0.01。而b表示与对照组比较,P<0.05;与CHF组比较,P<0.01
?
2.4 ⅠCA 对CHF 兔心室肌细胞ⅠCa-L 及其Ⅰ-V 曲线的影响
与对照组兔心室肌细胞的ⅠCa-L图形比较,CHF 组兔心室肌细胞ⅠCa-L在各钳制电压下均明显增大,但经过ⅠCA 作用CHF 兔心室肌细胞后,该组兔心室肌细胞的ⅠCa-L图形在各钳制电压均明显减小。从心室肌细胞ⅠCa-L的Ⅰ-V 曲线上不难看出,CHF 组ⅠCa-L的Ⅰ-V 曲线处于最下面,并略向左偏移;而ⅠCA 组ⅠCa-L的Ⅰ-V 曲线明显上抬,靠近对照组兔心室肌细胞ⅠCa-L的Ⅰ-V 曲线。在钳制电压为+10 mV 时,ⅠCA 组兔心室肌细胞ⅠCa-L电流密度为(6.95±0.15)pA/pF,明显小于CHF 组兔心室肌细胞ⅠCa-L电流密度,为(9.98±0.53)pA/pF(P<0.01,n=10 细胞),但仍大于对照组兔心室肌细胞ⅠCa-L电流密度,为(4.12±0.08)pA/pF(P<0.05,n=10 细胞)。另外,3 组ⅠCa-L的Ⅰ-V 曲线形态没有发生明显改变,表明记录条件的稳定性和可靠性(图1)。
3 讨论
研究发现,临床患者出现CHF 症状多与交感神经激活过度,心室壁对机械牵张负荷感应失敏密切相关[8]。系统激活过度和感觉失敏使交感神经信号传导通路中肾素-血管紧张素系统和β 肾上腺素受体功能增强,引起心脏和血液循环系统中儿茶酚胺类物质增多,进而加重心脏做功增强、心肌肥大、心肌相对缺血缺氧、心力衰竭加重直至心功能失代偿。鉴于此,本研究根据相关报道并作改良,给家兔长时间连续注射大剂量ⅠSO,结果发现选入造模组兔出现非常明显的消瘦、食欲减退、气促和肌肉萎缩等临床症状。超声心动图测定的LVEF 及LVFS 均明显减小,左心室腔明显扩大,室间隔显著变薄。清醒状态下心电图检查发现心率减慢,PR和QT间期均显著延长,ST段明显上抬等电生理特征,提示本实验制造的CHF模型成功[9],符合临床上心衰患者在病情慢性迁延过程中儿茶酚胺的浓度分泌增高引发CHF 形成过程,评价建立CHF 模型是否成功的标准和文献报道相一致,能很好地反映CHF 形成的病理生理发展过程,适合进行下一步在体电生理实验[10]。通过在体电生理记录更是真实反映了在神经体液和内分泌共同作用下的电生理的变化及其观察药物对病情发生作用的过程。
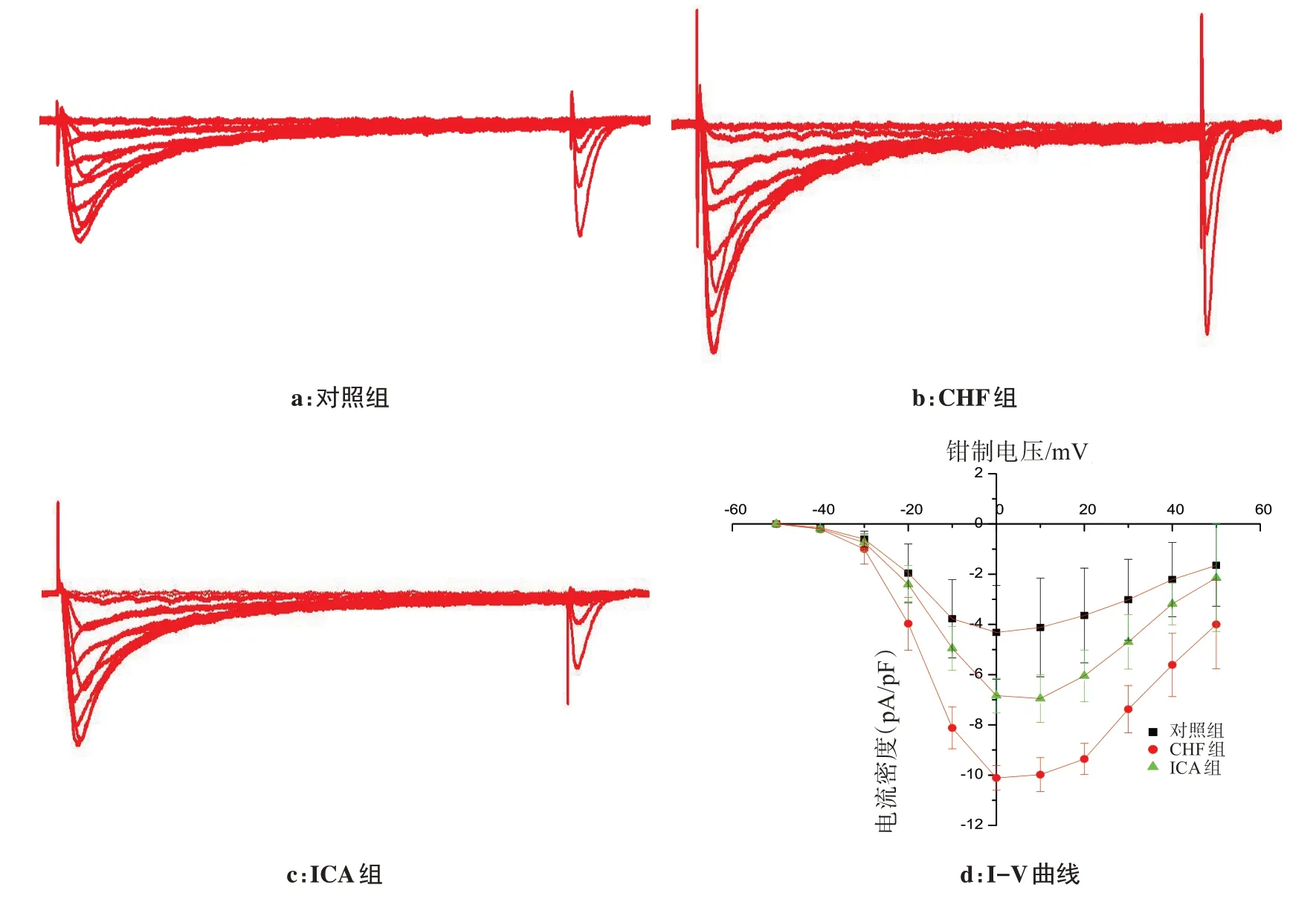
图1 ICA对CHF兔心室肌细胞ICa-L及其I-V曲线的影响Fig.1 Effects of icariin on ICa-L of ventricular myocytes and its current-voltage curves in rabbits with congestive heart failure
CHF 症状出现主要源于交感神经兴奋过度,进而使得肾素-血管紧张素系统释放更多醛固酮、β1肾上腺素类物质作用于心脏和血液系统,引起心室肌细胞Ca2+浓度显著增加,从而引起心室肌电重构,易于诱发触发性室性心律失常[11]。室性心律失常是CHF 患者猝死的主要致死病因,Ca2+拮抗剂能显著防治室性心律失常,降低CHF 患者死亡率。ⅠCA 是从小檗科植物淫羊藿(Epimedium Grandiflorum)茎叶中提取出来的一种δ-异戊烯基黄酮醇苷类化合物。现代药理动物实验研究表明,ⅠCA对实验性动物心室颤动具有明显抑制作用,能够改善ⅠSO 所致大鼠CHF后大鼠左心室重塑,通过多环节和/或多靶点干预心力衰竭进一步恶化[12]。本研究发现,ⅠCA能够明显纠正CHF 已经生成的异常心室电重构,使CHF 兔心室肌细胞的APA增加,Maxdv/dt加快,APD10、APD20、APD50和APD90均明显缩短,直至这些观察值接近正常兔心室肌细胞的相关参数。说明ⅠCA 可以使CHF兔心室肌细胞动作电位传递加快,心率加速,心肌收缩增强,改善原有的缓慢心电传导和衰弱的心脏做功。另外,ⅠCA 能够显著缩短CHF 兔心室的ERP 达到并接近正常值范围,同时减小心室dERP,从而纠正心室电整复姓和电交替性,减少心室电不均一性和跨室壁离散度,消除心室异位起搏点发放冲动所需时间和机会,防止折返性室性心律失常形成所需的条件和途径,从而防止CHF 心脏产生对折返性室性心律失常具有的易感性[13]。在此基础上,ⅠCA使诱发CHF 室性心律失常的BCL 显著缩短,心律失常诱发率明显下降,说明当ⅠCA 作用CHF 兔后,即使给予很快额外刺激,室性心律失常的诱发率也较低,不会像单纯的CHF 心脏,稍微给予一个额外长刺激周期就会诱发室性心律失常,危及生命,显示ⅠCA 具有抗CHF 后室性心律失常的作用。但值得注意是,尽管ⅠCA 能够显著减小CHF 心脏dERP,但这种减小程度仍不能达到正常心脏具有的dERP,这可能与CHF 心脏出现永久性异常病理性结构重构相关,ⅠCA仅能起到预防与治疗CHF 可能出现临床症状,但对根本性逆转CHF 心脏病理结构改变是不能实现的。正因如此,经ⅠCA 作用CHF 兔心脏,虽然诱发室性心律失常的BCL 缩短,诱发率下降,但和正常兔心脏比较,还是存在一定差异[14]。
临床上,CHF 患者容易诱发室性心律失常,出现心脏骤停,其机制可能是心室肌细胞ⅠCa-L增加,通过ⅠCa-L进入心肌细胞内Ca2+增高,诱发Ca2+超载,造成触发电活动发生,从而诱发触发性室性心律失常[15]。而作为我国传统的补肾壮阳中药,淫羊藿具有“益精气,坚筋骨,补腰腰膝,强心力”等功效,其提取有效成分总黄酮能选择性阻断离体及整体动物心肌β1受体,而ⅠCA 能明显抑制心肌细胞上ⅠCa-L,减少Ca2+内流,从而减轻细胞内Ca2+超载,对心脏有一定保护作用,这可能是其抗心律失常的重要机制之一[16]。本研究亦发现,在ⅠCA 的作用下,CHF 心室肌细胞ⅠCa-L明显减小,其最大电流密度峰值略向右偏移,Ⅰ-V 曲线明显上抬,提示ⅠCA 对CHF 心室肌细胞ⅠCa-L具有显著抑制作用,从而避免心肌细胞外过多Ca2+通过ⅠCa-L进入心肌细胞,引起CHF 心肌细胞内Ca2+浓度增加,诱发Ca2+超载及其Ca2+振荡,抑制CHF心脏触发下室性心律失常发生,起到抗CHF 引起的室性心律失常[17]。ⅠCA 能够抑制CHF 心室肌细胞ⅠCa-L,从而缩短APD 及其ERP,增加动作电位下传速度,改善跨心室壁离散度和电不均一性,有利于CHF 心室电重构改善,从而减少CHF 心室对折返性室性心律失常形成的易感性。ⅠCA 对CHF 心室肌细胞ⅠCa-L抑制作用,可能是ⅠCA抗CHF引起折返性和/或触发性室性心律失常的电生理机制[18]。总之,通过本实验结果发现ⅠCA在抗兔CHF 引起的室性心律失常过程中具有非常好的疗效。说明ⅠCA有很好的开发与应用前景,只是在具体应用到临床过程中还需明白ⅠCA 可能只是起到控制CHF 可能出现的临床症状,对逆转CHF 病根还有待商榷。