对乙烯与溴水反应实验中“异常”现象的实证
2020-04-02马占武郭燕
马占武 郭燕
摘要: 针对乙烯与溴水反应实验中出现的“异常”现象,通过实证探索、文献调查等方式进行原因的分析与探讨,得出以下的研究结论: (1)乙烯通入溴水实验中,溶液酸性增强、无油状液滴生成等现象与乙烯的纯度、取代反应等因素无关;(2)乙烯与溴水的反应比较复杂,主要产物是2-溴乙醇和HBr,而通常认知中的1,2-二溴乙烷的产率很低。
关键词: 乙烯; 溴水; 加成反应; 实验探究
文章编号: 1005-6629(2020)03-0061-04
中图分类号: G633.8
文献标识码: B
1 问题背景
乙烯在高中化学有机化合物的学习中具有极其突出的教学地位,它是帮助学生认识有机物结构特点、理解官能团化学性质的重要载体。在组织课堂活动时,针对乙烯使溴水褪色实验的反应原理,学生异口同声一致认定是加成反应(CH2CH2+Br2CH2BrCH2Br),并提出相关的验证方案: 溴水本身酸性不强,若通入乙烯时发生取代反应(CH2CH2+Br2CH2CHBr+HBr),反应过程中会不断生成强电解质HBr,溶液的酸性应明显增强;若是加成反应,产物CH2BrCH2Br属非电解质,伴随着Br2的消耗,由反应Br2+H2OH++Br-+HBrO引起的溶液酸性就会逐步减弱。因此,学生认为可以通过测定实验前后溴水的pH变化可确证反应发生的具体类型。但实验结果却颠覆了预料,实测一定物质的量浓度的溴水中通入乙烯前后溶液的pH,居然从3.41减小到2.53。
如何认识和理解上述实验结果,是不是乙烯与溴水反应的背后还有不为我们所认识的原因存在。笔者带领部分学生组建了问题攻关小组,拟通过实验探索、文献调查等方式,对该“异常”现象进行深入的分析与探讨,以期能获得更为合理、更接近真实的解释。
2 实证过程
2.1 溴水pH的理论计算数据值与实测数据值的比较
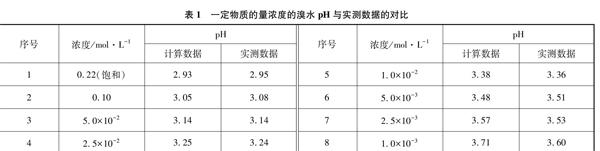
溴水溶液本身有酸性,已知Br2+H2OH++Br-+HBrO室溫下的平衡常数K=7.2×10-9[1],因HBrO酸性较HClO还弱(HBrO的pKa为8.7,大于HClO的7.2[2]),忽略HBrO的电离,我们可近似计算出特定浓度下溴水pH的理论值。文献查得,Br2在水中的溶解度不大,25℃下为3.58g[3],经换算可知饱和溴水的物质的量浓度约为0.22mol·L-1。在实际测定溴水pH时,由于难以采用直接准确量取液溴的方法来配制标准试液,所以选取饱和溴水用蒸馏水稀释特定比例的方式。具体操作过程是: (1)室温下在盛有蒸馏水的棕色试剂瓶中加入足量液溴,用塑料塞密封后置于阴暗处,保存约1周,确保下层仍残留一定量未溶解完的暗红色液溴滴,其中上层深红色溶液即为饱和溴水;(2)取100mL容量瓶,计算并用移液管移取一定体积的饱和溴水,再加蒸馏水定容、摇匀,获得所需特定物质的量浓度的实验用溴水;(3)将pH计进行洗涤并用配套标准液校准,然后分别对以上溴水进行pH测定,待仪器显示稳定后再读数。以上所得理论计算数据与实测数据可参见表1,近似计算所得的结果与实验结果差别不明显。
表1 一定物质的量浓度的溴水pH与实测数据的对比
序号浓度/mol·L-1pH
计算数据实测数据序号浓度/mol·L-1pH
计算数据实测数据
10.22(饱和)2.932.9551.0×10-23.383.36
20.103.053.0865.0×10-33.483.51
35.0×10-23.143.1472.5×10-33.573.53
42.5×10-23.253.2481.0×10-33.713.60
2.2 SO2杂质致酸性异常的实验证伪
针对乙烯通入溴水中酸性增强的异常现象,有学生认为可能源于所用乙烯的纯度不足。实验室常用的乙烯一般通过乙醇在浓硫酸加热条件下脱水获得,因众多副反应的发生势必会混入一定量的SO2等还原性或酸性杂质,在溴水中发生SO2+Br2+2H2O4H++SO2-4+2Br-等反应而导致溶液酸性增强。
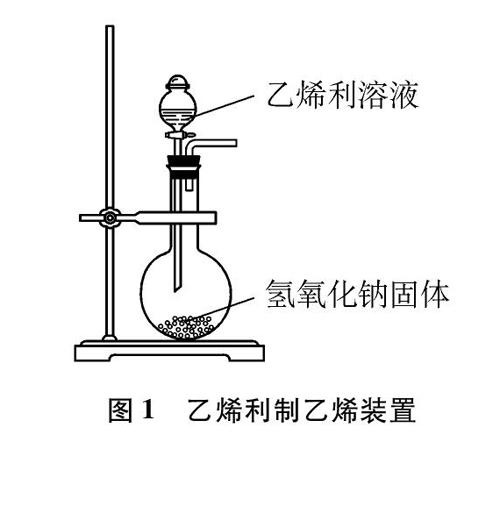
事实是否真如所料?从通入溴水的乙烯入手,我们主要进行了制备、预处理等方面的优化实证。(1)乙烯的充分净化: 将浓硫酸和乙醇加热制得的乙烯依次缓慢通过盛有足量NaOH浓溶液、品红溶液和Ba(OH)2溶液的洗气瓶,并使乙烯与洗液充分接触除杂,当品红溶液红色不变浅且Ba(OH)2溶液不浑浊时表明SO2等已除净。(2)乙烯的制法优化: 为从源头避免SO2等酸性气体产生,采用乙烯利(ClCH2CH2PO3H2)按图1方法[4]直接制备高纯度乙烯进行实验,相关制气原理为ClCH2CH2PO3H2+4NaOHCH2CH2↑+NaCl+Na3PO4+3H2O。
图1 乙烯利制乙烯装置
用上述两种方式获得的乙烯气体,分别通入溴水并检测反应后溶液的pH,与原溴水相比,酸性仍明显增强。可见,乙烯中存在SO2等杂质导致溶液酸性增强的推断不成立。
2.3 乙烯与溴水间取代反应的实验证伪
若通入乙烯时发生取代反应(CH2CH2+Br2CH2CHBr+HBr),在产生HBr致溶液酸性增强的同时,也应伴随有等物质的量的有机产物一溴乙烯的生成,而常温常压下的一溴乙烯是微溶于水的无色气体,据此我们可通过设计实验对取代反应的假设加以检验。
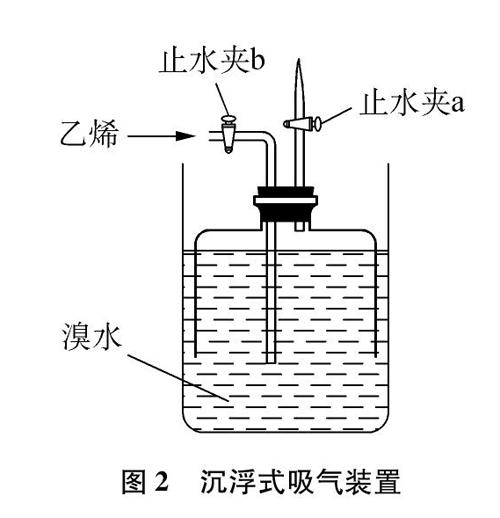
先制作沉浮式气体吸收装置[5](限于篇幅,对具体加工方法不再赘述),按图2组装仪器并检查,确保气密性良好。室温(26℃)下,向装置加入足量橙(红)色溴水,同时打开止水夹a、 b,下压钟罩上部以排尽体系空气后将止水夹a关闭。然后,将通过适量乙烯利制得的纯净乙烯通入,控制钟罩贮气上浮约3~5cm高度时再关闭止水夹b(要注意集气量不能过多,以维持体系中溴水颜色不完全褪去,即能保证有足够的Br2与乙烯反应)。静置一段时间,贮存的气体会不断减少,钟罩也逐步下沉,最终溴水充满钟罩。可见,通常条件下乙烯与溴水反应后装置中根本收集不到新的气体,因此,取代生成HBr和CH2CHBr的假设也与实验事实不符。
图2 沉浮式吸气装置
2.4 乙烯通入不同浓度溴水时的pH变化
为直观显现出乙烯与溴水反应过程中pH的变化,学生实验组以乙烯利制得的纯净乙烯作反应气,缓慢而匀速地通入50mL一定浓度的溴水中,并用pH传感器监测溶液酸性大小与通入时间的实时数据,得到相应的pH-t关系图(如图3为5.0×10-3mol·L-1溴水的实时变化曲线)。当每组实验结束后,再读取最终反应后溶液稳定的pH,具体结果列于表2。可见,任意浓度溴水中通乙烯,溶液pH都会呈现明显的变小过程,且溴水浓度越大,pH变小幅度越显著。
图3 一定浓度溴水与乙烯反应时pH随时间的变化曲线
表2 一定物质的量浓度溴水溶液通乙烯前后的pH
序号浓度/mol·L-1溴水pH
实验前通入后序号浓度/mol·L-1溴水pH
实验前通入后
10.22(饱和)2.950.7951.0×10-23.362.04
20.103.081.1065.0×10-33.512.36
35.0×10-23.141.3872.5×10-33.532.65
42.5×10-23.241.6981.0×10-33.603.01
此外,值得指出的是,实验时除能观察到溶液pH变小与橙黄(红)色逐渐褪去外,各种浓度溴水在实验过程中都未出现明显的油状液滴或浑浊,即使用光束照射丁达尔现象也不明显。文献[6]查得,1,2-二溴乙烷为无色挥发性的液体,微溶于水,熔点9.9℃,沸点131.6℃。若乙烯通入溴水时发生CH2CH2+Br2CH2BrCH2Br,对实验中的溶液酸性增强且没有出现油滴等现象,都无法得到合理的解释。因此,溴水与乙烯反应使溶液褪色的原因,应当不是(或至少不仅仅是)发生了如上的加成反应。
2.5 乙烯与溴水实验现象的理论探讨
為深入探寻实验背后的科学原理,揭示“异常”现象的真正原因,笔者带领学生在检索分析系列相关论文专著的基础上,对乙烯与液溴、乙烯与溴水反应的差异从机理角度进行了比较研究。
实际上,乙烯与溴的反应大致可分为两步。第一步,由于受到π键的影响,Br2会极化成一端带正电荷、一端带负电荷的极性分子(Brδ+—Brδ-),其中带正电荷的溴原子靠近并与乙烯分子双键间的π电子形成π-络合物,再进一步转化成环状溴鎓离子并离去Br-。第二步反应的发生与溶剂环境紧密相关,若是纯液溴(或Br2的CCl4溶液),Br-会从环的反面与碳原子结合,促使溴鎓离子三元环被打开,进而生成1,2-二溴乙烷[7];若是溴水,体系中除Br-外更多还存在溶剂水,两者作为亲核试剂均可进攻溴鎓离子,完成反应并得到1,2-二溴乙烷和2-溴乙醇的混合物。具体过程如图4所示。
图4 乙烯与溴水加成的反应机理
因溴水即使在饱和时的浓度也不是很大,发生第二步亲核试剂进攻时H2O会优先于Br-,所以一般都认为溴代乙醇才是反应的主要产物[8,9]。有学者[10]还通过气相色谱法对乙烯与不同浓度溴水加成产物进行了定量分析,结果也表明主要产物为2-溴乙醇,且随溴水浓度的增大副产物1,2-二溴乙烷所占比例虽略有增加,即使是饱和溴水时也仅为10.2%。不难看出,表2数据正是这一结果在pH角度具体特征的体现。此外,因主产物2-溴乙醇是能与水混溶的无色吸湿性液体,在整个研究过程中见不到油状液滴也就不足为奇了。
3 结论与启示
通过系列实证分析活动,研究小组的成员们在真切感受化学学科魅力、深刻体会化学反应复杂性的同时,对乙烯与溴水的反应也有了更深入的了解,并最终形成如下基本认识与结论: (1)溴水中通入乙烯,溶液褪色的同时酸性也会明显增强且无油状液滴生成,但这些现象与乙烯纯度、取代反应等因素无关。(2)乙烯与溴水的反应复杂,除生成少量1,2-二溴乙烷外,主要产物是2-溴乙醇,即主反应可表示为CH2CH2+H2O+Br2HOCH2CH2Br+HBr。
通过此次实验异常现象的实证分析活动,也让我们对教材内容的编写意图、生成性资源的利用等有了新的理解与认识。从教材编写的科学性层面看,正因为乙烯与溴水实验背后化学反应机理的复杂性,现行几套高中化学教材将实验试剂“溴水”都已改成了“溴的四氯化碳溶液”,这种调整不但有助于简化反应的物质体系,明确指向加成反应生成1,2-二溴乙烷,也使得教材内容更趋合理、严谨、科学。因此,教师需要勤修内功,提高专业知识,对这些内容调整背后的意图做到了然于心。从生成性资源的利用层面看,教师要充分注重实验的教学地位,重视实验教学中的异常现象,积极创设学生参与、体验的机会,引导学生像科学家一样去思考未知问题并提出自己的见解或方案,感悟科学探究的曲折历程,促进学生在体验中以探究方式进行深度学习。相信这样有深度的课堂活动,才能激发学生的创新思维,并最终建立属于学生自己的认知模型,提升学生的学科核心素养。
参考文献:
[1][3]天津大学无机化学教研室. 无机化学(第四版)[M]. 北京: 高等教育出版社, 2010: 284~286.
[2]严宣申. 化学原理宣讲(第1版)[M]. 北京: 北京大学出版社, 2012: 147.
[4]黄勇良. 用乙烯利制备乙烯的方法[J]. 化学教学, 2012, (7): 46~47.
[5]陆燕海, 谢培轩, 忻良. 例谈用塑料瓶改进系列化学实验[J]. 中学化学教学参考, 2007, (8): 37~38.
[6]周公度主编. 化学辞典(第二版)[M]. 北京: 化学工业出版社, 2011: 174.
[7]马瑞红. 溴在有机反应中反应机理的探讨[J]. 考试(教研版), 2007, (5): 61~62.
[8]R. T. 莫里森, R. N. 博依德著. 有机化学(上册)(第1版)[M]. 北京: 科学出版社, 1980: 197~200.
[9]邢其毅, 徐瑞秋, 周政等. 基础有机化学(第二版)[M]. 北京: 高等教育出版社, 1993: 172.
[10]秦丙昌, 何其戈, 刘庆云. 乙烯与溴水加成反应的研究[J]. 化学教育, 2001, (5): 42~43.
