基于核心素养进阶学习的教学设计
2020-04-02叶晨黄志华张文华
叶晨 黄志华 张文华


摘要: 进阶学习从学生已有的经验模型和认知水平出发,通过渐进的学习方式,完成概念和模型的構建。学生通过进阶学习,有效地构建科学模型,培养综合分析及问题解决能力。通过“影响化学反应速率的因素”教学案例,探索基于核心素养的进阶学习模型的构建。
关键词: 进阶学习; 核心素养; 化学反应速率影响因素; 变化观念与平衡思想
文章编号: 1005-6629(2020)03-0029-05
中图分类号: G633.8
文献标识码: B
近十年,国际理科教育提出了学习进阶(Learning Progressions)理念,旨在构建一致性、连贯性的课程,充分调动学生的生活经验和认知发展潜能,为持续性、系统性地理解科学本质和核心概念提供了可操作、更成功的方法。进阶学习由以下五个要素组成: (1)进阶预期——学生预期需要培养的学科素养;(2)进阶维度——学生所需掌握的核心概念;(3)成就水平——反映学生思维发展过程中的关联性和层次性;(4)预期表现——处于特定理解水平的学生完成特定任务时所应呈现的表现;(5)评估方法——测评学生在预期进阶学习路径上的概念、思维、能力的素养的发展水平。进阶学习将科学教育的课程标准、课程大纲、课程内容和学业评价等要素进行整合,为学生的学习和教师的教学提供一个大框架指导[1~3]。
在“化学反应原理”模块的学习中,由于知识本身的系统性和复杂性,学生可以采用阶梯式的路径实现进阶学习,深化对概念的理解和原理的认知。参见表1,以“化学反应速率”学习主题为例,来认识进阶学习在高中化学必修模块和选择性必修模块的系统性和连贯性[4,5]。
表1 “化学反应速率”的进阶学习
进阶预期4通过反应速率实验,认识到方法选择和反应条件控制在化学反应实际应用中的重要性。
进阶预期3认识活化能,能用有效碰撞理论、过渡态理论解释相关化学反应速率问题;
了解化学反应速率的不同测定方法,分析实际测定中的化学问题。
进阶预期2进一步深化化学反应速率的概念,理解化学反应中“平均速率”和“瞬时速率”的意义;
理解浓度、温度、压强、催化剂等因素对化学反应速率的影响;
掌握化学反应速率的定量计算;
认识浓度-时间等相关速率图像和曲线。
进阶预期1掌握化学反应速率的表示方法,能进行简单计算;
定量判断各种类型的化学反应速率的大小关系;
了解化学反应速率随时间的变化情况;
初步认识影响化学反应速率的因素。
1 进阶起点及素养预期
由于不同学习者对必修课程中化学反应速率相关内容的掌握程度有差异,教师可以设计相关教学前测内容来设定进阶学习的起点,对教学内容的选择、安排、难度进行统筹规划。
[教学前测](1)写出影响化学反应速率的内因;(2)写出各类外界因素对化学反应速率的影响;(3)知识迁移与应用: Ⅰ.对于Fe+2HClFeCl2+H2↑,改变下列条件对生成氢气的速率有何影响?①增大盐酸的浓度;②增大铁的质量;③把铁块改成铁粉;④加入氯化钠固体;⑤加入醋酸钠固体;⑥升高温度;⑦滴入几滴CuSO4溶液。
Ⅱ.对于反应N2(g)+O2(g)2NO(g),在恒温恒容条件下进行,下列措施对化学反应速率有何影响?①缩小体积使压强增大;②恒容充入He;③恒压充入He;④加入催化剂。
教师针对某个教学班课前发放了39份教学前测,对前测结果进行了统计和分析。“知识迁移和应用”有89.7%的学生回答正确,另有10.3%的学生对于个别因素还有疑惑,可见学生初步掌握了各种因素对化学反应速率的影响,基本上达成必修模块的素养要求并能解决相关的简单问题。在选择性必修模块中,进阶学习可以以“表1”中的进阶预期3和进阶预期4为顶层设计,注重学生“变化观念”“证据推理”和“模型认知”核心素养的培养。基于学情的分析,选择性必修模块中本主题学生现有的核心素养要求和预设的进阶预期列于表2。
表2 主题核心素养的起点和进阶预期
素养维度素养起点进阶预期
变化观念
平衡思想1. 初步形成化学变化是有条件的大观念;
2. 认识反应条件对化学反应速率的影响;
3. 能分析化学变化的内因和变化的本质。1. 能运用反应原理分析影响反应速率变化的因素;
2. 体会变量控制方法的重要性;
3. 能运用化学变化原理和规律分析实际问题。
证据推理
模型认知1. 能理解、描述和表示化学反应速率中常见的认知模型;
2. 能推测各种因素变化时对化学反应速率的影响。1. 能对复杂化学问题的关键要素进行分析并构建相应的模型;
2. 能选择不同的模型综合解释或解决复杂问题。
科学探究
创新意识能设计简单的实验方案,完成实验操作,记录实验现象,形成实验结论。1. 培养强烈的问题意识,独立完成实验,并基于现象和数据进行分析和总结;
2. 能根据文献和实际需要提出综合性的解决方案,并能进行相关评价和优化。
科学态度
社会责任初步形成了科学态度,意识到化学和社会发展的紧密关系。树立将化学成果应用于生产、生活的意识,用化学理论解决实际化学问题。
2 进阶维度分析和核心教学流程设计
在选择性必修模块进阶学习中,学生预期学会从内因与外因、量变与质变等多维度分析物质和化学变化,认识到化学反应变化是有条件的,用发展、变化、平衡的观点预测某一特定条件下可能发生的化学反应变化。
2.1 进阶维度一: 碰撞理论模型建构
进阶起点: 定性认识了浓度、温度、压强的变化对化学反应速率的影响。
核心素养预期: 构建碰撞理论模型;用碰撞理论来解释三种因素对反应速率的影响;体会化学实验中变量控制方法的重要性。
2.1.1 核心教学内容设计
[情境设置]化学史短视频: 1918年,路易斯运用气体运动论的成果,提出了化学反应速率的碰撞理论。该理论认为,化学反应物分子间的有效碰撞是化学反应的先决条件。化学反应物分子间有效碰撞的频率越高,反应速率越大。
[理论模型探索]构建碰撞理论模型和核心概念。设置问题链: (1)思考有效碰撞和化学反应的联系;(2)思考有效碰撞的前提条件;(3)思考活化分子、活化能、活化分子百分数的概念。
[证据推理]2HI(g)H2(g)+I2(g),在973K、 1L密闭容器中,HI的浓度为1×10-3mol/L,反应物分子碰撞次数每秒3.5×1028次,如果每次碰撞都发生的话,反应速率为5.8×104mol/(L·s),但实验测得实际反应速率为1.2×10-8mol/(L·s)。思考这些数据背后的化学问题。
[认知冲突]只有极少数的碰撞是有效的。深入理解活化分子的有效碰撞是化学反应的先决条件。
[变化观念构建]思考哪些途径可以改变活化分子的浓度来增加有效碰撞的频率。
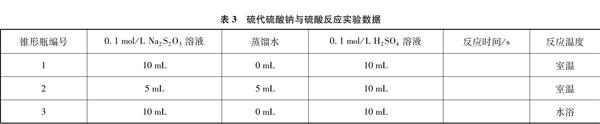
[科学实验探究]学生分组进行硫代硫酸钠与硫酸反应的实验(见表3),体会变量控制在实验中的重要作用。
实验仪器: 50mL锥形瓶、烧杯、试管、温度计、秒表、白纸
表3 硫代硫酸钠与硫酸反应实验数据
锥形瓶编号0.1mol/L Na2S2O3溶液蒸馏水0.1mol/L H2SO4溶液反应时间/s反应温度
110mL0mL10mL室温
25mL5mL10mL室温
310mL0mL10mL水浴
[理论模型应用]由表3实验数据可知,增大硫代硫酸钠溶液浓度和升高温度都能加快反应速率。小组合作,尝试用碰撞理论模型解释化学反应速率加快的本质原因。
2.1.2 学习障碍点分析及教学突破
学习任务障碍点一: 有效碰撞的核心概念。教学者抽取一位男生示范标准投篮动作并向其他同学分解投篮动作要领,从而类比迁移到有效碰撞发生的条件。学生通过生活的实际经验联想,明确足够的能量和合适的取向是有效碰撞发生的必要条件,深入理解活化分子、活化能、活化分子百分数等核心概念。
学习任务障碍点二: 哪些途径可以增加有效碰撞的频率。学生在课堂学习中能合理解释浓度增大引起单位体积内活化分子数增加,从而加快有效碰撞频率。但在分析温度升高这个因素时,学生无法用专业化学术语来解释本质原因。教学者通过展示分子能量和分子百分数的正态分布曲线,直观对比升温后的正态分布曲线变化,引导学生明确在不改变反应物浓度的基础上可以通过升温来增加活化分子百分数,从而加快反应速率。
学习任务障碍点三: 学生小组合作,自主确定实验操作环节和试剂添加顺序。学生需要认真体会变量控制在科学实验和研究中的重要作用,深切感知在实验、生活、生产中,化学试剂、药品的纯度、浓度、温度等各种因素对化学反应速率有重要影响。在学生充分的自主设计基础上,教师适时指导学生完成科学实验。
学习任务障碍点四: 有效碰撞理论的适用范围。学生在理论和实验分析的基础上,学会了用碰撞理论解释浓度和温度的影响,但是对有效碰撞理论的适用范围并不太清楚。教师可以引导学生尝试用碰撞理论来解释压强、催化剂对化学反应速率的影响,从而引发新的认知冲突,用碰撞理论解释催化剂的影响比较困难。
2.2 进阶维度二: 过渡态理论模型建构
化学动力学、热力学对化学反应的速率和反应机理的研究有重要的作用,对进一步学习化学平衡等相关化学反应原理课程的进阶学习有深远的影响。
进阶起点: 定性认识催化剂对反应历程的影响;初步建构碰撞理论模型;能简单运用化学反应原理分析影响化学反应速率变化的因素。
核心素养预期: 建构过渡态理论模型;用过渡态理论来解释催化剂对反应速率的影响;能对复杂化学问题的关键要素进行分析并建构相应的模型。
2.2.1 核心教学内容设计
[认知冲突]能否用碰撞理论解释催化剂对化学反应速率的影响?
[情境设置]化学史(1): 1930年,艾林提出了过渡状态理论,1935年由A.G.埃文斯和M.波拉尼提出了“绝对反应速率理论(absoluterate theory)”。反应物分子并不只是通过简单碰撞直接形成产物,而是必须经过一个形成高能量活化络合物的过渡状態,并且达到这个过渡状态需要的一定的活化能,再转化成生成物。化学史(2): 介绍1999年诺贝尔化学奖——美国科学家泽维尔教授用飞秒分光技术观察化学反应的过渡状态。
[理论模型探索]构建过渡态理论模型和核心概念。设置问题链: (1)思考科学家为什么会提出过渡态理论;(2)思考反应物到高能量过渡态,再从高能量过渡态到生成物的能量变化;(3)思考活化能高低对反应速率快慢的影响;(4)思考催化剂是通过什么途径加快反应速率。
[理论模型归纳]小组合作,教师引导探讨并绘制无催化剂和有催化剂条件下化学反应历程与能量变化图(见图1),明确催化剂是通过降低反应活化能来增大化学反应速率的。
图1 无催化剂和有催化剂条件下化学反应历程与能量变化
[前沿化学热点介绍]催化剂是改变化学反应速率最有效的手段之一,工业上涉及的90%以上化学反应都使用催化剂。在环保领域,汽车尾气净化催化剂研发过程经历了从贵金属三效催化剂、稀土型掺杂型催化剂到复合金属氧化物型催化剂的发展。
2.2.2 学习障碍点分析及教学突破
学习任务障碍点一: 过渡态理论的适用范围。催化剂对反应速率的影响是一个复杂的化学问题,教学者利用化学史情境引出认知冲突,反应物分子并不只是通过简单碰撞直接形成产物,从而明确科学理论模型是不断发展的,培养学生强烈而持久的求知欲和探索精神。
学习任务障碍点二: 反应活化能高低和反应速率的关系。教师引导学生从已有的热化学知识出发,认识不稳定的高能量过渡状态,挖掘反应活化能与反应速率的关系。
学习任务障碍点三: 催化剂对化学反应速率的本质影响。学生无法直接理解反应物与催化剂形成中间产物,再由中间产物变为产物的总活化能,要比反应物之间直接反应生成生成物的活化能小得多。教师通过直观数据对比,用图示的方法将催化剂对反应过程的影响表征出来,从而明确催化剂通过降低反应的活化能,增加活化分子百分数的途径来加快反应速率。
2.3 进阶维度三: 化学速率问题解决模型
进阶起点: 初步建构了碰撞理论和过渡态理论模型;能简单运用化学变化原理和规律分析实际问题。
核心素养预期: 能选择不同的模型综合解释或解决复杂问题。
2.3.1 核心教学内容设计
[理论模型应用1]有研究表明生成NaClO3的反应分两步进行: Ⅰ.2ClO-ClO-2+Cl-; Ⅱ.ClO-2+ClO-ClO-3+Cl-。常温下,反应Ⅱ能快速进行,但是氯气与氢氧化钠溶液反应很难得到NaClO3,试用化学反应原理解释其原因。
[理论模型应用2]NO在空气中存在如下反应: 2NO(g)+O2(g)2NO2(g), ΔH<0。此反应分两步进行: Ⅰ.2NO(g)N2O2(g), ΔH1<0; Ⅱ.N2O2(g)+O2(g)2NO2, ΔH2<0。反应Ⅰ的反应速率数值较大,是一个快反应,而反应Ⅱ是一个慢反应。试用过渡态理论来确定哪步反应是反应速率的决速步骤,并绘制化学反应历程与能量变化图像。
[理论模型归纳]小组合作,用思维导图来呈现影响化学反应速率的理论模型认知发展过程,见图2。
2.3.2 学习障碍点分析及教学突破
学习障碍点一: 对复杂化学问题关键要素进行分析,并选择合适的理论模型。改编一道2016年浙江省普通高校招生选考化学科目考试题,原题指定用碰撞理论来解释原因。教师删除了指定条件,增加了问题难度,预期希望学生能对问题进行预判,选择合适的理论分析问题。但学生的课堂反馈并未达到预期,说明理论模型的建构不到位。教师需要引导学生从碰撞理论的活化能、有效碰撞频率角度来思考此问题,并且在后续教学中要强化复杂化学问题的关键要素分析。
学习障碍点二: 综合化学问题的信息处理。应用2中,学生需要对化学问题进行文字图像转换“快反应反应速率快,图像表征为活化能低;慢反应反应速率慢,
图2 影响化学反应速率的理论模型认知发展过程思维导图
图像表征为活化能高”。在思考多步反应中速率控制步骤时,教师应引导学生思考活化能高、比较难进行的反应是速率控制步骤,因此在实际生产中可以通过选择慢反应的合适催化剂来加快总反应速率。
3 进阶学习发展水平评估及教学反思
一个新的理论、概念学习之后,教师需要设计一个完整的进阶学习评价体系,包括课内的评价和课后的评价。为了评估学生对碰撞理论和过渡态理论模型的认知水平,笔者在授课结束后的课间对学生进行了简要测试。后测问卷的编制主要是以表2核心素养的进阶预期为依据,因课间时间限制,测试题为下列选择题:
反应2N2O5(g)4NO2(g)+O2(g)经历如下历程: 第一步N2O5NO3+NO2,快速平衡;第二步NO2+NO3NO+NO2+O2,慢反应;第三步NO+NO32NO2,快反应。其中可近似认为第二步反应不影响第一步的平衡。下列表述正确的是 (填标号)。
A. v(第一步的逆反应)>v(第二步反应)
B. 反应的中间产物只有NO3
C. 第二步中NO2与NO3的碰撞仅部分有效
D. 第三步反应活化能较高
问卷发放39份,全数收回,结果显示,53.85%的学生双选完全正确,33.33%的学生单选C选项,另有7.7%的学生错选D。后测结果显示,学生初步完成了碰撞理论、过渡态理论模型的构建,能对相关问题基于反应原理角度进行判断和分析,基本达成本主题核心素养的进阶预期。
教师在课后还对不同层次发展水平的学生进行学习访谈,从学生的主体需求对本次教学进行了反思: (1)部分学生认为概念理解没问题,但是对实际问题的分析无从入手,不知道选择哪个模型进行分析;(2)部分学生认为课堂进展偏快,有些知识点还处于一知半解状态,对概念、理论的讲解还需要进一步深化;(3)部分学生觉得问题分析基本没问题,但是用专业化学术语描述比较困难。因此,教师在本次课程结束之后,还需要设计基于原理的化学速率综合问题的进阶课程,以培养学生复杂化学问题的分析和解决能力。教师从“影响化学反应速率的因素”主题设计中,认识到进阶学习的连贯性、科学性和发展性。进阶学习可以呈现学生在学习、研究化学学科主题和概念时,逐步从简单到复杂、从低水平到高水平、从陌生到熟练,对化学反应原理核心概念和理论系统的构建产生深远影响。
参考文献:
[1]Duschl R., Maeng S., Sezen A.. Learning progressions and teaching sequences: a review and analysis [J]. Stud. Sci. Educ., 2011, 47(2): 123~182.
[2]Gobert J., Buckley B.. Introduction to modelbased teaching and learning in science education [J]. Int. J. Sci. Educ., 2000, 22(9): 891~894.
[3]Khan S.. Modelbased inquiries in chemistry [J]. Sci. Educ., 2007, (91): 877~905.
[4]中華人民共和国教育部制定. 普通高中化学课程标准(2017版)[S]. 北京: 人民教育出版社, 2018.
[5]刘晟, 刘恩山. 学习进阶: 关注学生认知发展和生活经验[J].教学学报, 2012,(4): 81~86.
