阳春砂仁生品与盐制砂仁不同溶剂萃取物抑菌效果比较
2020-04-02曹冠华王希付李晓岗肖进宝赵荣华
曹冠华,张 雪,王希付,熊 记,王 杰,李晓岗,肖进宝,赵荣华,贺 森
(云南中医药大学中药学院,云南昆明 650500)
砂仁(Fructusamomi)又名小豆蔻,多年生草本姜科植物,其花、果、根、茎、叶均可入药[1]。砂仁为历代常用中药,含多种活性成分[2],其中以挥发油含量居多。中医认为砂仁性温、味辛,归胃经、脾经、肾经,具有化湿开胃、温脾止泻、理气安胎等功效[3]。砂仁根据其不同的炮制方法可分为盐砂仁、姜砂仁及酒制砂仁等,但目前临床上常用的是砂仁生品和盐制砂仁。砂仁盐制工艺指砂仁生品经一定浓度的盐水闷润后,高温炒炙后的产品。砂仁盐炙后主归肾经,辛温之性略减,温而不燥,能引药下行,增强理气安胎、温肾缩尿的作用[4]。目前国内外对砂仁的有效成分及药理作用进行了大量的研究,但对砂仁抑菌研究相对较少,唐建阳等[5]研究发现砂仁粗提物对枯草芽孢杆菌、沙门氏菌、大肠杆菌、葡萄球菌、肺炎克雷伯菌等均具有一定的抑制效果;高林林等[6]、钟旭美等[7]进一步研究发现,砂仁中的黄酮类物质在抑菌效果中起到主要作用,尤其是60%乙醇浸提下的产物对金黄色葡萄球菌、枯草芽孢杆菌、大肠杆菌和绿脓杆菌具有更好的抑制效果。但目前尚无关于砂仁和砂仁炮制品不同溶剂萃取物抑菌效果的报道。砂仁作为天然植物抑菌剂[8],具有广谱、高效、毒副作用小,安全性较高等优点,具有西药不具备的优势,在食品、药品、化妆品等领域具有广阔的应用前景[9]。本实验对砂仁生品和盐制砂仁的抑菌效果进行了对比分析,为砂仁抑菌剂的研究及相关产品的开发提供了数据支持和理论依据,同时也为进一步探讨砂仁的抑菌机理提供了参考。
1 材料与方法
1.1 材料与仪器
阳春砂仁 选取的砂仁呈椭圆形或卵圆形,表面棕褐色,密生刺状突起,顶端有花被残基,基部具果梗;种子团饱满紧实,表面棕红色或暗褐色的新鲜砂仁(水分含量为78.52%),此种砂仁活性成分含量较高[10],采自于云南省红河金平县阳春砂仁基地,由云南中医药大学赵荣华教授鉴定确定为阳春砂仁;大肠杆菌(Escherichiacoli)、金黄色葡萄球菌(Staphylococcusaureus)、枯草芽孢杆菌(Bacillussubtilis) 云南大学微生物重点实验室;无水乙醇、石油醚、乙酸乙酯、正丁醇、氯化钠、蛋白胨、酵母粉等 均为分析纯。
SK7210HP型超声波清洗器 上海科导超声仪器有限公司;LABOROTA4010型旋转蒸发仪 Heidolph;SHB-III型循环水式多用真空泵 郑州长城科工贸有限公司;MJ系列恒温恒湿培养箱 上海一恒科技有限公司;WFZ UV-4802H型紫外可见分光光度计 尤尼柯(上海)仪器有限公司;CS1011型电热鼓风干燥箱 中华人民共和国重庆实验设备厂。
1.2 实验方法
1.2.1 砂仁的炮制 取净砂仁,加盐水拌匀,室温闷润1 h,待盐水吸尽后用文火炒干(水分含量为9.42%),取出晾凉。每100 g砂仁用食盐2.5 g[4]。
1.2.2 砂仁乙醇提取物及不同溶剂萃取物的制备 采用有机溶剂热浸法结合超声法对砂仁进行有效成分的提取[11]。取砂仁生品与盐砂仁打粉,过60目筛,将粉末分别用65%、75%、95%的乙醇(浸提固液比1∶10 (m/v))浸泡1 h,60 ℃超声(功率300 W,频率40 kHz)3 h,,提取两次,合并滤液。滤液经旋转蒸发浓缩至粘稠,挥去有机溶剂,冷冻干燥,得砂仁醇提物,备用。通过比较不同乙醇浓度砂仁生品、盐制砂仁的得率以及抑菌效果筛选出最佳提取浓度。
得率(%)=干燥后砂仁提取物质量/原料质量×100
将最佳提取浓度提取的砂仁醇提物复溶于蒸馏水中,按极性由小到大,依次用石油醚、乙酸乙酯、正丁醇进行萃取,有机溶剂与醇提物体积比为2∶1,萃取3~4次。将各组分萃取液蒸发浓缩,得到萃取物的浸膏,干燥称量,储存于4 ℃冰箱中备用。
1.2.3 抑菌活性的测定
1.2.3.1 培养基的配制 LB培养基:蛋白胨10 g、酵母粉5 g、氯化钠5 g、琼脂18 g,加水定容至1 L,适度加热使培养基均匀溶解,调整pH至7.0~7.2,于高压灭菌锅中121 ℃灭菌20 min。
1.2.3.2 供试菌悬液的制备及浓度的测定 菌种活化:从4 ℃冰箱中取出冷冻保存的大肠杆菌、金黄色葡萄球菌、枯草芽孢杆菌,用无菌接种环挑取单菌落,划线培养于营养琼脂平板培养基上,置于37 ℃恒温培养箱中倒置培养24 h,得单菌落[12]。挑取活化后的单菌落,用无菌纯水制备成菌悬液备用。
将离心管置于烘箱中干燥至恒重,自然冷却后称重,记为质量m1,准确量取10 mL菌液进行离心(3500 r/min,10 min),倾去上清液,将菌体烘干至恒重,自然冷却后称重,记为质量m2,根据菌体的质量m=m2-m1,计算菌体浓度。
1.2.3.3 供试菌液浓度的确定 采用梯度稀释法[13],吸取1 mL上述菌悬液加入到9 mL无菌纯水中并稀释,选取5个稀释度,各吸取0.2 mL分别加入到含有营养琼脂培养基的培养皿中,涂布均匀,于37 ℃下恒温培养24 h。要求菌长满整个培养基且生长分布均匀,从中选出生长情况一致的平板,并以该稀释度菌液作为供试菌液浓度,进行后续抑菌实验。
1.2.3.4 不同溶剂萃取物抑菌圈直径的测定 将LB培养基经高压灭菌后倒入平板中,待培养基凝固后,在无菌状态下分别取0.2 mL大肠杆菌、金黄色葡萄球菌、枯草芽孢杆菌的供试菌液于平板中均匀涂布,静置待培养基吸取菌液,备用。
采用滤纸片法测定抑菌圈的大小[14]。分别精密称取砂仁生品与盐制砂仁不同浓度乙醇浸提物及不同溶剂萃取物的干燥粉末复溶于无菌纯水中,超声溶解,调整样液浓度为0.1 g/mL,分别取2 mL于小试管中。用打孔器制作直径7 mm的无菌滤纸片,放入装有样液的小试管中浸泡2 h,以无菌纯水作对照,每组试验设3个重复。将浸泡后的纸片排布在带菌平板上,各滤纸片间距离均等,37 ℃,恒温培养24 h。观察并用游标卡尺准确测量抑菌圈直径。当抑菌圈直径大于7 mm时,则表示有抑菌作用;若对照组产生抑菌圈,则试验失败无效。
1.2.3.5 石油醚萃取物抑菌谱测定 分别将盐制砂仁与砂仁生品的石油醚萃取物配制为0.1 g/mL溶液,之后进行梯度稀释,稀释倍数分别为10倍、100倍、1000倍;将直径7 mm的无菌滤纸片浸泡于稀释液中2 h。按上述方法制作带菌平板,将浸泡于不同稀释浓度的滤纸片整齐排布于带菌平板上,以浸泡无菌纯水的滤纸片为对照,37 ℃恒温培养24 h,观察并测量抑菌圈。
1.2.4 最低抑菌浓度(MIC)测定 取砂仁生品及盐制砂仁的石油醚萃取物,用无菌水溶解,将其配置为10 mg/mL的溶液,用琼脂平板连续稀释法将提取物进行稀释[15],分别制作成抑菌浓度为3.0、2.5、2.0、1.5、1.0、0.5 mg/mL的培养基,待培养基凝固后,用移液枪分别吸取0.2 mL大肠杆菌、金黄色葡萄球菌、枯草芽孢杆菌供试菌液于不同抑菌浓度的平板中,用涂布棒均匀涂布,37 ℃恒温培养24 h,以不加石油醚萃取物的20 mL LB培养基平板作为空白对照。观察有无细菌生长,用同样的方法,升高或降低抑菌浓度,观察大肠杆菌、金黄色葡萄球菌、枯草芽孢杆菌菌落生长情况,并计算3种供试菌种的最低抑菌浓度。
1.3 数据处理
采用软件SPSS 21.0中的单因素方差分析(One-way Anova)(>2个样本)或独立样本T检验(2个样本)对本文数据进行方差分析。采用软件GraphPad Prism 5作图。
2 结果与分析
2.1 砂仁生品与盐制砂仁不同浓度乙醇浸提物得率比较分析
以不同浓度的乙醇对砂仁生品和盐制砂仁分别进行提取、精密称量。由表1可知,醇提物的得率由高到低顺序依次为:65%乙醇>75%乙醇>95%乙醇,这可能是由于砂仁中含有多糖、黄酮苷类等非挥发性成分物质,随着乙醇浓度升高溶剂极性降低,导致非挥发性成分溶出减少,醇提物得率逐渐降低[16-18]。此外,砂仁中的挥发油也易溶于极性较高的溶液中。醇提物盐制砂仁的得率整体都大于砂仁生品,推测由于盐制过程中高温致使部分有效成分的化学性质发生变化,部分有效成分溶出增加,得率增加[19-20]。但不同浓度醇提物的抑菌效果可能存在差异,故本实验进一步考察了不同浓度醇提物的抑菌效果。
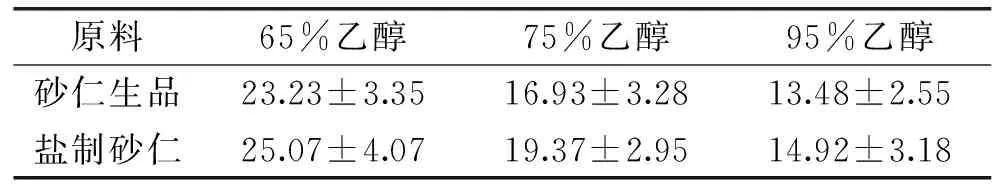
表1 砂仁生品与盐制砂仁不同浓度乙醇浸提物得率(%)Table 1 Extract rates of Fructus amomi and itssalt-processed products with different concentration ethanol(%)
2.2 砂仁生品与盐制砂仁不同浓度乙醇浸提物抑菌效果比较分析
由图1可知,对于砂仁生品来说,与对照组相比,95%和75%乙醇浸提物对于3种供试菌的抑制效果明显,且二者均优于65%乙醇浸提物,但95%和75%乙醇浸提物之间差异无显著性。65%乙醇浸提物对大肠杆菌和金黄色葡萄球菌无抑制效果;对枯草芽孢杆菌具有一定的抑制效果。因此,对于砂仁生品,95%乙醇浸提物对3种供试菌的抑菌效果最好。
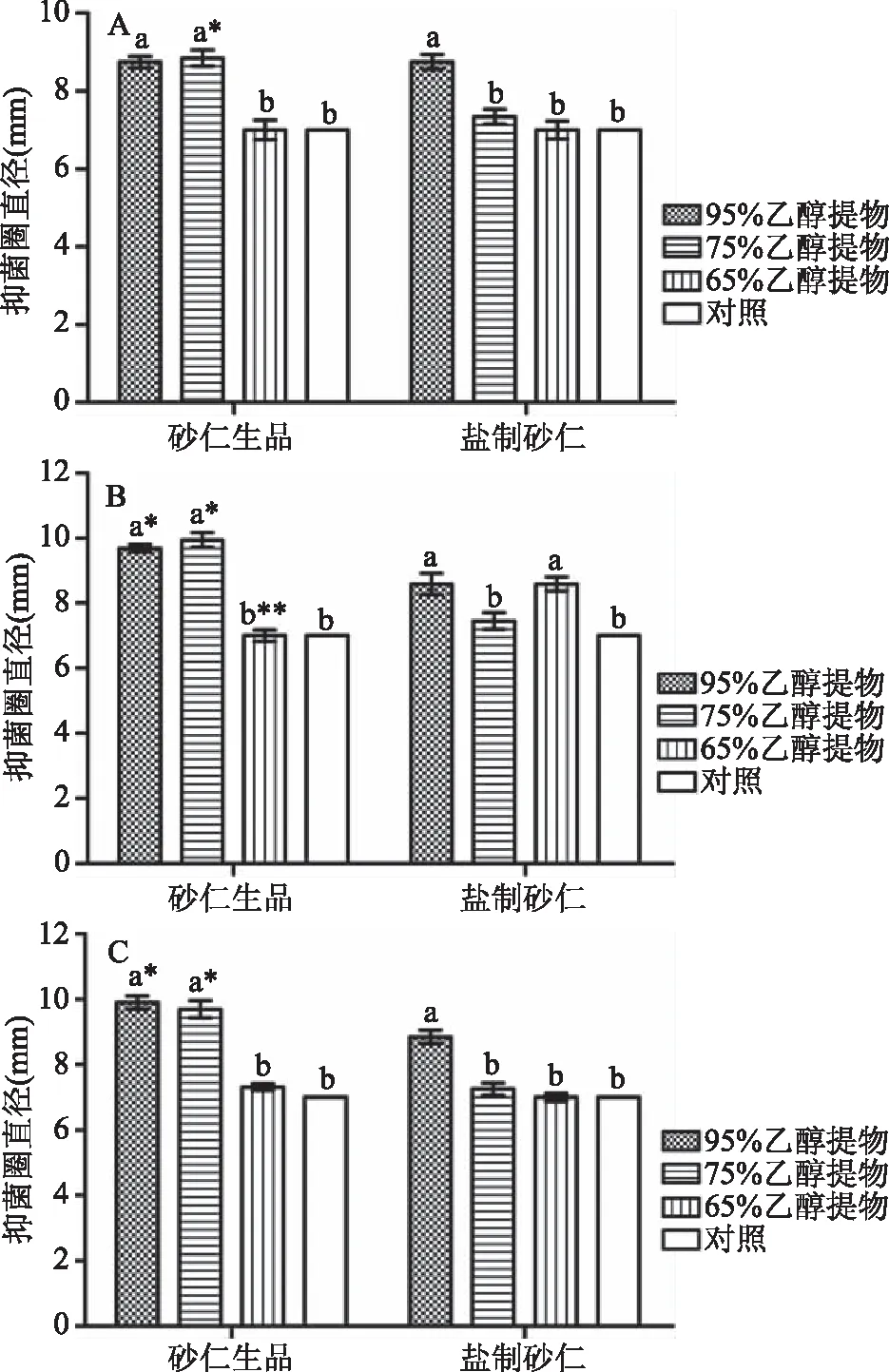
图1 砂仁生品和盐制砂仁不同浓度乙醇提取物抑菌效果Fig.1 Bacteriostatic effect of different ethanol extractsmade from Fructus amomi and salt-processed products注:A、B、C分别表示供试菌为大肠杆菌、金黄色葡萄球菌和枯草芽孢杆菌;不同的小写字母代表同一砂仁制品(砂仁生品或盐制砂仁)不同浓度乙醇提取物对同一种菌的抑制效果差异显著,P<0.05;*代表相同乙醇浓度砂仁生品和盐制砂仁提取物对同一种菌的抑制效果差异显著,P<0.05;**代表差异极显著,P<0.01;图2、图4同。
对于盐制砂仁来说,95%乙醇提取物对于3种供试菌的抑制效果均优于75%乙醇浸提物。65%乙醇浸提物对大肠杆菌和枯草芽孢杆菌均无抑制效果,但对金黄色葡萄球菌抑菌效果显著(P<0.05),抑菌圈直径与95%乙醇相同,均显著(P<0.05)高于75%乙醇浸提物。此外,95%乙醇提取物对大肠杆菌和枯草芽孢杆菌的抑制效果与75%、65%乙醇浸提物抑制效果相比,均差异显著(P<0.05),但后两者之间则无显著差异。因此,对于盐制砂仁来说,同样是95%乙醇浸提物对三种供试菌的抑制效果最好。
对比同一浓度的乙醇浸提物抑菌效果发现,砂仁生品95%乙醇浸提物对金黄色葡萄球菌和枯草芽孢杆菌的抑制效果均显著优于盐制砂仁(P<0.05),而对大肠杆菌的抑制效果一致,抑菌圈直径均为8.75 mm。砂仁生品75%乙醇提取物对3种供试菌的抑菌圈直径均大于盐制砂仁,呈显著差异(P<0.05)。此外,砂仁生品和盐制砂仁65%乙醇浸提物分别对枯草芽孢杆菌和金黄色葡萄球菌有一定的抑制作用,其余全无抑制效果。黄酮和精油是砂仁中起抑菌作用的主要成分,但精油易挥发,在砂仁醇提物中起到抑菌作用的多为黄酮类物质[6,7,21]。此外,研究发现高浓度的乙醇或甲醇是提取砂仁中黄酮类物质的有效溶剂[7,16,22],这与本实验所得的结果一致,故综合考虑,本文后续实验选择95%乙醇作为砂仁生品和盐制砂仁的提取溶剂,提取有效成分,并通过冷冻干燥、无菌水复溶,制成0.1 g/mL的醇浸提溶液用于后续实验。
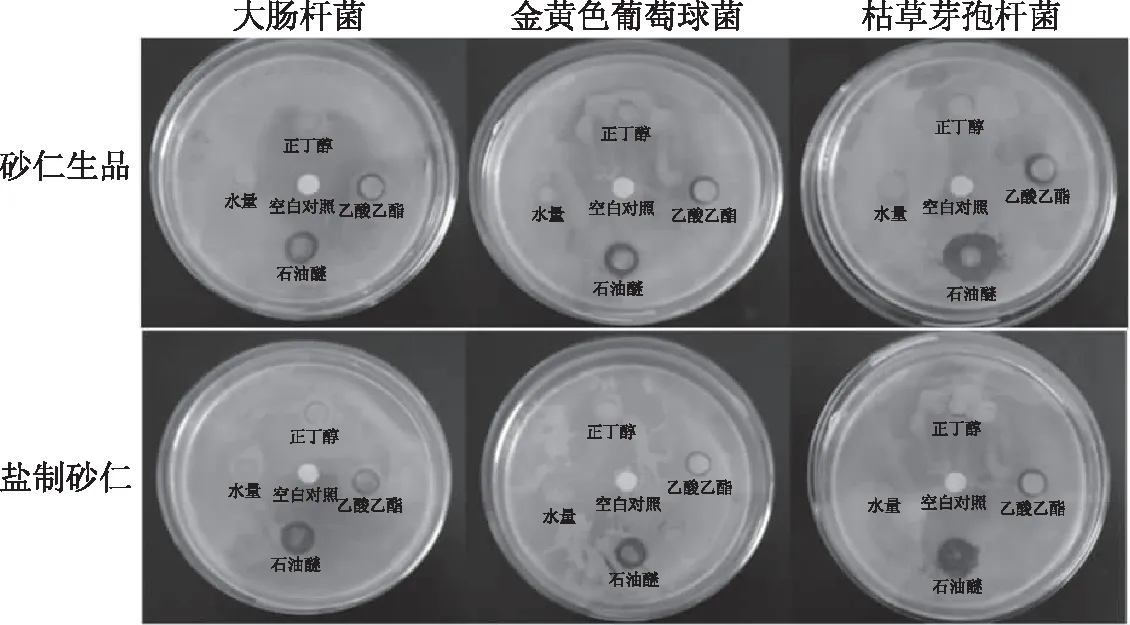
图3 砂仁生品和盐制砂仁不同溶剂萃取物抑菌效果平板直观图Fig.3 Illustrative diagram of bacteriostatic effect of different extracts madefrom Fructus amomi and its salt-processed products in plates
2.3 不同溶剂萃取物抑菌效果比较分析
依次用石油醚、乙酸乙酯、正丁醇萃取醇提物,无菌水复溶后制得不同萃取物溶液。由图2、图3可知,不同溶剂萃取物的抑菌效果差异较大,对于砂仁生品来说,石油醚、乙酸乙酯、正丁醇和水层萃取物对3种菌的抑制效果趋势一致,均为石油醚>乙酸乙酯>正丁醇 ≥ 水层。除与乙酸乙酯萃取物对大肠杆菌抑制效果相比无显著差异外,石油醚萃取物对3种菌的抑菌圈直径与乙酸乙酯萃取物、正丁醇萃取物、水层萃取物相比,均呈显著差异(P<0.05)。乙酸乙酯萃取物对大肠杆菌的抑制效果显著优于正丁醇(无抑菌效果)(P<0.05),但作用于金黄色葡球菌和枯草芽孢杆菌时则无显著差异。此外,横向比较发现,石油醚、乙酸乙酯、正丁醇萃取物对3种菌的抑制效果顺序分别为:枯草芽孢杆菌>金黄色葡萄球菌>大肠杆菌,大肠杆菌>枯草芽孢杆菌>金黄色葡萄球菌,枯草芽孢杆菌>金黄色葡萄球菌>大肠杆菌。由此可知,不同溶剂萃取物对供试菌的抑制效果不同,但其抑制效果均为逐级递减,推测抑菌活性物质多保留在石油醚萃取物,且在逐级萃取过程中有所损失。
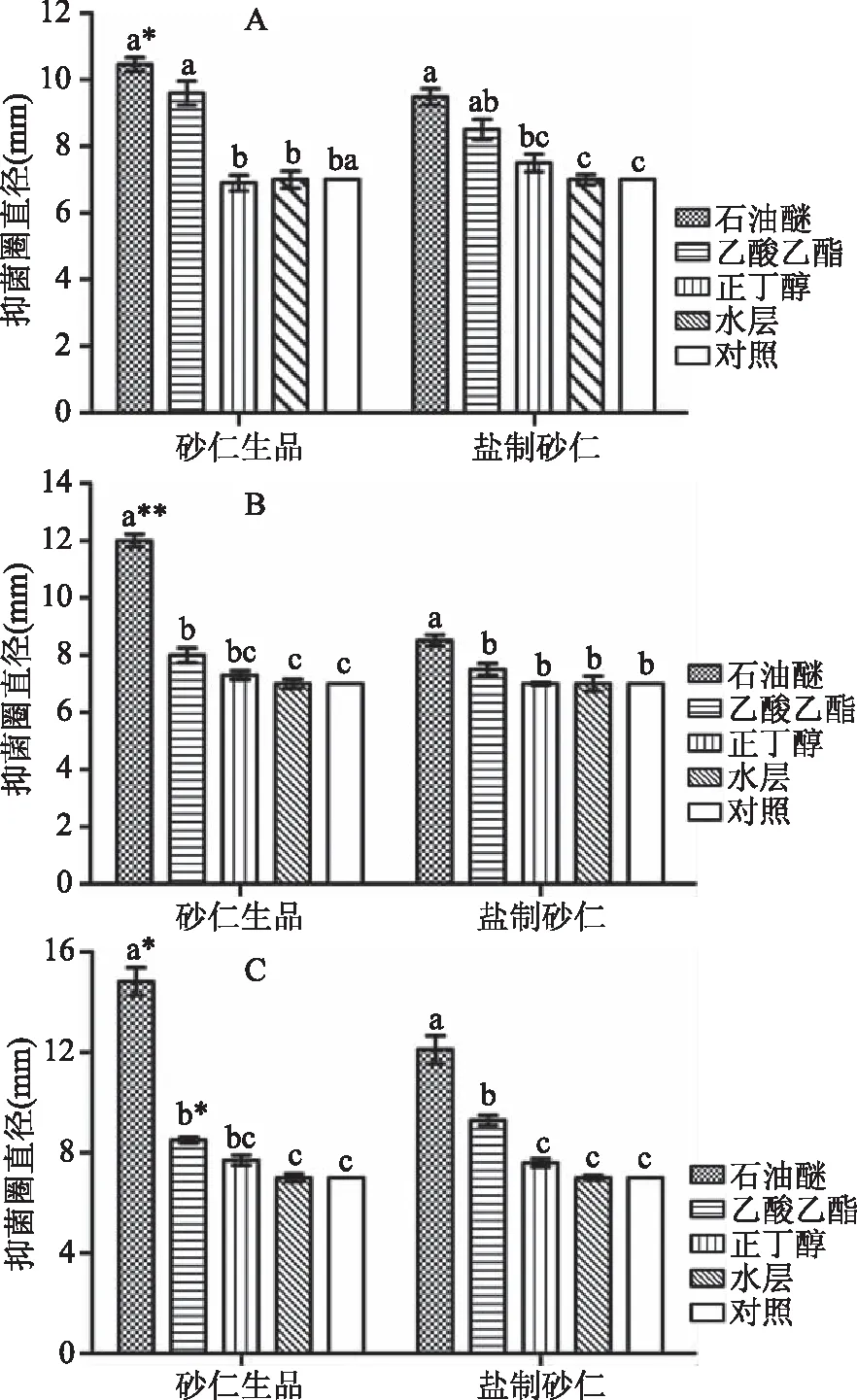
图2 砂仁生品和盐制砂仁不同溶剂萃取物抑菌效果Fig.2 Bacteriostatic effect of different extracts madefrom Fructus amomi and its salt-processed products
对比盐制砂仁不同溶剂萃取物对3种菌的抑制效果发现,其与砂仁生品变化规律一致,均为石油醚>乙酸乙酯>正丁醇 ≥ 水层。供试菌为大肠杆菌时,石油醚与乙酸乙酯萃取物抑菌效果无显著差异,而之于金黄色葡萄球菌和枯草芽孢杆菌则差异显著(P<0.05)。石油醚与正丁醇萃取物对于3种菌的抑菌圈直径之间则均为显著差异(P<0.05)。乙酸乙酯与正丁醇萃取物对3种菌的抑制效果,仅作用于枯草芽孢杆菌时,二者之间差异显著(P<0.05),而对于大肠杆菌和金黄色葡萄球菌则无显著差异。此外,横向比较结果显示,石油醚萃取物对枯草芽孢杆菌抑制效果最优,其次为大肠杆菌,金黄色葡萄球菌次之;乙酸乙酯和正丁醇萃取物对3种菌的抑制效果同石油醚萃取物变化规律一致,抑菌圈直径均为:枯草芽孢杆菌>大肠杆菌>金黄色葡萄球菌。该实验结果表明,砂仁经过盐制后,其抑菌成分发生了一些变化。与砂仁生品相比,不同溶剂萃取物对3种供试菌的抑制效果已有所变化,但具体是哪些成分发生了变化需要进一步研究。
对比砂仁生品与盐制砂仁相同溶剂萃取物抑菌效果发现,砂仁生品石油醚萃取物对3种菌的抑制效果均优于盐制砂仁,且对大肠杆菌、枯草芽孢杆菌的抑制效果呈显著差异(P<0.05)、对金黄色葡萄球菌的抑制效果呈极显著差异(P<0.01)。砂仁生品乙酸乙酯萃取物对大肠杆菌和金黄色葡萄球菌的抑制效果同样优于盐制砂仁,且对前者的抑制效果呈显著差异(P<0.05);而砂仁生品、盐制砂仁正丁醇萃取物对3种菌的抑制效果之间则无显著差异。总体来看,砂仁生品的抑菌效果明显优于盐制砂仁,最主要的原因是砂仁盐制过程破坏了抑菌成分,如砂仁精油[23],但盐制砂仁温而不燥,在理气安胎、温肾缩尿等临床方面具有良好的效果[4]。
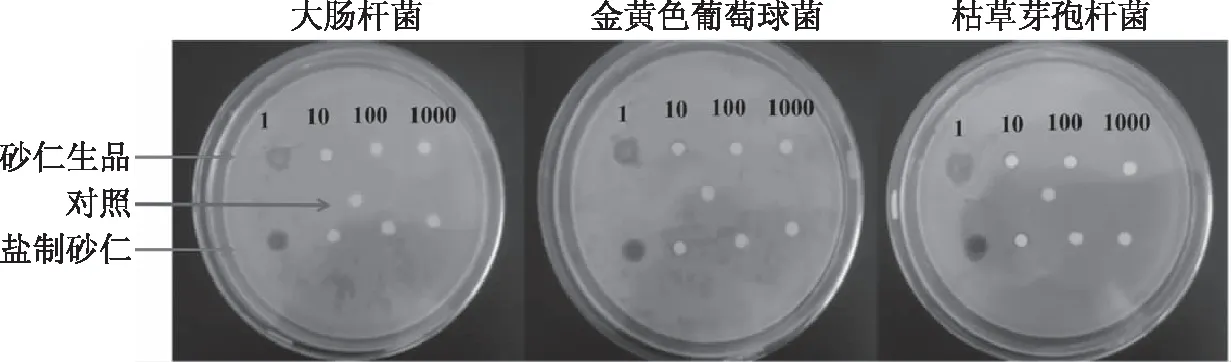
图5 石油醚萃取物的抑菌效果直观图Fig.5 Illustrative diagram of bacteriostatic effect of petroleum ether extract made from Fructus amomi and its salt-processed products
2.4 石油醚萃取物抑菌谱测定结果
选取对3种菌具有较好抑制效果的石油醚萃取物进行梯度稀释,考察其抑菌谱。由图4、图5可知,随着稀释倍数的递增,砂仁生品和盐制砂仁的抑圈直径逐渐变小,直至1000倍时的无任何抑制作用。在各稀释倍数条件下,砂仁生品石油醚萃取物对枯草芽孢杆菌抑制效果最优,其次为大肠杆菌、金黄色葡萄球菌。不同盐制砂仁石油醚萃取物稀释浓度对3种供试菌的抑制效果变化规律同砂仁生品一致。
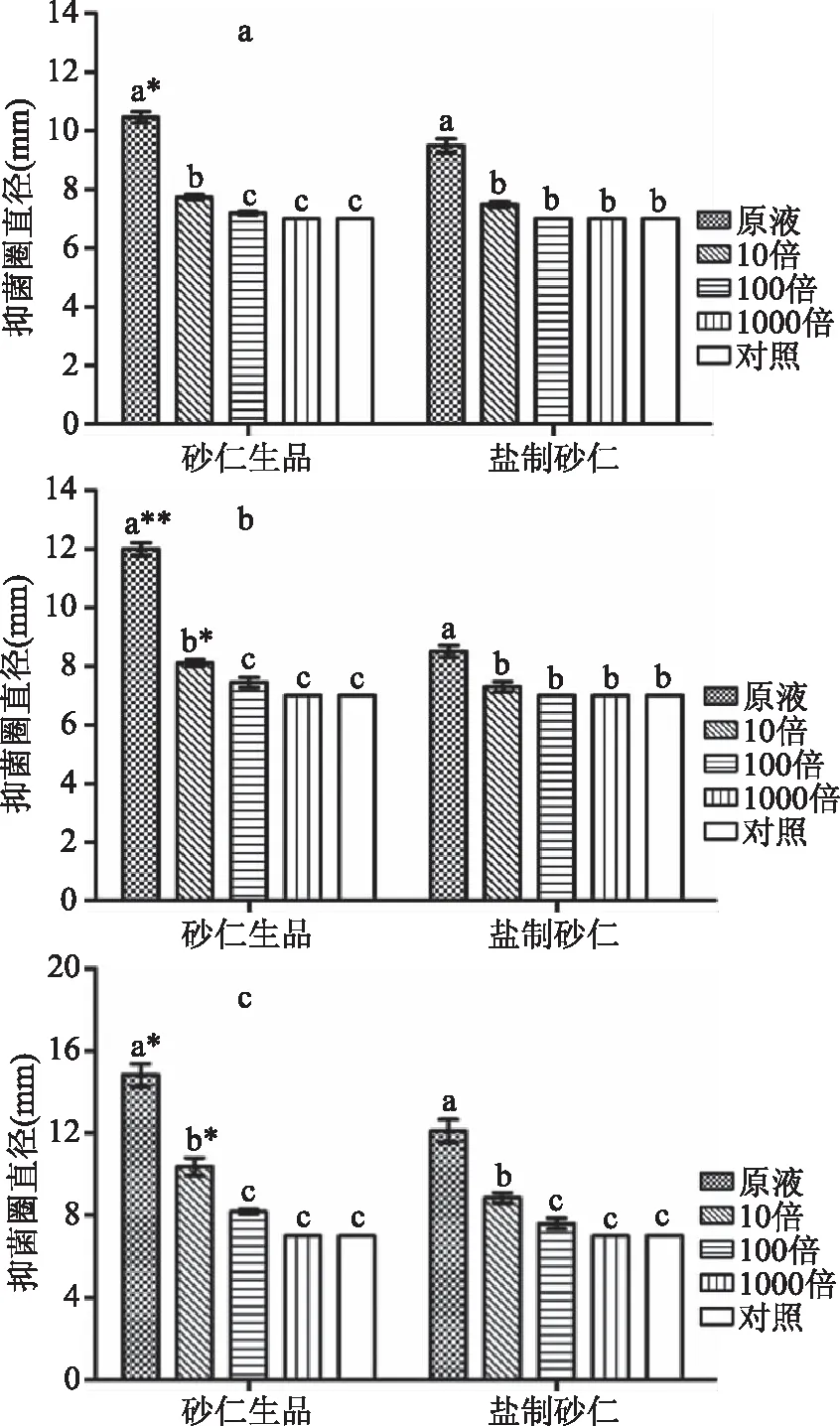
图4 砂仁生品和盐制砂仁石油醚萃取物抑菌效果Fig.4 Bacteriostatic effect of petroleum ether extract madefrom Fructus amomi and its salt-processed products
此外,无论是石油醚萃取物原液浓度,还是将其稀释10倍、100倍,砂仁生品对3种菌的抑菌效果均要好于盐制砂仁,尤其是对枯草芽孢杆菌的抑制效果,在原液和10倍稀释条件下,砂仁生品与盐制砂仁之间的抑菌效果均呈显著差异(P<0.05)。
2.5 石油醚萃取物对供试菌的最小抑菌浓度(MIC)的测定
由表2可知,砂仁生品的石油醚萃取物对3种菌的的MIC值均小于盐制砂仁,进一步说明,砂仁生品的抑菌效果优于盐制砂仁,其中砂仁生品的石油醚萃取物对枯草芽孢杆菌的抑菌效果最好,为0.23 mg/mL。
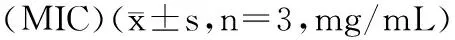
表2 砂仁石油醚萃取物对3种供试菌的最小抑菌浓度Table 2 Minimum inhibitory concentration(MIC)ofpetroleum ether extracts against the
3 结论
砂仁生品不同溶剂萃取物抑菌效果显著(P<0.05)优于盐制砂仁,95%乙醇提取物的对3种供试菌的抑制效果优于75%、65%乙醇提取物,且不同溶剂萃取物对3种供试菌的抑制效果顺序为:石油醚>乙酸乙酯>正丁醇 ≥ 水层。此外,砂仁生品、盐制砂仁石油醚萃取物对3种菌的抑制能力顺序分别为:枯草芽孢杆菌>金黄色葡萄球菌>大肠杆菌,枯草芽孢杆菌>大肠杆菌>金黄色葡萄球菌,推测这种差异是由于盐炙改变了砂仁中的抑菌活性成分造成的。
