放电等离子烧结技术制备(Ti-35Nb-7Zr-5Ta)-15HA复合材料微观组织的演变及生物活性
2020-04-02刘凯歌胡树兵
刘凯歌,胡树兵
放电等离子烧结技术制备(Ti-35Nb-7Zr-5Ta)-15HA复合材料微观组织的演变及生物活性
刘凯歌,胡树兵
(华中科技大学 材料成形与模具技术国家重点实验室,武汉 430074)
为了提高生物材料的生物活性并降低弹性模量,利用放电等离子烧结技术制备(Ti-35Nb-7Zr-5Ta)-15HA生物复合材料,研究不同烧结温度(950~1150 ℃)对复合材料相对密度、微观组织演变、力学性能及生物活性的影响。结果表明:随着温度的升高,复合材料相对密度从87.6%提高到97.5%;复合材料主要由-Ti相、-Ti相及陶瓷相,如Ti2O、CaZrO3、CaO、Ti5P3和Ca3(PO4)2等组成;复合材料的弹性模量为30~95 GPa、抗压强度为593~ 1978 MPa,而且随着烧结温度升高呈增大趋势;同时,在模拟体液中浸泡14 d后,复合材料表面能够获得类骨磷灰石,显示出良好的生物活性,但随着温度的升高,类骨磷灰石含量不断减少。因此,950 ℃下烧结的(Ti-35Nb-7Zr-5Ta)-15HA生物复合材料是潜在的良好的生物植入材料。
生物复合材料;钛;放电等离子烧结;羟基磷灰石;生物体外实验

钛及钛合金由于具有良好的力学性能和优异的耐腐蚀性因而在牙科和骨科被广泛用作生物植入材料[1−3]。而Ti具有两种同素异形体,分别为六方密堆积结构(HCP)的-Ti和体心立方结构(BCC)的-Ti。与-Ti相比,-Ti合金被认为是更好的骨科植入材料,因为它具有更低的弹性模量。而较低的弹性模量有利于Ti合金植入材料与人骨之间的应力分配,应力分担不足可能导致骨质疏松、关节松动和植入物过早失效,这被称为“应力屏蔽效应”[4]。由RACK等[5]开发的型Ti-35Nb-7Zr-5Ta合金是目前弹性模量最低的钛合金,该合金弹性模量是55 GPa,其抗拉强度为590 MPa,可以作为人体植入材料应用于承重部位。而且添加的Nb、Zr和Ta这些-Ti相稳定元素是无毒的并且有利于细胞的增殖分化[6]。由于Ti-35Nb-7Zr-5Ta的弹性模量与人骨更接近,因而与传统生物医用合金如CP-Ti和Ti-6Al-4V相比,它被认为是更好的植入材料。
生物植入材料的表面特性非常重要,因为材料的表面特性会影响植入材料的生物活性,即植入物周围新骨组织的形成。但是几乎所有的Ti及Ti合金都是生物惰性材料,骨的矿物质磷酸盐很难在其表面诱导沉积,所以手术后在植入物和天然骨之间形成骨结合需要几个月甚至更长时间。为了缩短这个过程,已经开发了各种表面改性技术,使Ti材料的表面更具生物活性,例如:微弧氧化[7−8]、气相沉积[9]、激光熔覆[10]、电化学沉积[11]和溶胶−凝胶处理[12]。这些技术的主要目的是改变钛植入材料的表面,使植入材料兼具Ti的力学性能和HA(羟基磷灰石:Ca10(PO4)6(OH)2)的生物活性。HA与人体骨骼系统中存在的磷灰石具有相似的矿物成分和晶体结构,因此可以用于植入材料,体外试验显示有利于成骨细胞的生长[13]。然而,通过这些方法合成的层状或梯度Ti / HA生物材料,HA涂层与Ti基体之间的粘附性差,HA涂层易从Ti基底剥落,导致植入失败。最近,钛陶瓷复合生物材料引起了人们的极大兴趣。QIAN等[14]使用3D打印技术制备Ti-20HA的-Ti和陶瓷复合的生物材料,抗压强度为184 MPa,并具有良好的生物相容性。ARIFIN等[15]制备的Ti-6Al-4V-HA复合材料,弹性模量最低能达到39 GPa,但其抗压强度不满足人骨要求,而且Ti-6Al- 4V将有毒离子(Al和V)释放到体内,这可能会引起人体疾病,例如阿尔茨海默病[16]。
放电等离子烧结(SPS)技术是冶金和烧结方法的新工艺[17]。为了克服上述问题,使用SPS技术制造Ti-35Nb-7Zr-5Ta与HA复合的生物材料。在SPS工艺期间,通过高能脉冲电流在粉末颗粒之间产生等离子体同时结合加热加压,使颗粒之间形成高质量的结合。SPS工艺的烧结持续时间短,被认为能控制材料的微观结构和抑制晶粒的长大,有利于提高材料的性能。
钛的相变转变温度为882.5 ℃,为保证制备出型复合材料,在这项工作中,通过SPS技术在950 ℃到1150 ℃不同烧结温度下成功地制备了(Ti-35Nb- 7Zr-5Ta)-15HA复合材料[18]。这项工作的目的是研究烧结温度对复合材料的相对密度、微观结构、力学性能和生物相容性的影响。通过将Ti-35Nb-7Zr-5Ta合金与HA生物陶瓷结合,期望获得具有低模量、高强度并增强生物活性的植入材料。
1 实验
1.1 复合材料的制备
实验使用的Ti粉末(纯度>99.5%,平均粒径约45 μm)、Nb粉末(纯度>99.5%,平均粒径约45 μm)、Zr粉末(纯度>99.5%,平均粒径约25 μm)、Ta粉末(纯度>99.5%,平均粒径约25 μm)和HA粉末(纯度AR,平均粒径<10 μm)制备复合材料。使用精确度为0.1 mg的电子天平对Ti、Nb、Zr和Ta粉末按质量比53:35:7:5进行称量,并与一些不锈钢球一起放入不锈钢容器中。粉末与球的质量比3:1。在混合之前,将具有粉末混合物的容器用氩气吹扫1 h,以使混合期间粉末的氧化最小化,密闭后通氩气以避免氧化。将这些材料在行星式球磨机(YXQM型,长沙)中以300 r/min的速度混合10 h。真空干燥后,通过行星式球磨机将所得Ti-35Nb-7Zr-5Ta混合物机械混合含量15%(质量分数)的HA粉末,速度为150 r/min,持续30 min,得到(Ti-35Nb-7Zr-5Ta)-15HA粉体,其组成如表1所示。最后,通过SPS烧结系统分别迅速升温到950、1000、1050、1100和1150 ℃不同烧结温度,并保持该温度5 min,然后随炉冷却。在制备过程中,SPS室的真空度保持在6 Pa,加热速率为100 ℃/min,轴向压力保持在40 MPa。
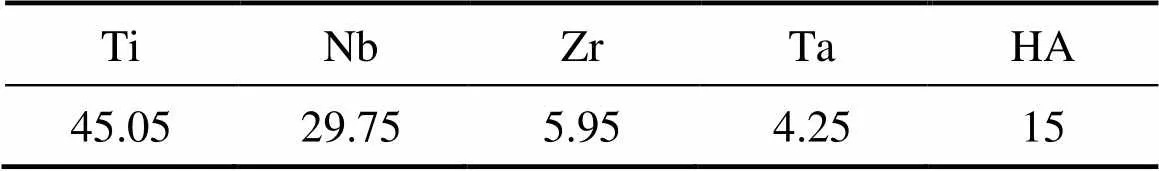
表1 (Ti-35Nb-7Zr-5Ta)-15HA粉末的成分
1.2 样品微观结构和机械性能表征
通过场发射扫描电镜(Nova NanoSEM 450,荷兰FEI公司)观察样品的表面形貌;用EDX分析表面元素成分;使用X射线衍射仪(XRD−7000,日本岛津公司)分析表面物相;烧结后试样相对密度利用阿基米德排水法测量;力学性能利用日本岛津AG−100KN材料高温性能试验机在室温下进行测试,根据GB/T 7314—2017,将试样分别线切割成直径4 mm×10 mm和直径2 mm×10 mm 的圆柱,前者用来测抗压强度,后者用来测压缩弹性模量。
1.3 样品生物活性表征
为了分析烧结的(Ti-35Nb-7Zr-5Ta)-15HA复合材料的生物活性,进行了骨样磷灰石形成能力测试。这里生物活性定义为放在在模拟体液(SBF)中材料在表面上形成骨状磷灰石层的能力。模拟体液成分如表2所示[19]。浸渍样品为10 mm×10 mm×2 mm的块体。样品表面用砂纸逐级打磨,然后用去离子水在超声波浴中清洗5 min,最后在露天干燥。在预处理之后,通过密封烧杯将样品浸入25 mL SBF溶液中。在恒温水浴中将烧杯保持在(309.5±1.5) K ((36.5±1.5) ℃)下14 d(336 h)。模拟体液每2 d更新一次。
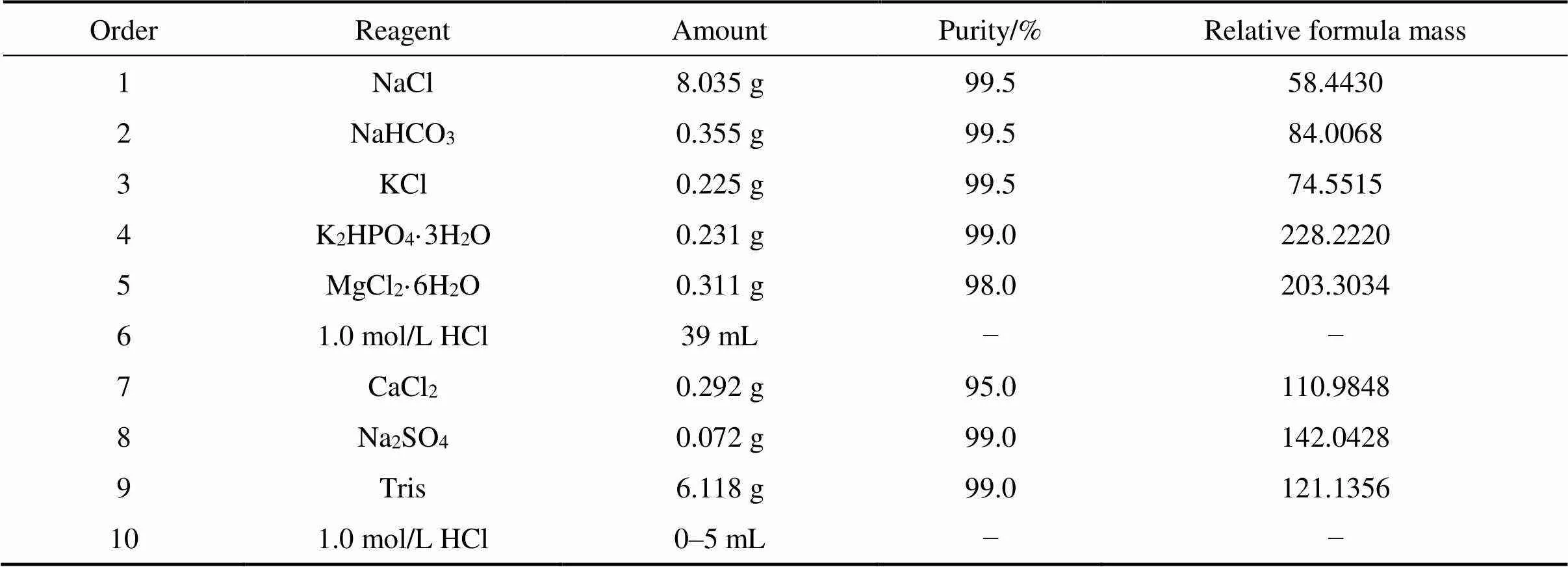
表2 模拟体液的成分[19]
2 结果与讨论
2.1 (Ti-35Nb-7Zr-5Ta)-15HA复合生物材料的相对密度
图1所示为不同温度下烧结的(Ti-35Nb-7Zr-5Ta)- 15HA生物复合材料的相对密度。从图1可知,烧结温度为950、1000、1050、1100和1150 ℃时,复合材料相对密度依次为87.6%、94.5%、96.5%、96.7%和97.5%。随着烧结温度的升高,复合材料相对密度逐渐增大,在达到1050 ℃后,趋于平缓。烧结过程中孔隙的变化原因如图2所示,经过压制的样坯,存在粉末间隙,这导致原始孔隙的形成。然后在烧结过程中,粉末颗粒间首先实现点接触,随后,随着温度的升高,颗粒进一步结合,形成烧结颈,烧结颈逐渐长大,与此同时粉末颗粒间的孔隙合并长大或者单独的逐渐缩小,期间孔隙持续球化至烧结完成。而烧结温度为这一过程提供能量,由此可以发现,烧结温度的升高使得合金的相对密度增加。除了金属粉末间隙之外,柯肯达尔效应可能是原始孔隙产生的另一个原因,由于不同元素原子扩散速度和烧结温度不同,原子扩散过程中质量传输不平衡而产生的空位聚集形成孔隙。此外,HA的添加也是孔隙形成的重要原因之一。一方面,HA受热分解释放的气体,会产生孔隙。另一方面,HA的低导电性和导热性以及HA与Ti合金的热膨胀系数的差异,也会导致孔隙的产生。
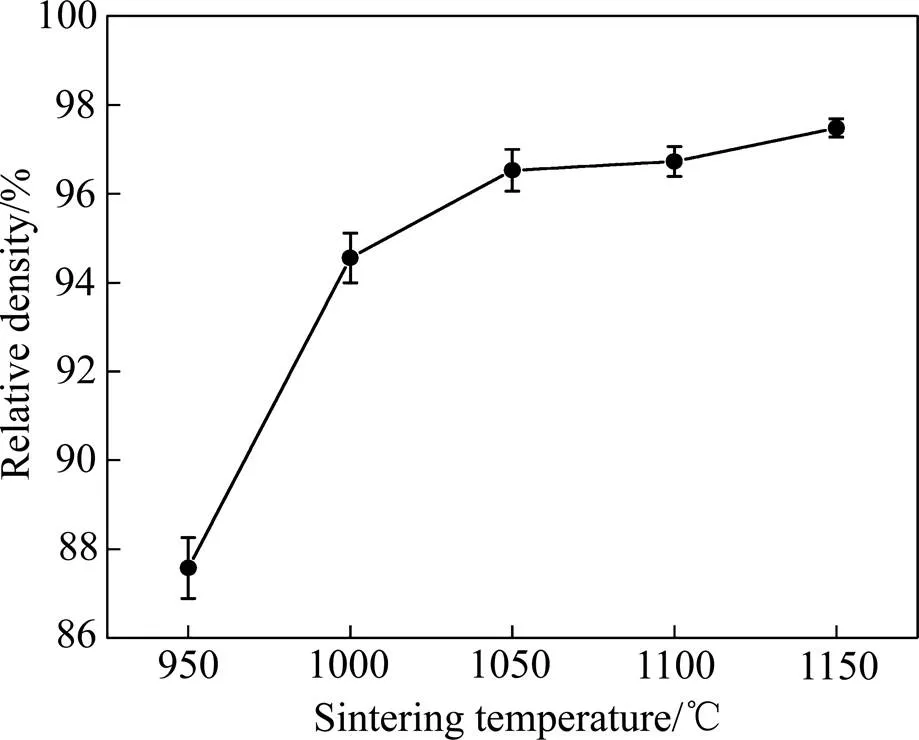
图1 不同烧结温度下(Ti-35Nb-7Zr-5Ta)-15HA复合生物材料的相对密度变化曲线

图2 烧结过程中孔隙的变化
2.2 (Ti-35Nb-7Zr-5Ta)-15HA复合生物材料的微观组织演变
图3所示为不同烧结温度时(Ti-35Nb-7Zr-5Ta)- 15HA生物复合材料的XRD谱。从图3可以看出,不同温度烧结的生物复合材料主要由-Ti、-Ti和陶瓷相组成,如Ti2O、CaZrO3、CaO、Ti5P3和Ca3(PO4)2。随着温度升高,-Ti、-Ti 峰强度降低,Ti5P3和Ti2O峰强度升高,这可能是由部分Ti元素与陶瓷相反应生成Ti2O和Ti5P3所致。-Ti相的峰随着温度上升明显变宽,而且与标准的图相比,峰朝向更低的角度。这些现象可能是由于以下原因:1) 具有较小半径和较低活化能的O和P元素扩散到Ti元素中;2) Ti(Nb)和Ti(NbZrTa)的过饱和固溶体导致晶格参数发生明显变化;3) 烧结过程中产生缺陷。烧结的复合材料中,Nb和Zr峰消失,这是由于Nb和Zr扩散到Ti晶格中并在Ti的晶体结构中形成置换固溶体,例如Ti(Nb)和Ti(NbZrTa)固溶体。Ta的峰仍然存在,这是因为Ta和Ti的熔点相差过大,反应温度过低,反应时间较短,而未完全扩散到Ti中,仍有部分残留。随着温度的上升,Ca3(PO4)2相的峰强度下降,CaZrO3和CaO相峰的强度略有升高。Ca3(PO4)2相是由于HA在800℃上受热分解生成。随着温度升高,Ca3(PO4)2逐渐与金属相反应而减少,反应产物CaZrO3和CaO相则会增加。虽然HA的添加会引入大量新的陶瓷相,降低力学性能,但是这些陶瓷相的存在会进一步影响复合生物材料的生物活性。根据XRD谱结果,烧结过程中的反应方程式如下:
40Ti+2Ca10(PO4)6(OH)2→3Ca3(PO4)2+11CaO+
15Ti2O+2Ti5P3+2H2O↑ (1)
Zr+2O→ZrO2(2)
CaO+ZrO2→CaZrO3(3)
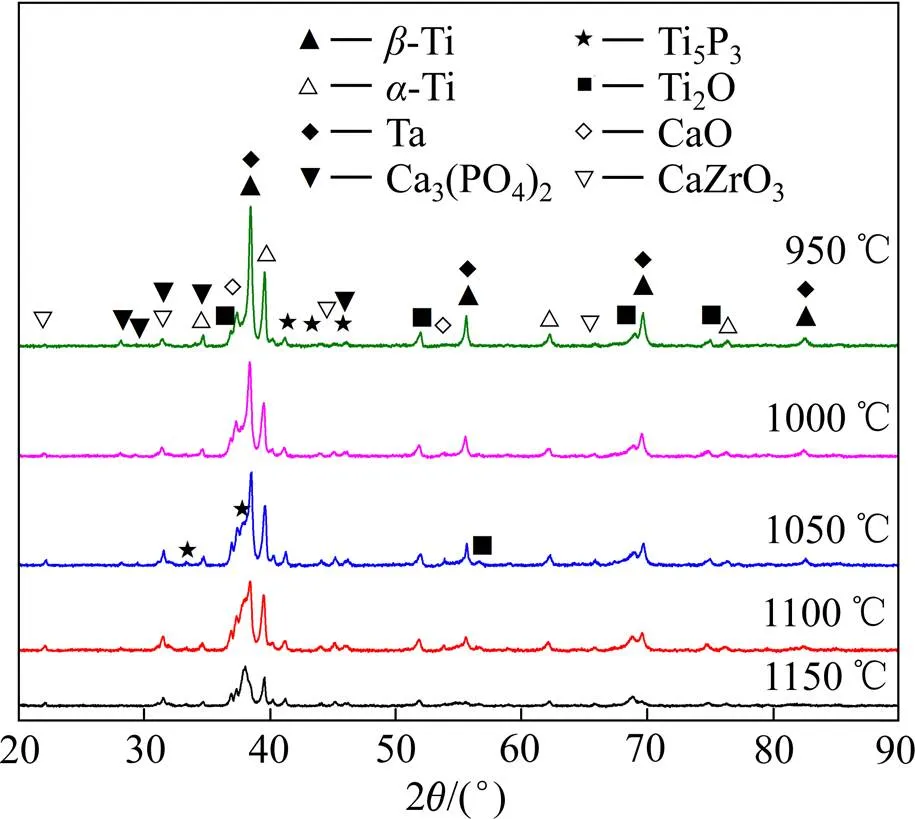
图3 不同烧结温度下(Ti-35Nb-7Zr-5Ta)-15HA复合生物材料的XRD谱
材料的结构和表面形态是植入物成功移植的关键因素之一。图4所示为在950、1000、1050、1100和1150 ℃下烧结的(Ti-35Nb-7Zr-5Ta)-15HA复合材料的SEM和BSEM像。从BSEM像中可以看到明显的黑色、灰色和白色区域。根据表3中的EDX分析结果,黑色区域是Ti富集区域,灰色是TiNb富集区域,白色区域是Ta富集区域。随着烧结温度的升高,黑色与白色区域减少,灰色区域增多,这表明烧结温度可使烧结复合材料中的元素分布均匀。在图5中清晰观察到,Ti和Ta整个基体中几乎都有分布,在部分区域会有富集,这可能是烧结时间太短导致。HA在高温烧结时不稳定并部分分解与金属反应生成第二相。从图5可以发现,Ca、P、O和Zr元素集中在孔和相的边界周围,形成细碎陶瓷区,而且O原子半径更小,更易在合金基体中扩散。随着温度升高,Ca、P、O和Zr元素在Ti-35Nb-7Zr-5Ta基体中扩散更加均匀。式(4)显示了Arrhenius方程:
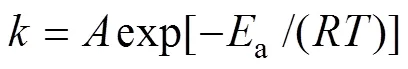
其中:是扩散速率;是Arrhenius常数;a是元素的活化能;是摩尔气体常数;是温度。从式(4)可以看出,元素的扩散速率取决于温度。当烧结温度升高时,元素的扩散速率加快,元素接近均匀分布。陶瓷相弥散分布在Ti基体上,随着温度升高,逐渐把金属相分隔开,也起到细化晶粒的作用。通过比较图4中右侧的SEM像可看出,随着温度的升高,材料表面变得越来越平整。显然,烧结温度的升高降低了烧结复合材料的孔隙率,这与我们之前的相对密度测量结果一致(见图1)。
2.3 (Ti-35Nb-7Zr-5Ta)-15HA复合生物材料的力学性能
生物复合材料的弹性模量和压缩强度的平均值如图6所示。不同烧结温度下(Ti-35Nb-7Zr-5Ta)-15HA复合材料的弹性模量在30~95 GPa范围内变化。弹性模量对相组成及其浓度和孔隙率敏感[20]。950 ℃时,生物复合材料的相对密度最低,而且Ti此时未与HA完全反应,低弹性模量的-Ti相较多,所以此时的弹性模量最低为30 GPa,接近人工骨的弹性模量(0~30 GPa)[21]。随着温度提高到1000 ℃,弹性模量迅速上升到76 GPa,这与相对密度的迅速提高的趋势一致。从1050 ℃到1150 ℃,材料的弹性模量随着温度的提高增加较小,这可能与材料相对密度增加较小有关,但这时材料的弹性模量仍低于传统-Ti(110 GPa)的弹性模量[1]。所以,随着温度从950 ℃升到1150 ℃,由于材料的相对密度增加及低弹性模量的-Ti相转变成高弹性模量的陶瓷相,导致生物复合材料弹性模量逐渐增加。
(Ti-35Nb-7Zr-5Ta)-15HA复合材料的抗压强度,随着温度的增加,从593 MPa上升到1978 MPa,生物复合材料的抗压强度远高于自然骨的(90~280 MPa)[21]。陶瓷相为硬质相,基体为较软的相,在压应力作用下,两种相首先在缺陷处发生滑动,当滑动发生塞积时,硬质相对软质相包覆并产生一定的剪切作用,促使软质相的撕裂,而产生微裂纹,微裂纹很容易在弱孔壁处传播,导致相互连接的弱孔壁破裂,随后在孔隙附近出现宏观裂缝,导致材料失效。当温度较低时,孔隙较多,弱孔壁也相对较多,当应力达到近线弹性变形阶段的峰值时,大量脆性孔被逐层压碎,导致材料更易失效。随着温度升高,相对密度升高,孔隙减少,微裂纹难以产生,外界需要更大的力,才能使其失效。所以随着温度升高,其抗压强度逐渐提高。
2.4 (Ti-35Nb-7Zr-5Ta)-15HA复合生物材料的生物活性
模拟体溶液中类骨磷灰石形成的能力已被广泛用于评估生物材料的生物活性。不同温度下(Ti-35Nb- 7Zr-5Ta)-15HA复合材料浸入SBF溶液后的表面形貌如图7所示。BSEM结果表明温度对磷灰石的形成有着显著的影响,不同温度下添加HA的复合材料表面均有磷灰石生成。不同温度下磷灰石层的分布和厚度也是不同的。当烧结温度为950 ℃时(见图7(a)),生物复合材料表面生成致密的磷灰石层,基体不可见,磷灰石向上填充到空间形成多层磷灰石层。但也可以看到,在磷灰石层表面仍存在微裂纹,这可能主要是因为干燥或磷灰石在成核和生长过程中内应力的分布不均匀残余应力释放的结果。当烧结温度上升到1000 ℃时(见图7(b)),在复合物的表面上形成一层完整的磷灰石薄层,但在孔隙处仍能观察到部分基体。烧结温度上升到1050 ℃以上(见图7(c)、(d)和(e)),少量磷灰石颗粒(黑色颗粒)开始在晶界周围的陶瓷区和孔洞处生成,然后部分相互连接在一起,形成磷灰石区域,但是都未能形成一层完整的磷灰石层,而且随着烧结温度的升高,磷灰石颗粒逐渐减少。比较不同烧结温度下制备的复合材料,高的烧结温度不利于生物活性的提高。950 ℃烧结温度下材料表面生物活性最好,可以形成致密的磷灰石层。为了进一步证实表面的沉淀,EDS光谱用于研究950 ℃下烧结的(Ti-35Nb-7Zr-5Ta)-15HA复合生物材料的化学成分。根据复合材料的EDS结果(见图8),复合生物材料表面的成分和化学状态发生了显着变化,其中磷灰石的主要成分是Ca、P和O元素。而且表面形成的磷灰石Ca与P摩尔比为1.66,该值非常接近羟基磷灰石的化学计量Ca与P摩尔比(1.67)。另外,对于复合材料获得的O元素浓度略低于HA的标称组成值,表明在生物复合材料上形成了类似骨的磷灰石层。

图4 不同烧结温度下(Ti-35Nb-7Zr-5Ta)-15HA复合生物材料的BSEM和SEM像
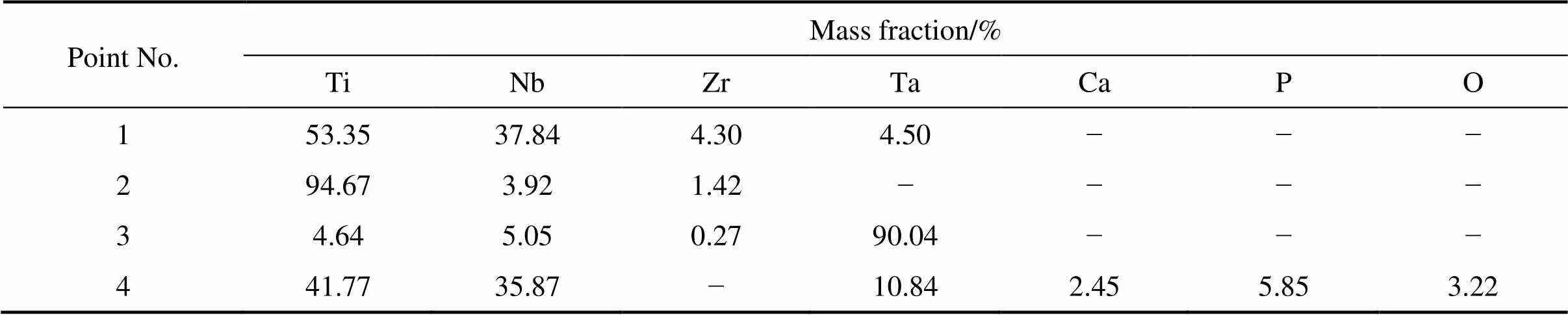
表3 图4 中不同烧结温度下复合材料EDS 能谱分析结果
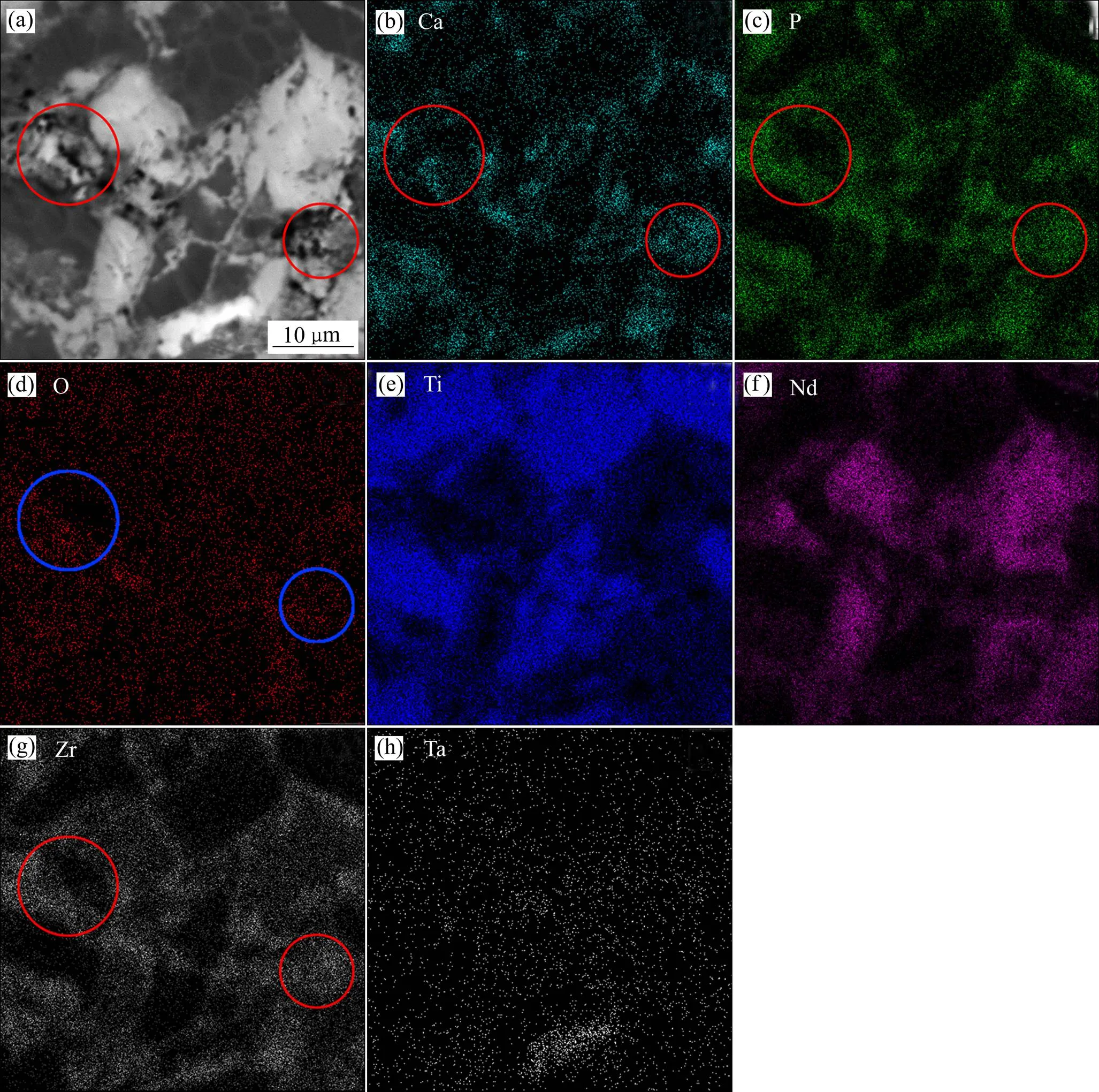
图5 烧结温度为1150 ℃时(Ti-35Nb-7Zr-5Ta)-15HA复合生物材料的元素面分布

图6 不同烧结温度下(Ti-35Nb-7Zr-5Ta)-15HA复合生物材料的弹性模量与抗压强度
表面类骨磷灰石形成的是一个形核和生长的过程。高温烧结后,部分Ca3(PO4)2并未完全与金属反应,当样品放入模拟体液中,溶液中的Ca2+、PO43-和HO-离子先于Ca3(PO4)2反应生成类骨磷灰石核,然后通过不断地消耗SBF中的钙和磷酸根离子而自发生长以形成骨状磷灰石层。并且,复合生物材料表面的CaO和Ca3(PO4)2也会有部分溶解到模拟体液中,形成过饱和区域,加速这一过程。随着温度的升高,Ca3(PO4)2与金属反应增多,留下的形核位点减少,不利于类骨磷灰石的形成。所以,随着温度升高,表面的类骨磷灰石逐渐减少。另外,在较低的烧结温度下,材料表面孔隙较多,导致材料表面有较高的表面能,也有利于类骨磷灰石的形核与生长。所以,随着温度从950 ℃升高到1150 ℃,由于材料表面的物相及孔隙的原因,导致材料表面生物活性逐渐降低。

图7 不同烧结温度下(Ti-35Nb-7Zr-5Ta)- 15HA复合生物材料经SBF浸泡14 d后的BSEM像
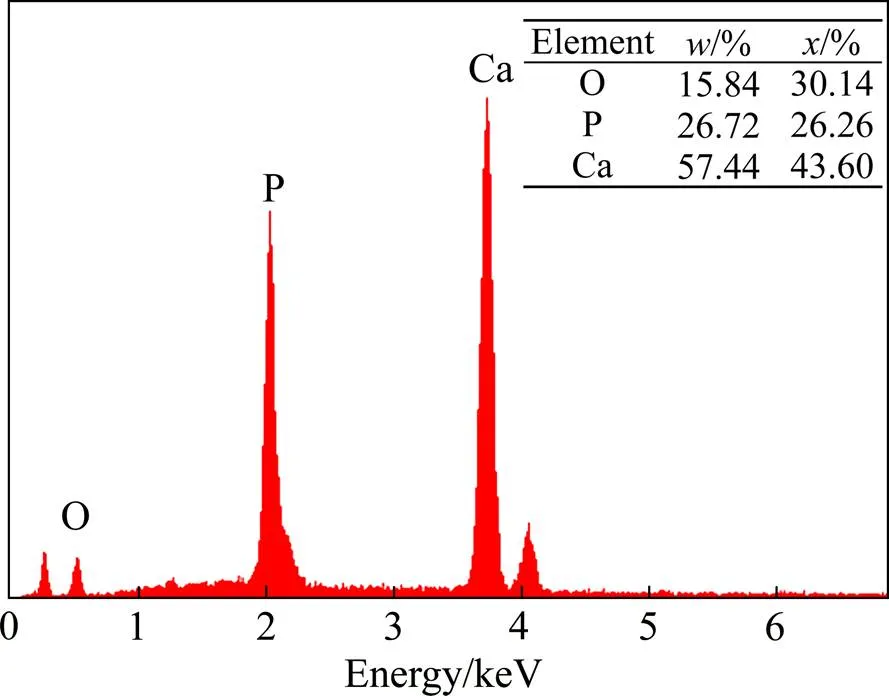
图8 在950 ℃下烧结的(Ti-35Nb-7Zr-5Ta)-15HA生物复合材料浸泡在SBF中14 d后表面的EDS光谱
3 结论
1) 放电等离子烧结技术制备的(Ti-35Nb-7Zr- 5Ta)-15HA生物复合材料具有87.6%~97.5%的高相对密度,而且随着温度的升高,相对密度不断增加。
2) 复合材料组织主要由-Ti 相、-Ti 相及Ti2O、CaZrO3、CaO、Ti5P3和Ca3(PO4)2等陶瓷相组成;随着烧结温度升高,复合材料中-Ti、-Ti 和Ca3(PO4)2峰强度降低,Ti2O、CaZrO3、CaO和Ti5P3峰强度升高。
3) 复合材料的弹性模量与抗压强度分别为30~95 GPa和 593~1978 MPa。在1000 ℃以下,随烧温度升高都快速增大。但是当烧结温度超1050 ℃时,由于相对密度较高,孔隙变化相对较小,弹性模量与抗压强度增加较少。
4) 在模拟人工体液中浸泡14 d后,复合材料表面能够获得类骨磷灰石,显示了良好的生物活性。但随着温度升高,Ca3(PO4)2与金属反应增多,留下的形核位点减少,孔隙的减少,导致表面能的下降,不利于类骨磷灰石的形核与生长。而且,在较低的烧结温度下,材料表面有较高的表面能,也有利于类骨磷灰石的形核与生长。所以,随着温度从950 ℃升高到1150 ℃,材料表面生物活性逐渐降低。950 ℃下烧结的(Ti-35Nb-7Zr-5Ta)-15HA生物复合材料生物活性较好是潜在良好的生物植入材料。
[1] GEETHA M, SINGH A K, ASOKAMANI R, GOGIA A K. Ti based biomaterials, the ultimate choice for orthopaedic implants—A review[J]. Progress in Materials Science, 2009, 54(3): 397−425.
[2] RACK H J, QAZI J I. Titanium alloys for biomedical applications[J]. Materials Science and Engineering C, 2006, 26(8): 1269−1277.
[3] NIINOMI M. Mechanical properties of biomedical titanium alloys[J]. Materials Science and Engineering A, 1998, 243(1/2): 231−236.
[4] SUMNER D R, GALANTE J O. Determinants of stress shielding: design versus materials versus interface[J]. Clinical Orthopaedics and Related Research, 1992, 274: 202−212.
[5] LONG M, RACK H J. Titanium alloys in total joint replacement—A materials science perspective[J]. Biomaterials, 1998, 19(18): 1621−1639.
[6] ZHANG D, WONG C S, WEN C, LI Y. Cellular responses of osteoblast-like cells to 17 elemental metals[J]. Journal of Biomedical Materials Research Part A, 2017, 105(1): 148−158.
[7] 乔丽萍, 江龙发, 黄华德, 曲 彪, 张淑芳, 张荣发, 向军淮. 钙盐和氢氧化钾浓度对钛合金微弧氧化膜表面形貌及成分的影响[J]. 中国有色金属学报, 2015, 25(6): 1590−1596.QIAO Li-ping, JIANG Long-fa, HUANG Hua-de, QU Biao, ZHANG Shu-fang, ZHANG Rong-fa, XIANG Jun-huai. Effects of calcium salts and KOH concentrations on surface morphology and chemical compositions of micro arc oxidation coatings on titanium alloys[J]. The Chinese Journal of Nonferrous Metals, 2015, 25(6): 1590−1596.
[8] 王艳玲, 惠松骁, 叶文君, 米绪军. 医用钛合金的微弧氧化膜层组织及其磨损性能[J]. 中国有色金属学报, 2010, 20(S1): s188−s192.WANG Yan-ling, HUI Song-xiao, YE Wen-jun, MI Xu-jun. Microstructure and its wear property of micro-arc oxidation coating on biomedical titanium alloy[J]. The Chinese Journal of Nonferrous Metals, 2010, 20(S1): s188−s192.
[9] HAMDI M, IDE-EKTESSABI A. Preparation of hydroxyapatite layer by ion beam assisted simultaneous vapor deposition[J]. Surface and Coatings Technology, 2003, 163: 362−367.
[10] 杨永强, 张翠红. 激光熔覆−激光氮化复合法制取TiNi-TiN梯度材料[J]. 中国有色金属学报, 2006, 16(2): 213−218. YANG Yong-qiang, ZHANG Cui-hong. Synthesis of TiNi-TiN gradient coating by hybrid method of laser cladding and laser nitriding[J]. The Chinese Journal of Nonferrous Metals,2006, 16(2): 213−218.
[11] YANG X, ZHANG B, LU J, CHEN J, ZHANG X, GU Z. Biomimetic Ca-P coating on pre-calcified Ti plates by electrodeposition method[J]. Applied Surface Science, 2010, 256(9): 2700−2704.
[12] XU W, HU W Y, LI M H, MA Q Q, HODGSON P D, WEN C E. Sol-gel derived HA/TiO2double coatings on Ti scaffolds for orthopaedic applications[J]. Transactions of Nonferrous Metals Society of China, 2006, 16(S1): s209−s216.
[13] DHERT W J A, THOMSEN P, BLOMGREN A K, ESPOSITO M, ERICSON L E, VERBOUT A J. Integration of press-fit implants in cortical bone: A study on interface kinetics[J]. Journal of Biomedical Materials Research, 1998, 41(4): 574−583.
[14] QIAN C, ZHANG F, SUN J. Fabrication of Ti/HA composite and functionally graded implant by three-dimensional printing[J]. Bio-Medical Materials and Engineering, 2015, 25(2): 127−136.
[15] ARIFIN A, SULONG A B, MUHAMAD N, SYARIF J, RAMLI M I. Powder injection molding of HA/Ti6Al4V composite using palm stearin as based binder for implant material[J]. Materials and Design, 2015, 65: 1028−1034.
[16] RAO S, USHIDA T, TATEISHI T, OKAZAKI Y, ASAO S. Effect of Ti, Al, and V ions on the relative growth rate of fibroblasts (L929) and osteoblasts (MC3T3-E1) cells[J].Bio-Medical Materials and Engineering, 1996, 6(2): 79−86.
[17] 赵腾飞, 路 新, 曲选辉. 粉末冶金生物医用Ti合金的研究及应用现状[J]. 粉末冶金技术, 2012, 30(4): 300−306. ZHAO Teng-fei, LU Xin, QU Xuan-hui. Research progress and application of biomedical titanium alloys prepared by powder metallurgy[J]. Powder Metallurgy Technology, 2012, 30(4): 300−306.
[18] 于振涛, 余 森, 程 军, 麻西群. 新型医用钛合金材料的研发和应用现状[J]. 金属学报, 2017, 53(10): 1238−1264. YU Zhen-tao, YU Sen, CHENG Jun, MA Xi-qun. Development and application of novel biomedical titanium alloy materials[J]. Acta Metallurgica Sinica, 2017, 53(10): 1238−1264.
[19] KOKUBO T, TAKADAMA H. How useful is SBF in predicting in vivo bone bioactivity?[J]. Biomaterials, 2006, 27(15): 2907−2915.
[20] FOUSOVA M, VOJTECH D, KUBASEK J, JABLONSKA E, FOJT J. Promising characteristics of gradient porosity Ti-6Al-4V alloy prepared by SLM process[J]. Journal of the Mechanical Behavior of Biomedical Materials, 2017, 69: 368−376.
[21] GIBSON L J. The mechanical behaviour of cancellous bone[J]. Journal of Biomechanics, 1985, 18(5): 317−328.
Microstructure evolution and enhanced bioactivity of (Ti-35Nb-7Zr-5Ta)-15HA biocomposites by spark plasma sintering
LIU Kai-ge, HU Shu-bing
(State Key Laboratory of Material Processing and Die and Mould Technology, Huazhong University of Science and Technology, Wuhan 430074, China)
Ti-35Nb-7Zr-5Ta has suitable mechanical characteristics for orthopedic implants. However, it is not a bioactive material in the clinical application. A composite of Ti-35Nb-7Zr-5Ta and hydroxyapatite (HA) can be used to promote the growth of bone cells on the implant. Hence, we report a rapid fabrication of (Ti-35Nb-7Zr-5Ta)-15HA composites using spark plasma sintering (SPS) at different temperatures. The effects of temperature on the relative density, phase composition, microstructure, mechanical properties and biological activity of (Ti-35Nb-7Zr-5Ta)-15HA were investigated. (Ti-35Nb-7Zr-5Ta)-HA composites possessed matrix of-Ti phase,-Ti phase and ceramic phases (Ti2O, CaZrO3, CaO, Ti5P3and Ca3(PO4)2). Compression test reveals that the sintered (Ti-35Nb-7Zr-5Ta)-15HA composites exhibit excellent elastic modulus (30−95 GPa) and compression strength (593−1978 MPa), ensuring a better behavior as an implant material. Furthermore, the addition of HA can improve the bioactivity of (Ti-35Nb-7Zr-5Ta)-15HA composites significantly. The low elastic modulus, high strength and good bioactivity might make this material a candidate for hard tissue implants.
biomaterials; titanium; spark plasma sintering; hydroxyapatite; in vitro bioactivity
Project(2014CB046704) supported by the National Basic Research and Development Program of China
2019-01-25;
2019-04-25
HU Shu-bing; Tel: +86-13995667466; E-mail: hushubing@163.com
1004-0609(2020)-01-0112-10
TB33
A
10.11817/j.ysxb.1004.0609.2020-39490
国家重点基础研究发展计划资助项目(2014CB046704)
2019-01-25;
2019-04-25
胡树兵,教授,博士;电话:13995667466;E-mail:hushubing@163.com
(编辑 龙怀中)
