NGAL、炎症细胞因子在2型糖尿病肾脏疾病患者体内的变化
2020-04-01姜雯雯宋雅伟祁媚姣李小娟刘玉梅
姜雯雯,宋雅伟,祁媚姣,李小娟,刘玉梅
(1.兰州大学第二医院 检验医学中心,甘肃 兰州 730030;2.兰州市第二人民医院 检验科,甘肃 兰州 730030;3.甘肃省肿瘤医院 医院感染管理科,甘肃 兰州 730050)
2型糖尿病肾脏疾病(T2DM-DKD)的病情进展较为隐匿,在高血糖诱导的氧化应激损伤条件下,肾脏基底膜细胞的凋亡和纤维化,均能够促进T2DM-DKD的发生,加剧T2DM-DKD患者远期肾功能的恶化[1-2]。通过对于T2DM-DKD的病情评估,能够在T2DM-DKD的免疫治疗过程中发挥作用。分子标志物能够在T2DM-DKD的诊疗过程中发挥作用,特别是炎症因子的改变,能够显著影响到肾脏基底膜组织的损伤过程。中性粒细胞明胶酶相关载脂蛋白(NGAL)是中性粒细胞调控相关因子,其通过诱导中性粒细胞酶的激活,加剧其对于肾小球滤过膜的损伤,导致尿蛋白的出现和肾功能的异常[3];白细胞介素6(IL-6)或者肿瘤坏死因子α(TNF-α)是炎症损伤因子,其对于下游炎症信号通路的激活,能够加剧肾小管或者肾小球的损伤,导致肾脏滤过功能的异常[4]。为了揭示IL-6、TNF-α及NGAL的表达与T2DM-DKD患者的病情关系,从而为临床上T2DM-DKD的病情评估提供参考,本次研究选择在我院治疗的2型糖尿病患者180例,探讨IL-6、TNF-α及NGAL的表达及其与T2DM-DKD患者的病情关系。
1 资料与方法
1.1一般资料 2017年9月至2018年12月在我院治疗的2型糖尿病患者180例,根据尿微量白蛋白排泄量(UAE)分为3组,单纯组(UAE<30 mg/24 h)60例,男30例,女30例,年龄40~73岁,平均(53.13±4.89)岁;早期肾病组(UAE在30~300 mg/24 h)60例,男32例、女28例,年龄40~73岁,平均(53.06±4.82)岁。临床肾病组(UAE>300 mg/24 h)60例,男33例、女27例,年龄40~73岁,平均(52.96±4.85)岁。2型糖尿病患者纳入标准:①2型糖尿病诊断符合中华内分泌学分会制定的标准[5];②检测前未使用胰岛素、胰岛素类似物等;③受试者知情同意。排除标准:①合并有恶性肿瘤、自身免疫性疾病、甲状腺疾病等其他疾病;②患有糖尿病酮症、糖尿病酸中毒等并发症患者;③高血压肾病,肾结石。同时选取健康志愿者60例作为对照组,其中男性32例,女性28例,年龄40~73岁,平均年龄(52.79±4.79)岁。各组受试者一般资料比较差异无统计学意义(P>0.05)。
1.2实验方法 采用外周静脉血3~5 ml,室温下放置5~10 min,3 500 r/min离心15 min,2小时内检测血清。采用罗氏公司Cobas8000全自动生化检测仪器进行FPC、SCr、BUN水平检测,全自动生化检测试剂盒购自罗氏公司;采用ELISA法进行TNF-α的检测,BioTek酶标仪购自美国伯腾仪器有限公司。采用罗氏Cobas 6000电化学发光免疫分析仪进行IL-6的检测,试剂盒购自罗氏公司。采集患者的清晨中段清洁尿液5 ml,自然分层后抽取上层清亮液体待测。采用罗氏Cobas 8000全自动生化检测分析仪进行尿液NGAL的检测,试剂盒购自华宇亿康生物技术有限公司。

2 结 果
2.1血清内IL-6、TNF-α水平变化 治疗前,糖尿病各组IL-6、TNF-α水平表达明显高于对照组患者,同时T2DM-DKD越严重,其血清中的IL-6、TNF-α水平越高(P<0.05),见表1。
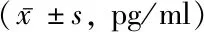
表1 各组血清IL-6、TNF-α水平比较
注:与对照组比较,*P<0.05;与单纯糖尿病组比较,#P<0.05,与早期肾病组比较,△P<0.05
2.2尿液内NGAL水平变化 治疗前,糖尿病各组NGAL水平表达明显高于对照组,同时T2DM-DKD越严重,其尿液中的NGAL水平越高(P<0.05),见表2。
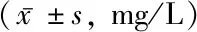
表2 各组尿液NGAL水平比较
注:与对照组比较,*P<0.05;与单纯糖尿病组比较,#P<0.05,与早期肾病组比较,△P<0.05
2.3血糖、肾功能相关指标变化 治疗前,糖尿病各组FPC、SCr、BUN水平表达明显高于对照组,同时T2DM-DKD越严重,其血清中的FPC、SCr、BUN水平越高(P<0.05),见表3。

表3 各组血糖、肾功能相关水平比较
注:与对照组比较,*P<0.05;与单纯糖尿病组比较,#P<0.05,与早期肾病组比较,△P<0.05
3 讨 论
2型糖尿病患者长期的高胰岛素抵抗、高血糖或者葡萄糖的代谢利用障碍,均能够促进T2DM-DKD的发生。长期的T2DM-DKD病情进展,能够显著促进肾脏基底膜组织的损伤,加剧肾小球滤过膜电荷屏障的损害,导致大分子物质的漏出[6]。在临床观察过程中,可以发现T2DM-DKD导致的终末期肾功能衰竭或者脏器微血管病变的风险明显上升,远期T2DM-DKD患者致残率或者病死率可超过5%以上[7-8]。通过早期的临床干预,能够显著抑制肾小球滤过膜的纤维化,改善滤过膜的通透性,抑制滤过膜足细胞的凋亡和萎缩。但现阶段临床上缺乏对于T2DM-DKD病情评估的可靠性分子标志物,虽然已有的相关综述研究探讨了不同分子标志物对于T2DM-DKD病情的标志作用。但包括尿蛋白、半胱氨酸或者胱抑素C等指标在内,其对于T2DM-DKD患者临床病情评估的稳定性较差,对于T2DM-DKD患者远期肾损害临床结局评估的灵敏度较低[9-10]。趋化或者炎症因子的改变,能够在泌尿系统内皮损伤过程中发挥作用。本次研究通过对于T2DM-DKD患者体内IL-6、TNF-α及NGAL的表达分析,其现实临床意义在于能够为临床上T2DM-DKD病情严重程度的评估提供参考。
IL-6、TNF-α是炎症性相关因子,其对于肾小球内皮细胞的直接性损伤,能够导致内皮细胞的凋亡和内皮间质组织纤维化。IL-6、TNF-α还能够影响到中性粒细胞酶的激活,影响到中性粒细胞的活化程度,最终导致肾功能结局的恶化[11];NGAL是粒细胞趋化载脂蛋白,其对于循环血中粒细胞数量的影响,能够导致过氧化物酶的激活,加剧自由基对于基底膜组织的浸润[12]。
在不同病情的糖尿病患者中,可以发现IL-6、TNF-α的表达浓度可随着T2DM-DKD病情的加重而上升,特别是在临床肾病患者中,血清中IL-6、TNF-α的表达浓度的上升更为显著。IL-6、TNF-α的上升对于T2DM-DKD病情的影响,主要在于其能够加剧下游NF-KB信号通路的激活,影响到下游生物活性酶如颗粒酶或者穿孔酶的激活,促进其对于肾脏足细胞的溶解和损伤。在病情加重的T2DM-DKD患者中,相关炎症性因子指标的上升更为显著,主要由于临床型肾病患者尿蛋白的漏出、肾功能的损害、体内代谢毒素的蓄积,均能够导致体内炎症因子的进一步激活和释放[13]。在其他的相关研究过程中,均可以发现IL-6表达显著上升,在肾功能失代偿或者合并有其他脏器损伤的T2DM-DKD患者中,IL-6的表达上升更为显著[14]。NGAL是评估患者体内中性粒细胞激活程度的指标,在T2DM-DKD患者中,其尿液中NGAL的表达明显的上升,特别是在病情较为严重的糖尿病肾病患者中,尿液中NGAL的表达上升更为显著。尿液中NGAL对于T2DM-DKD患者的病情影响,主要在于其能够影响到游离氧自由基的富集,加剧肾间质组织或者肾脏集合管侧壁膜细胞的损伤,影响到肾脏重吸收的功能障碍[15]。临床上可以通过检测IL-6、TNF-α或者NGAL,进而评估糖尿病肾病的发生风险。FPC、SCr、BUN水平是评估肾功能损伤程度的指标,T2DM-DKD病情约为严重,体内FPC、SCr、BUN的上升越为显著,这主要由于高血压诱导的肾脏微血管病变,从而导致肌酐滤过水平的下降。
T2DM-DKD患者患病程度越高,其体内NGAL、炎症细胞因子的表达就越高。希望后来的研究能够揭露NGAL、炎症细胞因子诊断T2DM-DKD临床结局的价值。
