冬小麦膨胀素基因EXPB7工程菌构建及纤维素水解作用分析
2020-04-01哲刘娣冯艳忠胡宝忠4李凤兰
冯 哲刘 娣冯艳忠胡宝忠4*李凤兰*
(1.东北农业大学生命科学学院,黑龙江哈尔滨150000;2.辽宁省本溪市农业技术服务中心,辽宁本溪117000;3.黑龙江省农业科学院,黑龙江哈尔滨150000;4.哈尔滨学院,黑龙江哈尔滨150000)
我国是一个农业生产大国,秸秆资源丰富,但其实际利用率相对较低[1-4]。秸秆中纤维素含量最多[5]。纤维素是世界上量最大的一类可再生、可生物降解的能量物质[6],但是纤维素中复杂的网状结构会明显降低纤维素酶的可及性,再加上一些环境因素如温度的影响,从而使纤维素的利用率很低。目前,天然纤维素的水解技术有酸水解、酶水解和微生物水解三种。其中酸水解和酶水解都存在一定的缺点和安全问题,很难实现规模化应用,阻碍其推广应用[7-10]。但微生物水解纤维素是一种绿色高效、成本较低的方法,已经从当初为了预防微生物破坏天然纤维素的研究目的转为微生物对废弃纤维的降解,如花生壳、麦秆等。
膨胀素是存在于植物细胞壁中的一种蛋白[11-12],而这种蛋白在部分微生物细胞壁中也存在,其于1989年被Cosgrove等首次发现[13],它可以在不水解共价键的情况下,破坏纤维素复杂结构中的氢键网络,引起细胞壁上的聚合体发生滑动,使细胞壁松弛延伸,能与纤维素酶协同降解纤维素[14],是一种对植物和部分微生物整个生长发育过程都有重要意义的一种协同蛋白。若能对膨胀素合理利用,通过膨胀素与纤维素酶协同水解纤维素来提高纤维素的降解效率,就可能解决纤维素降解难的问题,起到很重要的现实意义。
此前,研究者们对重组膨胀素与纤维素酶一起协同水解纤维素的作用研究均是在常温或高温条件下进行的[15-17],然而,在低温条件下重组膨胀素与纤维素酶一起协同水解纤维素的研究鲜有报道。李飞等[18]利用低温处理小麦根部,发现膨胀素基因TaEXPA5、TaEXPA6、TaEXPA7在低温胁迫下,相对表达量显著性升高。本研究以东农冬麦1号的膨胀素基因EXPB7为供体,构建黑曲霉表达载体,以黑曲霉CICC2462为受体,采用农杆菌介导法遗传转化黑曲霉,构建膨胀素基因的黑曲霉工程菌;并对该工程菌的发酵液纤维素水解作用进行分析,为纤维素酵解提供新的方法和思路。
1 材料与方法
1.1 材料与仪器
EXPB7基因的载体 东北农业大学实验室保存;Trans5α感受态pEASY-T3载体 购自北京全式金生物;AGL1农杆菌感受态 北京博迈德生物;黑曲霉CICC2462表达载体pSZHGS(含有T3-EXPB7) 东北农业大学生命科学学院遗传学试验室提供;限制性内切酶(NheI、HindIII)、T4 DNA连接酶 NEB公司。
多功能低温台式离心机 杭州奥盛仪器有限公司;ZHWY-2102C全温度恒温摇床 江苏盛蓝;电热恒温培养箱 上海森信实验仪器有限公司;HZQ-C空气浴振荡器 哈尔滨市东明医疗仪器厂;ZHWY-100B经典型多振幅摇床 上海智城分析仪器制造有限公司;HWS-28型恒温水浴锅 上海一恒科学仪器有限公司;CJ-2D型超净工作台 泰斯特;高速离心机、Mini-6K微型离心机 杭州奥盛仪器有限公司;WFH-210B紫外投射反射仪 上海精科实业有限公司;SmartGel一体化凝胶成像仪 北京赛智创业科技有限公司;DYY-8C型电泳仪、DYY-III型水平电泳槽、DYCZ-24DN型垂直电泳槽 北京市六一仪器厂;实时荧光 PCR仪 杭州博日科技有限公司;PB-10型酸度计 Sartorius;P330型超微量分光光度计 Implen GmbH;紫外分光光度计 德国贝克曼;超微量微孔板分光光度计 BioTek Epoch。
1.2 实验方法
1.2.1 黑曲霉表达载体的构建 使用限制性内切酶NheI和HindIII对T3-EXPB7进行双酶切,电泳后分别回收大约750 bp左右的目的条带;同时使用相同的酶对表达载体进行双酶切,回收大约15000 bp左右的条带[19];胶回收方法参照北京全式金胶回收试剂盒说明书。用超微量分光光度计测定胶回收产物的浓度后按照3∶1~6∶1(目的基因∶表达载体)的摩尔比混匀,再加入T4 DNA连接酶,16 ℃过夜连接。载体构建的示意图如图1所示。
将上一步过夜连接的产物导入大肠杆菌感受态进行扩增,挑取长势较好的菌落接到无菌的LB液体培养基中(含Kan 50 mg/L),37 ℃条件下培养12~16 h,然后进行质粒的提取,提取方法参照北京全式金质粒小提试剂盒说明书,再将提取的重组质粒进行双酶切鉴定,将鉴定正确的菌种用甘油保存至超低温冰箱备用。
1.2.2 农杆菌介导法转化黑曲霉 将重组质粒转化到农杆菌中,在培养平板中挑取长势较好的菌落进行液体培养,然后PCR鉴定。分别取出1.5 mL二次活化的农杆菌菌液和黑曲霉菌丝到无菌EP管中,将二者按比例混匀后,涂布于铺有玻璃纸的固体PDA培养基表面(含有200 μmol/L的AS),28 ℃共培养2 d后进行转膜培养,使用潮霉素和头孢噻肟钠作为抗性筛选,直到长出明显的黑曲霉白色菌落。再挑取白色菌落的菌丝放入含有抗性的马铃薯葡萄糖水培养基中静置培养,直到长出大量的黑曲霉菌丝。农杆菌介导转化黑曲霉的步骤参见李杰等[19]方法。3~5 d后挑取平板上长势良好的黑曲霉菌落菌丝,使用糖化酶同源臂引物F7/R7进行PCR,进行黑曲霉转化子的筛选和鉴定,具体方法参见王欣等[20]方法。
采用以基因组DNA为模板,使用鉴定同源重组的引物F8/R8对筛选的转化子进行PCR鉴定,筛选出同源重组转化子,所用的引物如表1所示。

图1 pSZHGS-EXPB7的构建Fig.1 Construction of pSZHGS-EXPB7

表1 阳性及同源重组转化子鉴定引物Table 1 Primer sequence of positive and homologous recombinant transformants
1.2.3 纯合子的筛选 由于该黑曲霉菌丝为多核,为了保证其稳定遗传,因此需要对同源重组转化子加以筛选,直到获得纯合子。
将鉴定正确的同源重组转化子在含有 200 mg/L潮霉素B的PDA和马铃薯葡萄糖水培养基中继续传代,期间收集其黑曲霉菌丝进行基因组的提取并进行同源重组转化子的鉴定,若获得的转化子中糖化酶基因条带消失,只有一条目的条带,则表明已获得纯合的同源重组转化子。
1.2.4 重组菌株转录水平的鉴定 将获得的同源重组转化子在马铃薯葡萄糖水培养基中进行扩培,按照10%的接种量接种于发酵培养基,放入30 ℃摇床,200 r/min培养6 d左右。取出部分发酵液置于50 mL离心管中,将沉淀和上清分开,取部分沉淀进行总RNA的提取,方法参照北京全式金RNA提取试剂盒说明书。
以黑曲霉的总RNA为模板,对其进行反转录获得cDNA,反转录体系和条件参照北京全式金反转录试剂盒。
为了鉴定转入的膨胀素基因是否转录,需要以黑曲霉cDNA为模板,设置内参作为对照,以确定cDNA的完整性,然后设计特异性较好的引物,进行反转录PCR,鉴定膨胀素基因是否转录。所用的引物如表2所示。
1.2.5 膨胀素蛋白的SDS-PAGE检测 取少量发酵液上清进行SDS-PAGE,检测是否存在膨胀素蛋白,主要方法参照文献[21]。
1.2.6 膨胀素蛋白的功能检测
1.2.6.1 滤纸崩解试验 将单独的纤维素酶液、出发菌株发酵液上清和重组菌株发酵液上清分别与0.1 mol/L pH为4.8的柠檬酸缓冲液等比例混合后,取5 mL倒入干净的培养皿中,放入50 mg的定量滤纸后封口放入25 ℃温箱静置,2 d后取出滤纸放在显微镜下观察其崩解程度。

表2 转录水平鉴定的引物Table 2 Primer sequence of identification in transcription level
1.2.6.2 还原糖含量的测定 由于滤纸中含有淀粉,而黑曲霉发酵液中含有淀粉酶,在测定还原糖时,为了避免试验结果受到影响,需要对滤纸预处理。方法如下:将滤纸剪成1 cm×6 cm的50 mg左右的滤纸条,用1%的醋酸溶液浸泡24 h,直到用碘液检验确定没有变蓝后,再用2%的NaHCO3溶液冲洗至中性,置于烘箱烘干备用。
用重组菌株发酵液上清与稀释酶液分别处理滤纸,加入纤维素酶保温后以缓冲液为对照组,设3次重复,采用DNS法测定其葡萄糖的增加量[22]。将重组菌株与稀释酶液协同降解滤纸产生的葡萄糖含量和稀释酶液降解滤纸产生的葡萄糖含量相比,计算葡萄糖的增加比例。
式中:C表示还原糖提取液的浓度,mg/mL;V表示还原糖提取液的总体积,mL;m表示样品重量,g;1000表示mg换成g的系数。
1.3 数据处理
本试验所得的试验数据均通过Excel录入,并使用Excel对试验数据进行初步处理。利用GrapHPad Prism 5对初步处理的数据进行统计分析。另外,利用DPS数据处理系统对试验数据进行单因素方差分析。
2 结果与分析
2.1 黑曲霉表达载体构建
分别用限制酶对目的基因和空表达载体进行双酶切,并用T4 DNA连接酶连接之后转化大肠杆菌进行扩繁;提取质粒后进行双酶切鉴定,得到约15000和750 bp左右的两条带如图2所示,表明黑曲霉表达载体pSZHGS-EXPB7已经成功构建。

图2 双酶切鉴定Fig.2 Double enzyme digestion 注:M1:DNA分子量标准15000 bp;1:pSZHGS原质粒;2:pSZHGS-EXPB7质粒;3:pSZHGS-EXPB7质粒双酶切;M2:DNA分子量标准2000 bp。
2.2 农杆菌介导法转化黑曲霉及转化子鉴定
2.2.1 农杆菌的转化和转化子的鉴定 将构建好的重组载体pSZHGS-EXPB7采用冻融法转化农杆菌,液体培养后进行菌液PCR鉴定,电泳图谱如图3所示。从图3中可以看出约750 bp的单一条带,条带大小与预期的目的条带大小基本一致。

图3 农杆菌转化子的PCR鉴定图谱Fig.3 PCR identification map of Agrobacterium transformants注:M:Marker DL2000;1:EXPB7。
2.2.2 农杆菌与黑曲霉共培养 取出二次活化的农杆菌菌液和黑曲霉菌丝,将二者按比例混匀后,涂布于铺有玻璃纸的固体PDA培养基表面(含有200 μmol/L的AS),28 ℃共培养2 d,共培养的结果如图4所示。

图4 农杆菌与黑曲霉共培养Fig.4 Co-culture of Agrobacterium tumefaciens and Aspergillus niger
2.2.3 黑曲霉同源重组转化子的筛选和鉴定
2.2.3.1 转化子的鉴定 挑取平板上长势良好的黑曲霉菌落菌丝进行黑曲霉转化子的筛选和鉴定,鉴定图谱如图5所示。由图5可知,转化菌株经鉴定已扩增出了约4700和3000 bp的两个目的条带,4700 bp的条带与黑曲霉出发菌株目的基因片段大小一致,3000 bp条带出现则表明已经成功获得了EXPB7基因的阳性转化子。用基因组DNA为模板,使用引物F8/R8进行PCR鉴定,鉴定图谱如图6所示。由图6中可以看出,该基因的阳性转化子有部分扩增出了约1701 bp的目的条带,表明已经成功获得EXPB7基因的同源重组转化子。

图5 黑曲霉转化子的PCR鉴定图谱Fig.5 PCR identification map of Aspergillus niger transformants注:M:Marker DL15000;1~6:EXPB7转化子鉴定。

图6 同源重组转化子的PCR鉴定图谱Fig.6 PCR identification map of homologous recombination transformants注:M:Marker DL15000;1~6:EXPB7同源重组转化子的鉴定。
2.2.3.2 纯合子的筛选 将鉴定正确的同源重组转化子连续传代几次进行鉴定。由图7可以看出获得的转化子含有4700 bp的条带并未完全消失,未筛选到纯合子,可能是因为黑曲霉为多核菌丝,杂合子在生长过程中由于无法与出发菌株竞争而退化。
图7 EXPB7纯合子的筛选Fig.7 Homozygous selection of EXPB7注:M:Marker DL5000;1~6:EXPB7纯合子的筛选。
2.3 重组菌株转录水平和蛋白的鉴定
通过PCR鉴定获得的同源重组转化子的目的基因是否转录,鉴定图谱如图8所示。由图8可知,内参引物扩增出单一条带,说明反转录获得的cDNA比较完整;特异性引物扩增出单一的约120 bp左右的条带,与预期结果一致,表明该膨胀素基因已经在黑曲霉中成功转录。膨胀素蛋白的分子量经过预测发现,EXPB7的分子量约为28 kDa。取少量发酵液上清进行SDS-PAGE,蛋白质电泳图谱如图9所示,电泳后发现重组菌株与出发菌株相比,在相应的位置附近有变化,但在28 kDa处的目的条带不明显,可能是由于膨胀素基因在黑曲霉中的表达量过低。

图8 重组菌株的反转录PCR鉴定Fig.8 Electrophoresis of reverse transcription PCR of recombinant strains

图9 发酵液上清的蛋白质电泳图谱Fig.9 Map of protein electrophoresis of the supernatant of fermentation broth注:M:蛋白质Marker;1:培养基上清;2:出发菌株发酵液上清;3:EXPB7重组菌株发酵液上清。

图10 转化子的发酵液上清对滤纸崩解的影响(40×)Fig.10 Effect of the supernatant of fermentation broth on the disintegration of filter paper(40×)注:A:纤维素酶;B:出发菌株发酵液上清+纤维素酶;C:EXPB7转化子发酵液上清+纤维素酶。
2.4 EXPB7蛋白的功能验证
2.4.1 滤纸崩解 其中出发菌株发酵液上清与纤维素酶共处理滤纸时,滤纸变化不大,说明出发菌株的分泌蛋白并没有对滤纸崩解起明显促进作用。
2.4.2 还原糖含量变化 由滤纸崩解实验可知,出发菌株的分泌蛋白并没有对滤纸的崩解起明显促进作用,所以,我们利用稀释酶液和重组菌株发酵液上清对滤纸进行处理,对产生的还原糖含量进行测定,结果如图11所示,与仅用酶液处理滤纸产生的葡萄糖含量相比,EXPB7能够将纤维素酶的水解效率提高32.9%,表明膨胀素蛋白可以提高纤维素酶的水解效率。
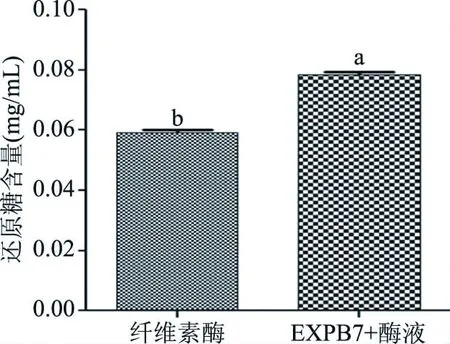
图11 重组菌株上清处理滤纸还原糖含量变化Fig.11 Changes in reducing sugar content of filter paper treated with recombinant strains
3 讨论与结论
迄今为止已经有很多的外源蛋白在黑曲霉中成功表达,黑曲霉具有高效的蛋白表达[23]、分泌和修饰能力及很强的外源基因表达能力,其重组子具有很高的遗传稳定性,它可生产木聚糖酶、纤维素酶、果胶酶等多种酶,成为了一个重要的酶表达体系。许多研究者已经证明了黑曲霉发酵产纤维素酶的活力高、产量大、酶功能完整、优化程度高,用途十分的广泛[24]。当然,有些外源蛋白也可以通过巴斯德毕赤酵母表达系统进行表达,利用毕赤酵母构建膨胀素工程菌,可有效分泌膨胀素,利用膨胀素具有破坏纤维素的结构的能力,可有效地提高纤维素酶对纤维素的分解效率[25];构建木聚糖酶工程菌,通过构建游离型表达质粒表达与整合表达联合应用来强化木聚糖酶的分泌效率提高其酶活[26]。本试验用到的工程菌黑曲霉也可以提高木聚糖酶的活性,并且比毕赤酵母表达系统更有优势,其具有美国FDA认证的GRAS食品级生产许可,为其在食品领域的应用提供了质量保障[24]。
膨胀素是植物生长发育过程中诱导细胞壁松弛和伸展的蛋白,破坏纤维素微纤丝之间氢键使纤维素结构松散从而提高其酶解效率[27],有着潜在的应用价值,但不具有纤维素水解活性[28]。膨胀素对纤维素结构的破坏活性被认为能促使酶更好的与底物结合从而与纤维素酶协同作用提高底物水解效率[29]。郭尧敏等[30]研究了水稻根特异表达的膨胀素基因OsEXPA8,该基因对水稻悬浮细胞的生长具有调控作用,可以促进水稻悬浮细胞的分裂和生长,使细胞数量增加,体积增大。姚杨[31]将里氏木霉膨胀素基因swol在黑曲霉中进行表达,重组的pSZHGS-swol菌株的发酵液上清能够协同纤维素酶降解滤纸纤维,使其更加膨松并且有明显的崩解效果,验证了该蛋白具有明显的膨松滤纸纤维的作用。但其在研究该膨胀素基因在黑曲霉中表达时,目的条带也不明显,说明表达量过低不是个例。对于本研究中表达量不高的情况可以通过更换不同的分泌型表达载体的信号肽序列来优化,也可以通过密码子优化方法使植物膨胀素基因的密码子更换为偏好于黑曲霉的密码子来优化。黄莎莎等[25]将从黄瓜D0462中克隆的Cs-EXPA1基因和Cs-EXPA2基因转化到毕赤酵母中,EXPA1蛋白、EXPA2蛋白与纤维素酶的协同作用均可以使滤纸发生崩解,其水解协同效率与本研究协同效率相当。
本研究将寒地冬小麦膨胀素基因EXPB7转化到黑曲霉中进行表达,EXPB7转化子发酵液上清和纤维素酶共同作用,滤纸发生崩解现象明显,水解葡萄糖含量增加,与预期效果一致。
