南极菌Pseudoalteromonas sp.A211-5产α-淀粉酶Amy3809的表达、性质及其降解特性
2020-04-01谷晓倩李潘爱红林学政
谷晓倩李 江*潘爱红林学政
(1.自然资源部 第一海洋研究所 海洋生态环境科学与技术重点实验室,山东 青岛266061;2.青岛科技大学 化工学院,山东 青岛266061)
α-淀粉酶(α-1,4-glucan-4-glucanohydrolase;EC 3.2.1.1)是一种内切葡糖苷酶,能够特异性的作用于α-1,4糖苷键,从而将可溶的淀粉、糖原等大分子糖类物质降解为糊精、麦芽糖以及葡萄糖等小分子量的还原糖,从而迅速降低了淀粉的黏度,起到液化作用,所以α-淀粉酶也称为液化酶[1]。α-淀粉酶主要归属于糖苷水解酶(Glycoside Hydrolase,GH)13,57和119家族,但绝大多数为GH13家族成员(http:∥www.cazy.org/Glycoside-Hydrolases.html)。
α-淀粉酶广泛地来源于动物、植物和微生物,特别是微生物来源的α-淀粉酶由于生产成本低、生产工艺简单高效,因而广泛地应用于食品、纺织、发酵、造纸等领域[2-3]。目前,对来源于Bacillussp.的α-淀粉酶研究最为深入,主要是由于该类酶具有良好的热稳定性[4]。近年来,随着对α-淀粉酶的工业应用要求不断提高,筛选和开发具有高催化活性、底物特异性、热稳定性、金属离子和变性剂耐受性及广泛p H适应性的特殊催化特性的α-淀粉酶,成为工业应用领域关注的焦点[5]。
在工业生产中,淀粉先要蒸煮糊化然后加入淀粉酶对其水解,但这种传统方法会消耗大量的热能进而使其生产成本提高。近年来,采用常温酶降解生淀粉的研究得到广泛的关注,目前,已发现了多个能够降解生淀粉的淀粉酶,这些酶能够在低于淀粉糊化的温度下直接对生淀粉进行降解,该工艺有效地降低了能耗,简化了操作流程,从而缩减了生产成本[6-7],因此在诸多工业领域显示出重要的应用前景。
南极海域不同于淡水、土壤等陆地环境,具有低温、高盐和强辐射等环境特征,生存于其中的微生物具有一些与其特殊环境相适应的形态学、生理学和遗传学上的特异性,因而蕴藏着大量功能独特的低温酶资源。目前,已报道的淀粉酶大多来自陆地和海洋微生物[8-12],而有关南极微生物的淀粉酶尚未见报道。本实验室在前期工作中,从南极沉积物中筛选获得了大量具有产淀粉酶活性的南极菌株,采用高通量测序技术获得了高产酶菌株Pseudoalteromonassp.A211-5的全基因组数据,筛选获得了淀粉酶疑似序列amy3809,并对其进行异源表达和酶学性质研究,以期获得具有潜在应用前景的高活性、高稳定性的α-淀粉酶。
1 材料和方法
1.1 菌株
产淀粉酶菌株Pseudoalteromonassp.A211-5分离自第32次南极科考采集的阿蒙森海深海沉积物(128°08'42″W,71°53'55″S),纯化的菌株保存于自然资源部第一海洋研究所菌种库(-80℃)。
1.2 试剂和材料
蛋白胨(Oxoid)、酵母粉(Oxoid);可溶性淀粉(天津市大茂化学试剂厂);IPTG(Solarbio);卡那霉素(Solarbio);麦芽糖标准样品(Miragen);E.coliBL21(DE3)(北京全式金生物技术有限公司);表达载体p ET-30a(His·Tag)(Takara);Ni Sepharose(GE Healthcare);硅胶板(Merck KGa A);其他试剂为国产分析纯。
3,5-二硝基水杨酸溶液:182 g四水合酒石酸钾钠溶解于600 m L蒸馏水中,加入21 g NaOH,6.3 g DNS,5 m L苯酚,5 g亚硫酸钠,定容到1 000 m L容量瓶中,储存于棕色瓶中;展开剂:根据实验需求正丁醇、冰乙酸、蒸馏水按2∶1∶1的体积比配制;显色剂:量取200 m L的丙酮于250 m L烧杯中,再加入4 g二苯胺,再加入4 m L的苯胺,20 m L的磷酸溶液,混匀后储存于棕色瓶中备用。
1.3 α-淀粉酶amy 3809的克隆
1.3.1 引物的设计
以全基因组测序获得的淀粉酶基因amy3809完整ORF为模板,设计特异性扩增引物(http:∥seq.yeastgenome.org/cgi-bin/web-primer);分析序列的限制性内切酶位点,并在引物的5'端和3'端分别引入相应限制性内切酶位点,特异性引物由金斯瑞生物技术有限公司合成:上游引物TATGTATCCGCAGTACTGT-3')添加BamHI酶切位点;下游引物GCGCTGCTAAA-3')添加XbaⅠ酶切位点
1.3.2 PCR扩增
以南极菌A211-5基因组为模板进行PCR扩增。PCR体系(50μL):2×Taq PCR Master Mix(Tiangen)25μL,通用引物27F、1492R各1μL,细菌基因组DNA模板1μL,灭菌蒸馏水。
PCR扩增程序:首先95℃预变性5 min,然后95℃变性30 s,55℃退火30 s,72℃延伸1.5 min,扩增30个循环;最后72℃延伸10 min,扩增获得的PCR产物采用琼脂糖凝胶进行回收纯化。
1.4 α-淀粉酶基因amy 3809的表达
1.4.1 表达载体的构建
采用Bam H I/Xba I内切酶分别对扩增的PCR产物和表达载体p ET-30a进行双酶切,利用T4 DNA Ligase连接纯化的目的基因和表达载体,从而构建重组质粒amy粒3809+p ET-30a,并将其转化TOP10感受态细胞。重组菌接种于含卡那霉素(50 mg/L)的LB液体培养基中37℃培养16 h,涂布平板筛选阳性克隆。提取阳性克隆的重组质粒转化E.coli BL21(DE3)表达宿主,转化的菌株涂布于LB固体平板(含50mg/L卡那霉素)于37℃培养24 h。
1.4.2 重组质粒的鉴定
挑取在板上产生透明圈的重组菌,提取重组质粒,采用双酶切和测序两种手段对重组质粒的插入片段进行验证,测序由南京金斯瑞生物技术有限公司完成。
1.5 重组α-淀粉酶Amy3809的纯化
按1%的接种量将重组菌接种在含卡那霉素(50 mg/L)的50 m L LB培养基中,37℃,150 r/min培养6~7 h;从50 m L液体培养基中取3 m L菌液加到300 m L的液体培养基,振荡培养至OD600为0.6~0.8时,加入终浓度为0.5 mmol/L的IPTG,16℃,125 r/min条件下培养24 h;经过诱导的重组菌于4℃、9 000 r/min的条件下离心15 min,收集菌体;采用p H为7.0的PBS缓冲液重悬菌体,然后于4℃、10 000 r/min的条件下离心10 min,获得粗酶液。
收集的粗酶液采用Ni-NTA His Tag Kit进行纯化[13],洗脱液为含有不同浓度咪唑 (40,80,120,160,200 mmol/L)的PBS缓冲液(p H=7.0),将不同浓度的洗脱液进行合并,采用SDS-PAGE方法对重组蛋白的分子量和纯度进行鉴定。
1.6 重组α-淀粉酶Amy3809的酶学性质研究
1.6.1 酶活测定方法[14-15]
反应体系为:1 m L粗酶液,1 m L底物(2 mg/m L淀粉溶于p H 7.0的磷酸缓冲液),50℃反应30 min,采用DNS法测定水解产生的还原糖吸光值。酶活力单位定义:1 m L酶液在50℃和p H=7.0条件下1 min催化产生1μg还原糖(以葡萄糖计)所需的酶量。每组实验设3个平行,取平均值。
1.6.2 重组α-淀粉酶Amy3809的性质
分别在10,20,30,40,50,60和70℃的反应温度下测定酶活,以确定其最适反应温度;分别在40,50,60℃的条件下保温0,1,2,3,4,5,12,24 h,然后测定其残余酶活,确定该酶的热稳定性;分别采用不同p H范围的缓冲液:NaAC-HAC(p H为4.0~5.0),Na2HPO4-Na H2PO4(p H为6.0~8.0),Gly-NaOH(p H为9.0~10.0),Na2HPO4-NaOH(p H=11.0),以测定其最适p H;分别配制含100 mmol/L EDTA,Na+,K+,Ca2+,Mg2+,Cu2+,Ba2+,Sr2+,Mn2+,Ni2+,Fe2+,Fe3+的溶液,加入到稀释酶液中使其终浓度达到5 mmol/L,以不加任何离子所测的酶活力定义为100%,以测定金属离子对Amy3809的影响。
1.7 降解产物分析
将1 m L重组酶Amy3809与1 m L底物(2 mg/m L淀粉溶于p H 7.0的磷酸缓冲液)在50℃条件下反应6 h,沸水浴10 min终止反应,离心备用。
1.7.1 薄层层析法(TLC)[16]
吸取一定量的麦芽糖标准样品、葡萄糖标准样品和反应产物上清,点于硅胶板上放入加有15 m L展开剂的层析槽中进行层析。在通风橱内层析约6 h,取出风干后用喷壶均匀喷洒显色剂于硅胶板上,等待风干后将硅胶板于90℃烤箱中烘烤10 min左右,直至样品显色效果明显。
2 结果与分析
2.1 基因克隆及序列分析
通过特异性引物克隆获得的α-淀粉酶基因amy3809序列全长为1 866 bp,编码619个氨基酸,预测其理论分子量为67 kDa。相似性比对结果表明,Amy3809与Amy Ac-3家族成员具有高度的相似性,与:α-amylase fuliginea(WP_033029470.1),α-amylase MelDa3(PLT24194.1),α-amylase ruthenica(WP_082079259.1)和αamylase S3431(WP_033039320.1)序列的相似性高达64%以上(图1)。

图1 Amy3809氨基酸序列的多重比对结果Fig.1 Multiple sequences alignment of Amy3809 with known alpha-amylase
2.2 α-淀粉酶Amy3809的表达与纯化
经双酶切和测序验证后的重组质粒amy3809+p ET-30a成功转化到E.coliBL21.(DE3)(图2)。SDSPAGE的结果表明,0.5 mmol/L的IPTG能够显著诱导重组蛋白的表达量,且该重组酶可溶性表达的比例很高(图3),同时也验证了目的基因,成功地实现了高效异源表达。
重组蛋白经镍柱纯化后可得到单一的蛋白条带,其洗脱液中咪唑浓度为120 mmol/L。SDS-PAGE结果显示重组酶Amy3809分子量约为70 k Da,与推测的理论分子量一致(67 k Da)。纯化后的Amy3809经标准酶活测定方法测定,其比活力为343 U/mg。
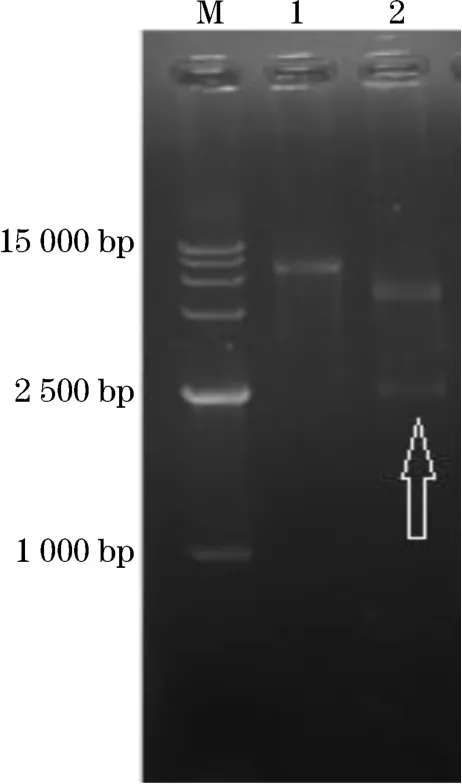
图2 重组质粒的双酶切结果Fig.2 Double enzyme digestion of recombinant plasmids
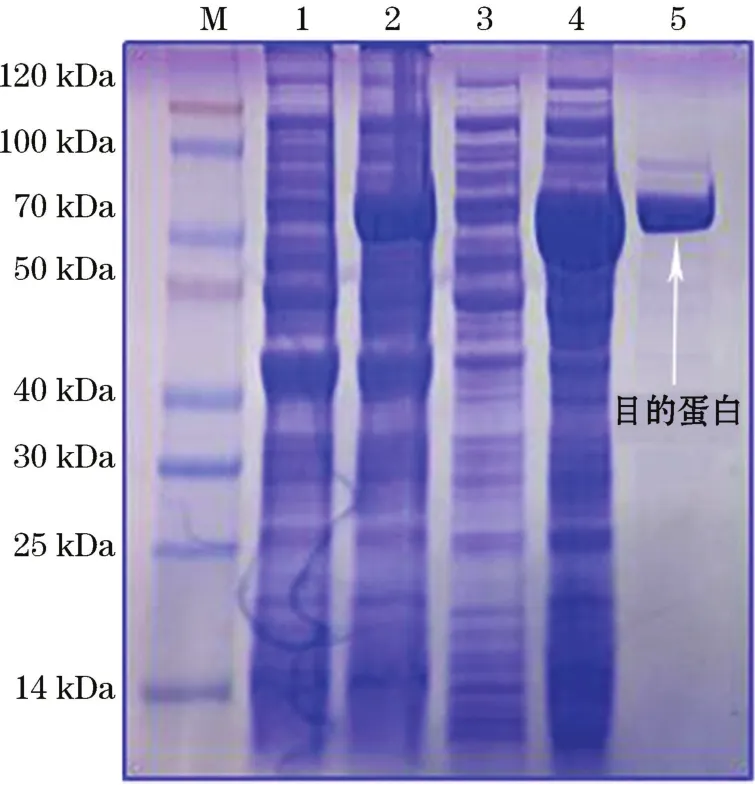
图3 Amy3809蛋白表达的SDS-PAGE分析Fig.3 SDS-PAGE of Amy3809
2.3 重组酶Amy3809的性质
纯化后的重组酶Amy3809在温度为50℃时呈现最高的酶活,且在10~40℃的范围内仍能保持85%以上的酶活,但当反应温度升高为60℃时,酶活显著下降,70℃时几乎失活,表明该酶具有良好的低温耐受特性及热敏感性(图4)。热稳定性实验表明,该酶在低温条件下具有较好的稳定性,当温度为40℃时,保温24 h的条件下,仍可保持在50%以上的初始酶活;50℃保温12 h,残留酶活仍能达到50%以上;当温度升高到60℃时,其稳定性显著下降。与大多低温酶类似,α-淀粉酶Amy3809在低温下较稳定,随着温度的升高稳定性显著降低(图5)。

图4 温度对重组酶Amy3809活性的影响Fig.4 The effect of temperature on the activity of Amy3809
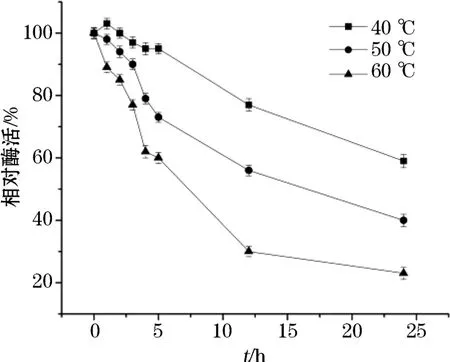
图5 温度对重组酶Amy3809稳定性的影响Fig.5 The effect of thermostability on Amy3809 at different temperatures and time points
Amy3809具有较广的p H耐受范围,其最适作用p H=7.0,但该酶在p H 5.0~10.0的范围内,仍保持50%以上的初始活性(图6)。
金属离子对重组酶Amy3809的活性具有显著的影响,如图7所示,5 mmol/L Na+,K+,和Ca2+能够提高重组酶Amy3809的活性,但Cu2+,Fe2+,Mg2+和EDTA则显著降低α-淀粉酶Amy3809的活性,尤其是Cu2+,Fe2+和 Mg2+(图7)。
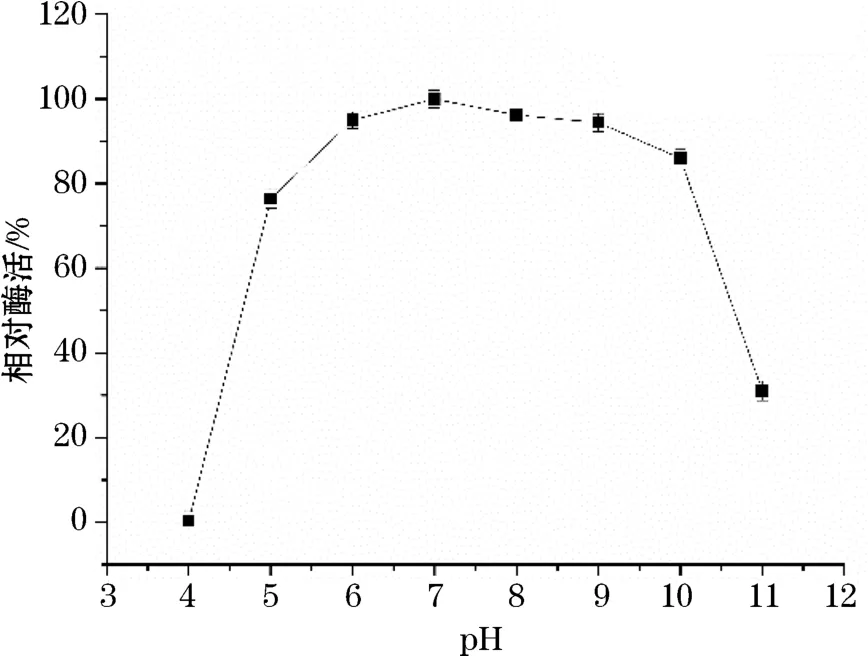
图6 p H对重组酶Amy3809活性的影响Fig.6 The effect of p H on the activity of Amy3809

图7 金属离子对重组酶Amy3809活性的影响Fig.7 The effects of metal ions and metal salts on the activity of Amy3809
2.4 酶解产物的分析
为验证重组酶Amy3809对可溶性淀粉的降解特性,我们采用薄层色谱(TLC)分析手段进行了分析,结果如图8所示。由图8可见,重组酶Amy3809能够有效地将可溶性淀粉降解为葡萄糖及不同聚合度的麦芽寡糖,其麦芽寡糖主要组成为麦芽四糖、麦芽三糖和麦芽糖。根据酶解产物的差异,可将α-淀粉酶分为两类:糖化型α-淀粉酶和液化型α-淀粉酶。二者主要的差异在于,液化型α-淀粉酶最终酶解产物为寡聚糖和糊精,而糖化型α-淀粉酶则随着反应时间的延长,除了有寡聚糖产生外,还会有葡萄糖终产物的产生。由图8可见,经过6 h的反应,重组酶Amy3809的终产物中检测到大量的葡萄糖产物,因此,我们初步推测该酶为糖化型α-淀粉酶。
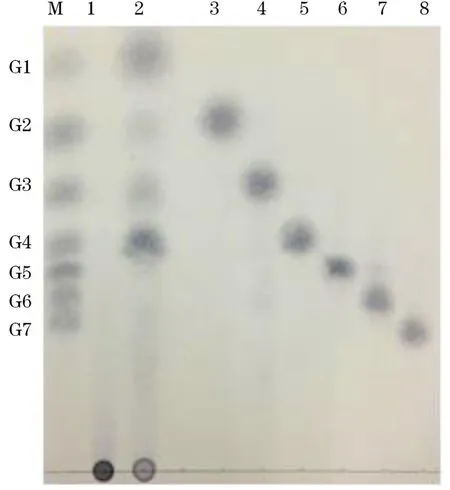
图8 重组酶Amy3809降解产物的TLC分析Fig.8 TLC of the hydrolysis products of recombinan Amy3809
3 讨 论
迄今为止,已有大量淀粉酶从海水、海洋沉积物、海藻、海洋软体动物、淡水和土壤等环境微生物中分离获得,但多数已报道的淀粉酶活力低、稳定性差,无法满足工业化生产的需求[17],因此活性高、稳定性好的中温淀粉酶的筛选和发现仍具有重要意义。南极具有独特的自然环境[18],因而孕育了丰富多样的生命形态,其在极端环境(如低温、高压、低营养输入、无光)下的生存机制,造就了各种具有独特生理活性的活性物质和酶系[19-21]。本研究的α-淀粉酶基因amy3809来自于南极适冷菌(Pseudoalteromonassp.A211-5),目前有关南极微生物产淀粉酶的研究尚不多见,重组α-淀粉酶Amy3809的酶学性质研究表明,该酶具有很好的低温耐受及热敏感特性、活性强、p H适应性广,因而具有潜在的应用价值。
重组α-淀粉酶Amy3809的最适作用温度为50℃,但随着温度的升高酶活迅速降低,70℃时几乎失活,表明该酶具有良好的低温耐受特性及热敏感性,据此推测此特性应该与其来源地南极生境相符。本研究结果略低于已有的中温α-淀粉酶,如刘洋等[16]和Sodhi等[22]报道从芽孢杆菌分离的α-淀粉酶最适反应温度为55℃;而Igarash等[23]和黄彦超等[24]报道的α-淀粉酶最适反应温度为60℃。中温酸性的α-淀粉酶在啤酒酿造以及淀粉糖浆行业中都具有显著的应用优势,首先,酸性淀粉酶能够与糖化酶协同作用增加淀粉的水解效率;其次,中温淀粉酶能够在较低的反应温度下进行淀粉降解,节能降耗;此外,中温淀粉酶也更容易灭活。因此,中温α-淀粉酶的开发和应用势在必行[25]。Amy3809的最适p H为7.0,且在p H在5.0~10.0的范围之内仍保持着较高的酶活,具有广泛的酸碱耐受性,该特性与已报到的α-淀粉酶Amy WQJ以及菌株825产的α-淀粉酶p H适应性相一致[26-27],由于该酶具有良好的酸碱耐受性,因此具有潜在的工业生产和应用前景。
金属离子通常会对酶的活性产生影响,在研究中Ca2+,K+,Na2+能够显著地提高Amy3809的酶活,该结果也与已有的报道相一致[27-29],很多海洋微生物来源的酶在Ca2+的作用下酶活能够得到提到,推测可能是因为Ca2+与酶中的特定氨基酸的羰基形成的配位键,对于稳定酶分子的三维结构起到了重要作用,该结果也与α-淀粉酶Amy3809产生菌的生境特征相符合;而Cu2+,Fe2+和Mg2+可能是通过与Ca2+竞争活性中心的结合位点,从而抑制其活性,而该酶确切的催化机理尚需进一步研究。
重组α-淀粉酶Amy3809能够有效地将可溶性淀粉降解为麦芽四糖、麦芽三糖、麦芽糖和葡萄糖等小分子的寡糖和单糖,该结果也与已有的报道相似,α-淀粉酶Amy WQJ水解木薯淀粉的终产物为麦芽六糖和麦芽七糖,还有其他不同聚合度的糊精[26];α-淀粉酶r BD5063水解可溶性淀粉,随时间延长缓慢释放低聚寡糖、麦芽糖和葡萄糖,水解17 h后,释放大量低聚寡糖[30];α-淀粉酶Amy H水解淀粉的第1个明显的寡聚麦芽糖产物是麦芽三糖,最终产物为多种低聚麦芽寡糖[31]。
鉴于α-淀粉酶Amy3809低温耐受及热敏感特性,以及广泛的p H耐受范围,加之高效的可溶性表达,使得该酶在洗涤、食品、污水处理等行业中具有广阔的应用前景,该研究也为南极微生物资源的开发利用提供了新思路。
4 结 语
本文对来自南极Pseudoalteromonassp.A211-5的α-淀粉酶基因Amy3809进行了克隆表达和酶学性质研究。结果表明,异源表达的重组α-淀粉酶Amy3809的最适作用温度为50℃、最适作用p H为7.0,且该酶具有良好的低温耐受和热敏特性以及较宽泛的p H适应范围;金属离子Na+,K+和Ca2+能够激活重组α-淀粉酶Amy3809的活性,而Cu2+,Fe2+,Mg2+和EDTA则对其活性具有抑制作用;且该酶能够有效地将可溶性淀粉降解为麦芽四糖、麦芽三糖、麦芽糖和葡萄糖。综上可见,α-淀粉酶Amy3809具有良好的低温耐受和热敏特性以及较广的p H耐受范围,能够有效地将淀粉降解为低聚糖和葡萄糖,因此在工业生产中具有潜在的应用价值。
