睡眠剥夺对大鼠学习记忆和海马区p-ERK表达的影响
2020-04-01苗素云于爱玲苗素梅赵芳芳仲丽霞刘志强唐吉友
苗素云 于爱玲 苗素梅 赵芳芳 仲丽霞 刘志强 唐吉友
1.泰安市中心医院神经内科,山东 泰安 271000; 2.山东第一医科大学第一附属医院,山东 济南 250014
睡眠剥夺是指由于环境或自身原因无法满足正常睡眠,表现为睡眠减少和/或睡眠的连续性中断,长期睡眠剥夺很容易导致行为水平下降、注意力不集中、记忆力丧失和学习能力下降等[1]。研究发现,睡眠剥夺可对身体健康造成不同程度的影响,但对学习记忆影响机制的研究仍然有限[2-3]。丝裂原激活蛋白激酶(MAPK)是一组能被不同刺激激活的丝氨酸-苏氨酸蛋白激酶,能与细胞内和细胞外信息通路相结合。MAPK家族的主要成员ERK1/2在接受外界刺激时会产生反应,能将细胞外信号导入细胞核,完成对细胞功能的调控。MAPK/ERK信号通路是目前研究最为广泛的信号转导途径之一,参与细胞增殖、生长和分化等各种生理和病理过程[4]。目前,长时程增强(LTP)被认为与大脑的学习和记忆过程有关。LTP可以通过激活N-甲基-D-天冬氨酸(NMDA)来诱导生成[5]。研究表明,阻断MAPK/ERK信号通路可以抑制LTP产生,从而影响大脑的学习和记忆能力[6],因此MAPK/ERK信号通路在学习和记忆中起着重要作用。
1 材料与方法
1.1 材料
1.1.1实验动物及分组 经过筛选后的健康成年雄性SD大鼠(198~274 g,由山东济南朋悦实验动物繁育有限公司提供)。大鼠放鼠笼正常饲养以适应环境,1周后随机分为对照组和睡眠剥夺组,每组30只。对照组置于平台控制系统(不旋转平台)饲养,睡眠剥夺组进行5天睡眠剥夺。动物房设置12 h光亮/黑暗,环境温度22~25℃。
1.1.2主要试剂与仪器 睡眠剥夺装置(SA107,江苏赛昂斯生物科技有限公司);Morris水迷宫系统(WMT-100S,成都泰蒙软件有限公司);BSA蛋白质定量试剂盒(北京雷根生物技术有限公司);RIPA裂解液(碧云天生物技术有限公司);兔抗大鼠ERK1/2(AB17942,美国Abcam公司);小鼠抗大鼠p-ERK1/2(4377,美国CST公司);山羊抗兔H&L抗体(ab6721,美国Abcam公司);山羊抗小鼠H&L抗体(ab6789,美国Abcam公司)。
1.2 方法
1.2.1睡眠剥夺 采用多平台水环境法睡眠剥夺装置对大鼠进行快速眼球运动(REM)期睡眠剥夺。设置平台前后旋转,运行速度为100 r/min。当大鼠进入REM期睡眠时,全身肌肉张力下降,站立的平台随机移动,致使大鼠觉醒无法进入REM期睡眠。对照组动物被放置到不旋转的平台上,允许获得REM期睡眠。大鼠无反应、冷漠、警觉性下降表明大鼠睡眠剥夺模型已成功制备。
1.2.2Morris水迷宫实验 采用Morris水迷宫的定位航行实验和空间搜索实验,前者用于获取各组大鼠提取空间信息和学习能力,后者用于测试记忆储存及提取再现能力。根据实验室的空间线索,训练大鼠寻找隐藏的平台。选择每个象限醒目标记下方为入水点,将大鼠面向池壁放入水中。象限的选择是随机的,每个象限均有相同的机会。每次实验中允许大鼠发现平台的最长时间为120 s,发现平台后登上平台,允许在平台上停留30 s。如果在规定时间(120 s)内没有发现平台,被引导上平台,在平台上停留30 s,记录逃避潜伏期为120 s。发现隐藏平台的时间(逃避潜伏期)和距离被智能视频跟踪系统跟踪记录。实验训练时间为4天,每天上午和下午各训练1次。
训练结束后,两组大鼠各分为5个亚组,每个亚组6只,睡眠剥夺组大鼠分别进行1、2、3、4、5天的睡眠剥夺,睡眠剥夺后的大鼠及对照组大鼠在睡眠剥夺装置的不旋转平台上饲养。每天进行定位航行实验。在第6天进行空间搜索实验,隐藏的平台从水迷宫中移走,选择平台相对象限为入水点。测试1次,时间120 s,记录穿越原平台位置的次数和平台所在象限游泳时间占总时间的百分比。
1.2.3蛋白免疫印迹法检测海马区p-ERK1/2蛋白的表达
1.2.3.1标本制备 各组大鼠在空间搜索实验结束后,立即给予2%戊巴比妥钠30 mg/kg,4℃生理盐水120 mL心脏快速灌注后断头取脑,在置冰的培养皿中分离背外侧皮质和海马,立即放置到液氮中冻存。后将样本放置到-80℃冰箱保存以备用。每个动物的断头和样本收集过程约持续4 min。
1.2.3.2海马区p-ERK1/2蛋白的表达 冰上称取海马组织,充分磨碎,加入组织裂解液裂解,提取总蛋白,进行蛋白定量测定。后按4︰1加入蛋白上样缓冲液,95℃加热15 min。取10 μl加入上样孔,10%分离胶分离蛋白后,4℃恒流280 mA转膜1 h。在室温下加入5%脱脂奶粉,于摇床封闭2 h,加入兔抗大鼠ERK1/2(1︰3 000)或小鼠抗大鼠p-ERK1/2(1︰1 000),PVDF膜与抗体充分接触,4℃孵育过夜;一抗孵育结束后,TBST试剂洗膜3次,每次10 min。加入山羊抗兔H&L抗体或山羊抗小鼠H&L抗体(1︰10 000),37℃摇床孵育1 h;TBST洗涤后,将PVDF膜和ECL试剂室温孵育1 min,立即在暗室中压片曝光,显影定影后胶片保存。使用Image J图像分析软件对各个目标条带进行灰度扫描并分析,计算样品内p-ERK1/2蛋白的灰度值与同样品ERK1/2蛋白的灰度值之比,其比值为p-ERK1/2的相对表达量。
1.3 统计学处理
2 结 果
2.1 Morris水迷宫的检测
2.1.1定位航行实验结果 各组间平均逃避潜伏期差异有统计学意义(F=10.41,P<0.001)。随着训练次数的增加,两组的搜索时间均有所缩短,与对照组相比,睡眠剥夺组大鼠在睡眠剥夺的第2天开始逃避潜伏期明显延长,差异有统计学意义,见表1。

表1 各组平均逃避潜伏期比较
2.1.2空间搜索实验结果 各组穿越原平台位置的次数和平台所在象限游泳时间占总时间的百分比不全相同(F=6.08,P<0.001;F=4.89,P<0.001)。与对照组相比,睡眠剥夺组大鼠在睡眠剥夺的第2天开始穿越原平台位置的次数和平台所在象限游泳时间占总时间的百分比减少,差异有统计学意义,见表2、3。

表2 各组穿越原平台位置的次数比较次)

表3 各组平台所在象限游泳时间占总时间的百分比比较
2.2 蛋白免疫印迹法检测结果
各组大鼠海马组织内p-ERK1/2相对表达量不全相同(F=87.85,P<0.001)。与对照组相比,睡眠剥夺组大鼠在睡眠剥夺的第2天开始p-ERK1/2表达减少,差异有统计学意义(图1、表4)。

图1 各组大鼠海马区p-ERK1/2表达
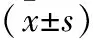
表4 各组大鼠海马区p-ERK1/2相对表达量的比较
3 讨 论
睡眠剥夺通常是指由周围环境及其自身因素所形成的、导致睡眠能力低下或不足的一种状态。随着人们生活节奏的不断加快,工作压力逐渐加大,越来越多的人受到睡眠不足、睡眠限制和长期潜在睡眠剥夺状态的威胁。近年来通过流行病学、人类睡眠剥夺实验和动物睡眠剥夺实验的研究发现,长期处于睡眠剥夺状态的人或动物不但会出现焦虑、易怒、易疲劳,身体处于亚健康状态,还可引起思维紊乱、学习记忆受损[7-10]。有研究发现人和动物的学习记忆能力受损程度与睡眠剥夺的持续时间成正比[11]。然而,睡眠剥夺对学习记忆影响的机制尚不清楚。
MAPK是一种重要的细胞外信号转导途径,能将细胞外信号导入细胞核,使细胞产生效应。MAPK通过3条通路:ERK、蛋白调节激酶p38和c-jun末端调节激酶通路完成对细胞功能的调控。MAPK/ERK信号通路可通过多种途径激活细胞内的ERK,激活后的ERK可以从多个方面参与学习和记忆形成过程[12-13]。ERK主要包括ERK1和ERK2,研究发现ERK与LTP的形成密切相关[14-16]。当ERK表达受到抑制时,可阻滞海马CA1区LTP的诱导产生。LTP和学习记忆过程密切相关,其表达受抑会影响空间学习记忆[15],因此认为MAPK信号通路中ERK的激活在学习记忆过程中起着重要作用。
作为经典实验,Morris水迷宫主要用于检测动物的空间学习和记忆能力。Zhu等[17]使用Morris水迷宫研究睡眠剥夺大鼠的空间记忆变化,发现睡眠剥夺大鼠的逃避潜伏期和探索距离明显高于对照组,在原平台象限探索时间百分比明显低于对照组,证实睡眠剥夺后大鼠的空间记忆显著降低。本研究通过Morris水迷宫实验探讨睡眠剥夺对大鼠学习记忆的影响。定位航行实验结果表明,睡眠剥夺组大鼠逃避潜伏期明显高于对照组。在空间搜索实验中,睡眠剥夺组大鼠穿越原平台位置的次数和平台所在象限游泳时间占总时间的百分比明显低于对照组,差异具有统计学意义,提示睡眠剥夺后大鼠的空间学习记忆受损。
MAPK/ERK信号通路采用高度保守的三级激酶级联传递信号即Raf /MEK/ERK。Ras是MAPK/ERK通路的启动子,是一种GTP结合蛋白。活化的Raf使MEK Ⅷ亚区的两个丝氨酸磷酸化而激活,激活后的MEK1/2使ERK1/2的苏氨酸和酪氨酸双位点磷酸化而激活。ERK1/2激活后将信号传递到细胞核,影响相关转录因子以实现细胞调节。前期研究证实睡眠剥夺大鼠的Ras、MEK1/2及p-ERK1/2表达低于对照组[18]。Zhang等[19]用ERK抑制剂阻断大鼠MAPK/ERK信号通路,也发现p-ERK1/2表达水平降低,认为p-ERK1/2减少可以影响大鼠的学习记忆[19]。
本研究发现,睡眠剥夺的第2天开始,大鼠海马组织内p-ERK1/2相对表达量明显低于对照组,并且随着睡眠剥夺时间的延长p-ERK1/2下降趋势更加明显,因此认为睡眠剥夺大鼠的学习记忆减退可能与ERK信号通路抑制有关。然而这项研究存在局限性,样本量相对较小,仅对该通路p-ERK1/2蛋白进行免疫印迹检测,在以后的研究中将检测该通路其他蛋白的变化,并通过免疫组织化学染色法进一步验证。
