小米糠黄酮对H2O2致HepG2氧化应激损伤的保护作用
2020-03-31郭增旺樊乃境田海芝王中江江连洲
郭增旺,樊乃境,田海芝,滕 飞,李 萌,李 杨,王中江,,江连洲,2,
(1.东北农业大学食品学院,黑龙江 哈尔滨 150030;2.山东禹王生态食业有限公司,山东 禹城 253000)
机体生长代谢过程中产生的自由基具有多种生理功能,如预防感染、激活细胞活性、传导信号等。但是过多的自由基能导致机体正常的细胞组织发生病变并引起氧化应激反应[1-2],并促进癌症、动脉粥样硬化和糖尿病等疾病的病理学发展[3-5]。因此,当机体受到外源性氧化物质攻击或内源性氧化损伤时,体内自由基产生和清除的动态平衡就会遭到破坏,从而会引起活性氧(reactive oxygen species,ROS)在体内堆积并产生细胞毒性作用[5-6]。自由基会氧化细胞膜、代谢酶系、蛋白质和DNA等物质,还会诱导细胞凋亡,对机体的细胞及器官造成损伤[7-8]。大量研究表明,通过膳食补充抗氧化成分能够调节机体内的自由基水平[9-11]和增强机体的防御能力,进而帮助维持机体的氧化动态平衡[12-16]。因此,开发具有清除自由基功能的食品和药物日益受到重视。
小米糠是谷子经过加工后的农副产物,占小米总质量的6%~8%。目前,我国小米年产量可达500万 t,加工小米将产生小米糠近40万 t,因此小米糠为一种产量较大的农副利用资源[17]。目前,小米糠主要被当作动物饲料进行处理,造成了巨大的资源浪费。小米糠富含蛋白质、脂肪、纤维素和维生素等,可以作为一种功能性的食品加工原料。Shan Shuhua等[18]从小米糠中提取得到一种新型FMBP蛋白,具有靶向抗结肠癌的作用。Bijalwan等[19]从小米糠中提取得到一种HCA-AXs功能性糖,具有较高的抗氧化活性。Balakrishnan等[20]将小米糠进行乳酸菌发酵制备乳酸,证实了小米糠可作为良好的乳酸加工原料进行工业化生产。研究表明,黄酮类化合物具有极佳的生理药理保健功能,具有抗氧化、抗肿瘤、延缓衰老、缓解炎性生物酶渗出,加速伤口愈合和止痛等功效[21],在食品、保健品、医药等各领域均有极其广阔的应用价值[22-23]。而小米糠中黄酮含量极为丰富,本课题组前期提取小米糠黄酮(flavonoids from millet bran,FMB)并通过体外实验评价了其抗炎活性,结果表明超声微波协同萃取得到的FMB具有体外抗炎活性[24]。但是关于FMB的抗氧化活性及其作用机制尚未明确。
为了系统准确地评价小米糠的抗氧化生物活性及其作用机制,本实验采用H2O2诱导HepG2细胞构建细胞氧化应激损伤模型,采用CCK-8检测细胞存活率,流式细胞仪检测胞内ROS水平,酶联免疫吸附测定法检测胞内抗氧化酶系活性,Western blotting法检测细胞凋亡通路蛋白表达量,以此评价FMB的抗氧化活性并探索其作用机理,从而为小米糠的功能性食品开发和抗氧化药物的研究提供理论依据。
1 材料与方法
1.1 材料与试剂
小米糠 河北冀州市盈润商贸有限公司。
FMB为实验室通过超声微波协同辅助萃取制得[24],纯度82.8%;人肝癌细胞HepG2 哈尔滨医科大学;DMEM高糖液体培养基、青霉素/链霉素 美国Hyclone公司;胎牛血清 浙江天杭生物科技有限公司;胰蛋白酶消化液 美国Gibco公司;磷酸盐缓冲液(phosphate buffered saline,PBS)、BCA蛋白质浓度测定试剂盒(增强型)、RIPA细胞裂解液、丙二醛(malondialdehyde,MDA)测定试剂盒、超氧化物歧化酶(superoxide dismutase,SOD)检测试剂盒、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)试剂盒、过氧化氢酶(catalase,CAT) 碧云天生物技术研究所;兔抗bax、p53、Caspase-3单克隆抗体、鼠抗Caspase-3单克隆抗体、辣根过氧化物酶标记的抗兔二抗、辣根过氧化物酶标记的抗鼠二抗 美国CST公司。
1.2 仪器与设备
CO2细胞培养箱、高速冷冻离心机 美国Thermo Fisher公司;多功能酶标仪 中国台北Welgene公司;FACS Calibur流式细胞仪 美国BD公司;EVOS荧光显微镜 美国Life Technologies公司;半干转膜仪、电泳槽、ChemiDoc XRS+化学发光成像系统 美国Bio-Rad公司;TS-2000A多用脱色摇床 海门市其林贝尔仪器制造有限公司。
1.3 方法
1.3.1 FMB的制备
参照课题组前期研究的方法[24],采用超声微波协同辅助萃取法提取FMB,具体工艺参数为超声微波时间0.87 h、乙醇体积分数77%、料液比1∶19和微波功率486 W。
1.3.2 细胞培养与分组
将HepG2细胞置于含有10%的胎牛血清、100 U/mL的青霉素、100 μg/mL链霉素的DMEM(高糖)培养基中,37 ℃、5% CO2的饱和湿度培养箱中培养,待细胞数量达到80%~90%后,吸去培养液,用PBS冲洗一次,加入1 mL胰蛋白酶消化3 min,进行传代培养,将处于对数生长期的细胞接种于培养板中培育4 h后,更换培养基除去未贴壁细胞,并对其进行分组[23]。正常对照组:不加FMB和H2O2干预处理,只加入等量的PBS溶液;氧化应激模型组:不加FMB干预,加入等量的PBS溶液培养24 h后,加入终浓度为2 mmol/L H2O2溶液刺激1 h;实验组:FMB低、中、高剂量组(FMB-L、FMB-M、FMB-H,终质量浓度分别为50、100、150 µg/mL)干预24 h后,加入终浓度为2 mmol/L H2O2溶液刺激1 h。
1.3.3 FMB对H2O2诱导HepG2细胞的存活率的测定
参照臧琳等[25]的方法,并略加改动。采用CCK-8法,按试剂盒说明书测定各组吸光度,细胞存活率按下式计算。

1.3.4 FMB对H2O2诱导HepG2细胞的胞内ROS水平的测定
参考Wang Wei等[26]的方法,并略加改动。选取对数生长期的HepG2细胞接种于6 孔板内,每孔体积2 mL,接种密度为1.0×105个/mL,置于37 ℃、5% CO2培养箱培养,按照1.3.2节分组方法处理细胞后,每孔加入终浓度10 μmol/L的DCFH-DA荧光探针,37 ℃避光反应20 min后吸去探针,用预冷的PBS洗涤细胞2 次,随后采用胰酶消化液消化细胞,离心除去上清液,PBS重悬细胞,并采用流式细胞仪测定活细胞的ROS相对强度。
1.3.5 FMB对H2O2诱导HepG2细胞的MDA水平的测定
参考刘艳等[27]的方法,并略加改动。选取对数生长期的HepG2细胞接种于6 孔板内,每孔体积2 mL,接种密度为1.0×105个/mL,置于37 ℃、5% CO2培养箱培养,按照1.3.2节分组方法处理细胞后,每孔加入100 μL细胞裂解液使细胞裂解,于4 ℃、1 600×g离心10 min,取上清液作为样本,参照试剂盒说明书对细胞内的MDA水平进行测定,单位为nmol/mL。
1.3.6 FMB对H2O2诱导HepG2细胞的胞内抗氧化酶系活力的测定
参照臧琳等[25]的方法,并略加改动。选取对数生长期的HepG2细胞接种于6 孔板内,每孔体积2 mL,接种密度为1.0×105个/mL,置于37 ℃、5% CO2培养箱培养,按照1.3.2节分组方法处理细胞后,用预冷PBS洗涤1 次,洗除PBS,刮下细胞转移到1.5 mL离心管中,离心弃上清液,加入细胞裂解液,4 ℃、12 000×g离心10 min。取上清液按照试剂盒说明书操作检测SOD、GSH-Px及CAT活力,余下部分采用BCA法进行蛋白质量浓度测定。
1.3.7 FMB对H2O2诱导HepG2细胞的胞内蛋白表达量的测定
参照Han等[28]的方法,并略加改动。选取对数生长期的HepG2细胞接种于6 孔板内,每孔体积2 mL,接种密度为1.0×105个/mL,置于37 ℃、5% CO2培养箱培养,按照1.3.2节分组方法处理细胞后,加入100 μL RIPA细胞裂解液提取细胞总蛋白,BCA法进行蛋白质量浓度测定,配制质量分数10%的分离胶和5%的浓缩胶,上样,恒压50、80、120 V电泳各30 min,半干法转膜,5%脱脂牛奶室温封闭1 h,一抗4 ℃孵育过夜,二抗室温孵育1 h,暗室中加发光染料底物混合物1 mL于膜上显色1 min,曝光显影,结果采用Image Lab软件进行定量分析处理。
1.4 数据统计分析
实验数据使用SPSS 19.0软件进行统计分析,用方差分析进行显著性检验,组间比较采用Tukey法来进行。实验数据采用平均值±标准差表示。
2 结果与分析
2.1 FMB对H2O2诱导HepG2细胞存活率的影响
细胞存活率是反映外界环境对细胞损伤程度的最直观指标。氧化应激的环境能导致胞内活性氧水平的升高,对HepG2细胞造成氧化损伤进而诱导细胞凋亡[29],其存活率的下降是氧化应激模型建立成功的标志之一。H2O2是一种重要的活性氧分子,性质相对稳定,常作为体外氧化应激损伤的造模药物,超氧阴离子自由基能使细胞膜上的脂质物质和蛋白发生氧化反应,还能与胞内的铁离子反应生成·OH等自由基,造成细胞氧化应激状态和组织损伤[28]。
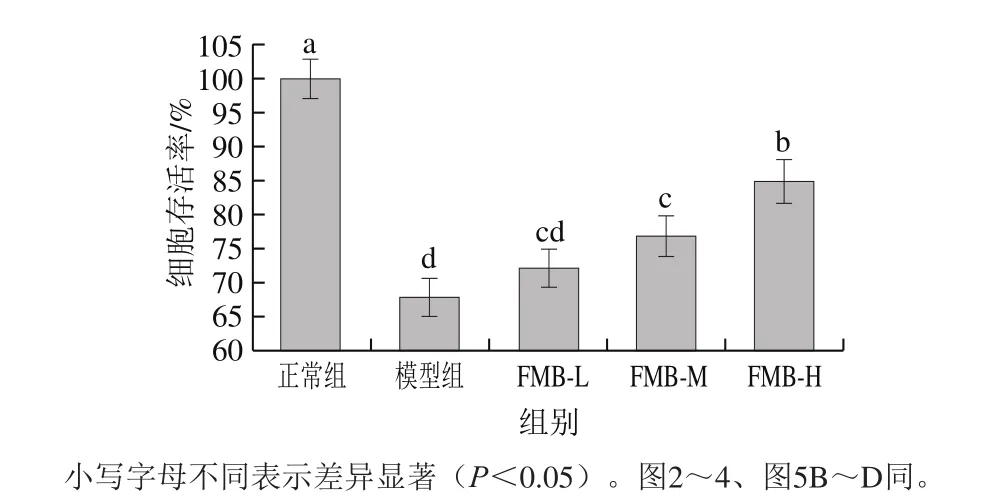
图 1 FMB对H2O2诱导HepG2细胞存活率的影响Fig. 1 Effect of FMB on viability of HepG2 cells with damage induced by H2O2
由图1可知,与正常组相比,H2O2构建的氧化应激模型组的细胞存活率显著下降(P<0.05),这表明氧化应激模型构建成功;与模型组相比,FMB中、高剂量组能显著提升细胞存活率(P<0.05),且呈现量效关系。这表明FMB对HepG2具有一定程度的保护作用,能缓解H2O2对HepG2的氧化应激损伤。
2.2 FMB对H2O2诱导HepG2胞内ROS含量的影响
ROS是细胞氧化系统中产生的含有ROS功能基团的化合物。正常细胞内的ROS的生成和清除处于动态平衡,适当的ROS可以促进机体巨噬细胞发挥其吞噬和酶解的免疫生理功能[30-31]。但是在外界刺激时,胞内清除ROS的调控作用机制失调,过多的ROS将会对细胞的细胞膜、蛋白质和核酸造成氧化损伤进而导致细胞凋亡[32]。
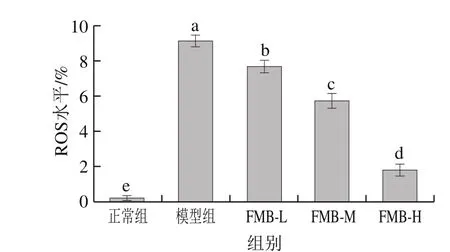
图 2 FMB对H2O2诱导HepG2胞内ROS水平的影响Fig. 2 FMB suppressed H2O2-induced ROS generation in HepG2 cells
由图2可知,与正常组相比,H2O2构建的氧化应激模型组的胞内ROS水平显著上升(P<0.05);与模型组相比,FMB-L、FMB-M、FMB-H组均能显著提升细胞存活率(P<0.05),且呈现剂量依赖性关系。这表明FMB能显著缓解H2O2所引起HepG2胞内ROS水平的升高,抑制ROS对细胞膜和胞内物质的氧化损伤,进而发挥抗氧化应激功能。
2.3 FMB对H2O2诱导HepG2的MDA水平的影响
机体存在天然的氧化调控系统,自身的抗氧化调节系统能抵抗一定程度的外界氧化应激刺激,避免外界对机体造成的损伤[33]。但是当氧化应激程度较为强烈并且机体的抗氧化系统不足以弥补调控时,首先会引起细胞膜上不饱和脂肪酸发生氧化反应,而MDA则是细胞膜被氧化后所生成的重要代谢产物,因此,MDA水平直接反映了细胞膜受到自由基氧化损伤程度[34]。
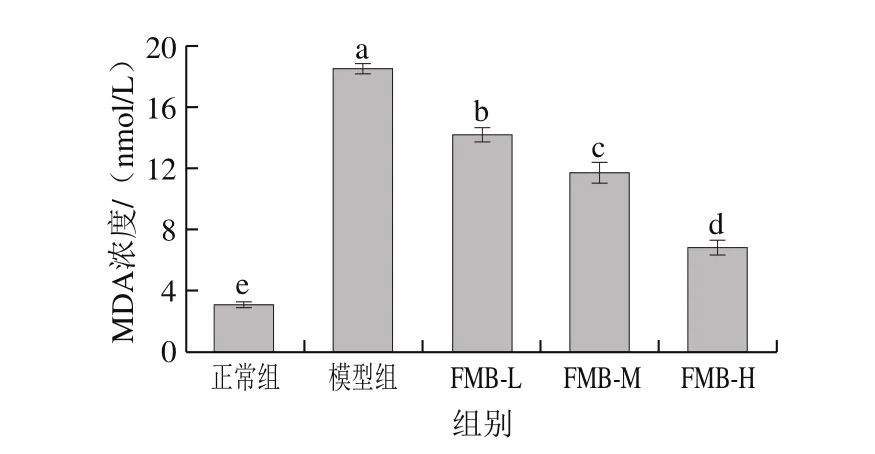
图 3 FMB对H2O2诱导HepG2细胞MDA浓度的影响Fig. 3 Effect of FMB on MDA content in HepG2 cells induced by H2O2
由图3可知,与正常组相比,H2O2构建的氧化应激模型组的胞内MDA浓度显著上升(P<0.05);与模型组相比,FMB-L、FMB-M、FMB-H组能显著降低胞内MDA浓度(P<0.05),且呈现剂量依赖性关系。这表明HepG2细胞经H2O2诱导后细胞膜发生严重损伤,而FMB能显著缓解活性氧对细胞膜脂质氧化损伤的影响,能减轻自由基对机体的氧化应激损伤。
2.4 FMB对H2O2诱导HepG2抗氧化物酶系活力的影响
机体自身存在酶抗氧化系统和非酶抗氧化系统抵御外界氧化应激刺激原[25]。SOD、CAT和GSH-Px是抗氧化酶系的重要组成部分。SOD、CAT是抵御氧化应激刺激的第一道防线,GSH-Px是机体内重要的过氧化物分解酶,能催化GSH和过氧化物还原成无毒的羟基化合物和氧化型谷胱甘肽,从而避免机体遭受过氧化物的损伤。机体的抗氧化物酶系在发挥抗氧化和维持氧化应激动态平衡中发挥了重要作用,其酶系活力直接反映出机体对外界氧化应激原的平衡调控水平[35-36]。
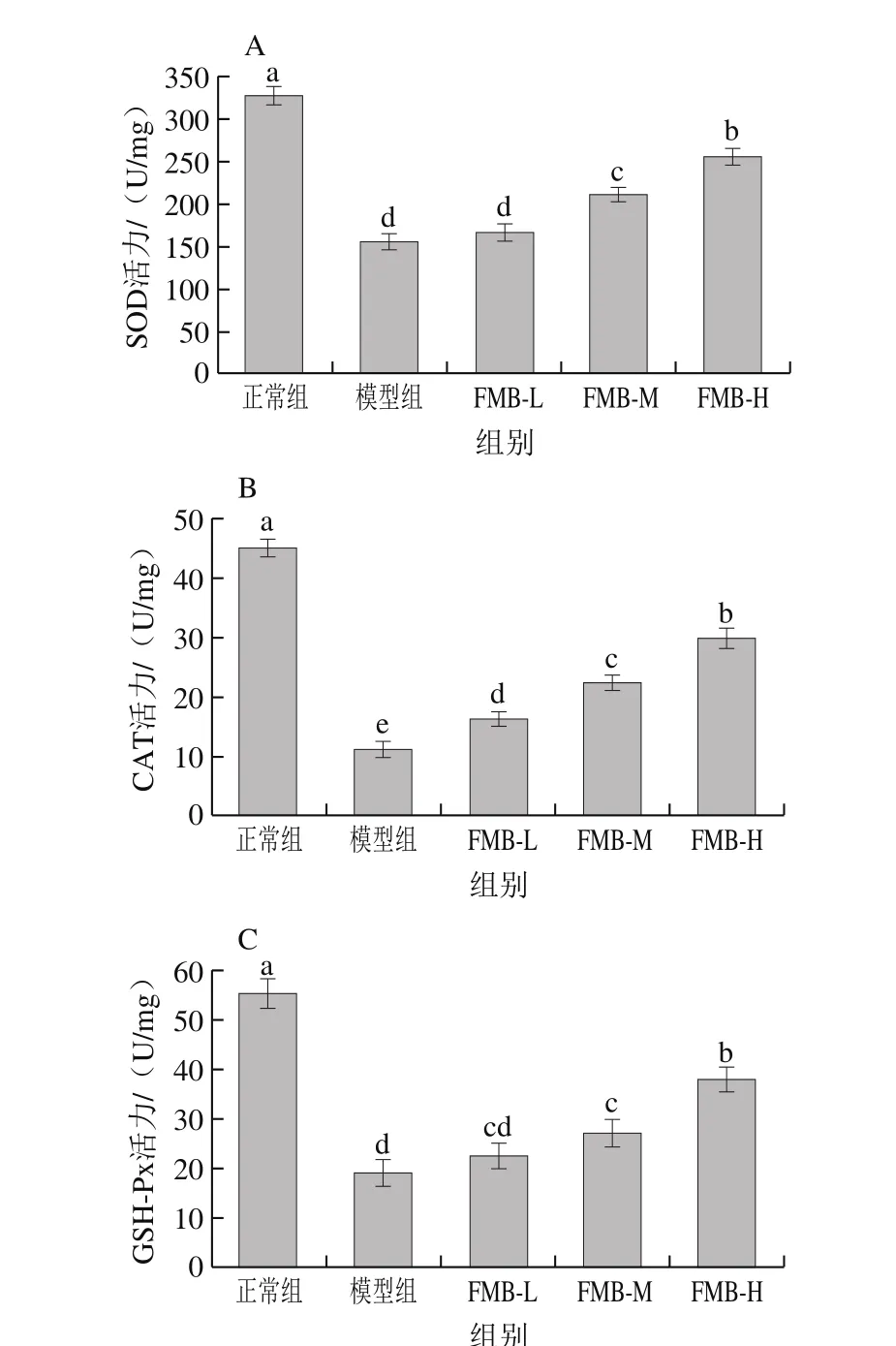
图 4 FMB对H2O2诱导HepG2细胞SOD(A)、CAT(B)、GSH-Px(C)活力的影响Fig. 4 Effect of FMB on SOD (A), CAT (B) and GSH-Px (C) activity in HepG2 cells induced by H2O2
由图4可知,与正常组相比,H2O2构建的氧化应激模型组的抗氧化物酶系活力显著降低(P<0.05);与模型组相比,FMB-L组的CAT活力显著升高,FMB-M和FMB-H组的SOD、CAT、GSH-Px活力显著升高。这表明该浓度下的H2O2能破坏细胞的氧化调节系统,降低胞内抗氧化酶系的活力,致使胞内的氧化动态平衡失衡和胞内MDA水平上升,导致细胞发生不可逆的氧化损伤;同时也表明氧化应激模型构建成功;而FMB预培养后能缓解H2O2造成的胞内抗氧化物酶系活力降低并且降低胞内MDA水平,对氧化应激损伤有保护作用,能提高机体对外界氧化应激的调控能力。这也和之前FMB能缓解H2O2所引起的细胞存活率降低和ROS水平上升的结果相一致。
2.5 FMB对H2O2诱导HepG2的凋亡信号通路影响
Caspases通路是所有细胞发生凋亡时都会被激活的通路,而Caspase-3是细胞发生凋亡的最终执行者,被激活后转化为能诱导凋亡的活性片段进入核内激活磷酸内切酶,进而使DNA裂解导致细胞凋亡[37]。而bax和p53是Caspase-3的上游蛋白,其中bax能调控线粒体凋亡通路,当bax被激活时能诱导线粒体凋亡通路的发生进而激活Caspase-3蛋白;p53主要介导DNA损伤后的细胞应激反应,可直接激活Caspase-3蛋白诱发细胞凋亡[38]。
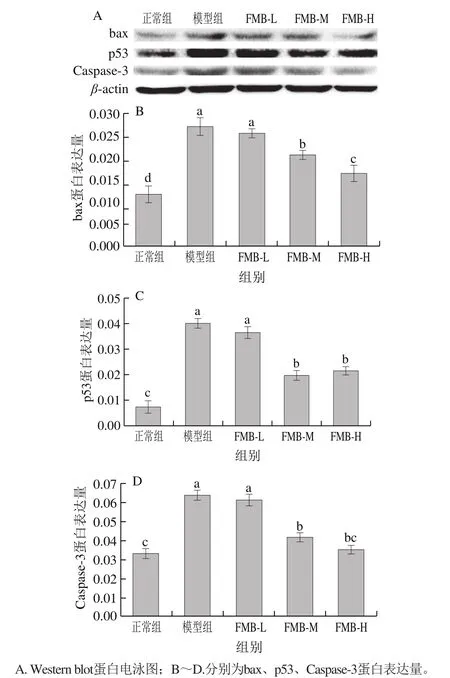
图 5 FMB对H2O2诱导HepG2的bax、p53、Caspase-3蛋白表达量的影响Fig. 5 Effect of FMB on expression of p53 and caspase-3 in HepG2 cells induced by H2O2
由图5可知,与正常组相比,H2O2构建的氧化应激模型组的bax、p53和Caspase-3蛋白的表达量均显著上升(P<0.05);与模型组相比,FMB-L组的p53和Caspase-3蛋白表达量显著下降(P<0.05),FMB-M和FMB-H组的bax、p53和Caspase-3蛋白显著下降(P<0.05)。结合前面实验结果可知,该浓度下的H2O2能使细胞存活率降低,并且使胞内凋亡蛋白bax、p53和Caspase-3表达量显著升高。bax凋亡蛋白的水平上升表示细胞的线粒体凋亡通路被激活,线粒体遭受到氧化应激损伤;p53凋亡蛋白的表达量上升代表DNA发生损伤后,细胞进行自我基因修复,当损伤不可修复时则激活Caspase-3凋亡蛋白的表达,而Caspase-3蛋白是细胞发生凋亡的最终执行者。这表明H2O2能激活细胞线粒体凋亡通路和Caspase-3凋亡通路,进而导致细胞存活率下降。而FMB能显著缓解H2O2所引起的HepG2胞内凋亡通路蛋白表达量的升高,表明FMB能通过协助细胞抵御氧化应激对线粒体和胞内DNA的伤害,缓解细胞的氧化应激损伤和提高机体氧化应激的调控能力。
当HepG2受到外界氧化应激原刺激后,会引起胞内活性氧水平的升高,使细胞膜脂质发生氧化反应并生成代谢产物MDA,胞内MDA水平的升高。为了抵御外界氧化应激原的刺激和维持细胞正常生存环境,机体的抗氧化物酶系会发挥调控功能,但当刺激程度过高时,抗氧化系统不足以补偿外界刺激,就会导致大量抗氧化物酶系酶活力降低和消耗,氧化动态平衡被破坏,导致膜通透性增强,并且对线粒体和胞内遗传物质DNA造成损伤,引起线粒体凋亡通路中bax蛋白和Caspase凋亡通路的p53蛋白、Caspase-3凋亡蛋白表达量升高,诱导其凋亡。而本研究结果显示,FMB能显著提高HepG2的存活率、降低MDA和胞内ROS水平、缓解H2O2所引起抗氧化物酶活力的降低和下调凋亡蛋白的表达。这和蔺曼[39]、刘国艳[40]和郑瑞芳[41]等的结果一致,但是不同物质提取的黄酮对各指标的响应值和抗氧化应激能力是不同的。这说明黄酮类化合物对氧化应激的调控能力和自身组成成分及含量有关,不同原料中存在多种黄酮单体组分,相互之间可能发挥协同或者是拮抗的作用。目前关于黄酮的氧化应激调控机制研究多集中在ERK和核因子κB等炎症通路[42],从线粒体凋亡通路和Caspase凋亡通路进行探究作用机制的研究还较少,仍需进一步深入研究。这表明,FMB能通过降低胞内ROS水平、提高过氧化酶系、增强细胞线粒体及DNA对外界氧化应激的抵御能力和抑制凋亡通路的激活进行增强机体对外界氧化应激的调控能力。
3 结 论
实验以FMB为研究对象,以H2O2诱导HepG2细胞构建氧化应激损伤模型,分别从细胞存活率、胞内ROS水平、MDA水平、抗氧化酶系活力和凋亡蛋白表达量探讨FMB对氧化应激损伤的修复作用。结果表明:FMB能显著缓解H2O2引起的HepG2细胞存活率的降低和胞内ROS、MDA水平的升高,恢复抗氧化酶系酶活力和下调bax、p53和Caspase-3凋亡蛋白的表达量。这表明FMB能通过抑制细胞凋亡通路蛋白的表达,调控细胞的氧化还原系统、清除胞内活性氧、提高胞内抗氧化酶系的活性,缓解氧化应激对机体所造成的损伤,增强机体对外界氧化应激的调控能力。
