呋喃西林代谢物酶联免疫吸附测定方法的建立及性能测定
2020-03-31徐冬梅李亚英李玉静
徐冬梅,李亚英,李玉静
(1.石家庄职业技术学院食品与药品工程系,河北石家庄050081;2.河北科技大学,河北石家庄050018;3.河北交通职业技术学院,河北石家庄050051)
呋喃西林(Nitrofurazone)是硝基呋喃类药物的一种,具有5-硝基呋喃母核[1],可抑制细菌DNA 和RNA合成,干扰菌体内酶代谢系统,能有效杀灭多种革兰氏阴性和阳性菌及某些真菌和原虫,曾被广泛应用于畜牧、水产养殖中[2]。然而,该类药物及其代谢物具有细胞诱变性、动物致癌毒性[3],通过食物链进入人体后会产生潜在危害,大部分国家已经禁止其在肉食中残留[4]。
呋喃西林在动物体内会被迅速代谢[5],不易检测,其代谢产物氨基脲(semicarbazide hydrochloride,SEM)能跟细胞内蛋白长期结合[6-8],存留较长时间,因此SEM 可作为呋喃西林残留的标识物。目前,呋喃西林代谢物的检测方法主要为色谱分析技术和免疫学分析技术。色谱技术主要为高效液相色谱法(high performance liquid chromatography,HPLC)、液相色谱-质谱联用法(liquid chromatography-mass,LC-MS)和液相色谱串联质谱法(LC-MS/MS)等,这些方法能随刻进行精确检测[9-11],有着灵敏和准确等优点,但仪器设备昂贵、操作繁琐、检测成本高,不适合现场批量检测,严重影响了对其非法使用的检测监管和风险预警。以酶联免疫吸附技术为代表的免疫分析方法具有灵敏准确、方便快捷、分析容量大、检测成本低等优点,可以实现对目标物进行现场批量快速定性定量分析,已成为目前最有效的初筛技术手段[12-17],广泛应用于动物源性食品中有毒有害物质的检测。
本研究以自制的SEM 抗原、抗体为基础原料[18],通过确定抗原和抗体使用浓度、抗原包被时间和温度、一抗和二抗作用时间等反应条件,建立间接竞争ELISA 检测方法,通过性能测定,该方法的灵敏度、准确度和精密度等参数均符合我国动物源性食品中兽药残留检测方法的有关规定,具有简便、快速、能批量检测等特点,能够应用于动物源性食品中呋喃西林代谢物的检测。影响该方法性能的因素有很多,如人工抗原的纯度、抗体的敏感性和特异性以及方法学的各项反应条件等[19-23]。本试验采用了自制的呋喃西林代谢物的人工抗原和单克隆抗体,人工抗原经透析等手段保证了纯度,单克隆抗体经鉴定具有很高的敏感性和特异性,从基础材料上有效保障了方法学的建立。通过进一步的试验,建立其酶联免疫吸附测定方法。
1 材料与方法
1.1 试剂
呋喃西林代谢物标准品:Sigma 公司;呋喃西林代谢物完全抗原SEM-OVA、呋喃西林代谢物单克隆抗体细胞株3D9:河北省科学院生物研究所细胞生化研究室研制;牛血清白蛋白(bovine serum albumen,BSA)、卵清白蛋白(ovalbumin,OVA)、胎牛血清:上海生物工程股份有限公司;HRP 标记山羊抗小鼠IgG:北京中杉金桥生物;其它试剂均为国产分析纯。
1.2 仪器设备
MULTIVAP 型氮吹仪:上海书俊仪器设备有限公司;ME54E 电子分析天平:METTLER 公司;液氮罐:成都金凤液氮容器有限公司;Allegra X-15R 高速冷冻离心机:德国BECKMAN 公司;DKB-8A 电热恒温水浴锅:上海精宏设备有限公司;ELX800 酶标仪:美国伯腾仪器有限公司Bio-TEK;XW-80A 漩涡混合器:上海医科大学仪器厂;96 孔酶标板:Costar 公司;微量移液器:Eppendorf 公司。
1.3 方法
1.3.1 ELISA 检测方法条件优化
1.3.1.1 抗原抗体工作浓度的确定
抗原、抗体采用方阵稀释法,横向包被梯度浓度的抗原,纵向加入倍比稀释的抗体,用间接酶联免疫吸附测定(enzyme linked immuno sorbent assay,ELISA)法进行测定,选择A450nm为1.0 左右时抗原和抗体浓度的组合作为理想工作浓度。
1.3.1.2 抗原包被时间及温度的选择
以确定的抗原、抗体浓度,分别设定包被条件为以下 6 种:4 ℃包被过夜、37 ℃孵育 0.5、1、2、3 h 和 4 h,分别检测其吸光度值,选择最佳包被时间和温度。
1.3.1.3 一抗作用时间的选择
一抗作用时间会影响到一抗和抗原的反应效果,因此需要通过试验来确定一抗与抗原的最佳作用时间。本试验选用一抗作用时间分别为10、20、30、45 min和60 min,通过线性关系选择最佳作用时间。
1.3.1.4 羊抗小鼠二抗作用时间的确定
羊抗小鼠二抗的孵育时间选用10、20、30、45 min和60 min 进行测定。
1.3.2 样品预处理
准确称取(1±0.05)g 均质样本于 50 mL 离心管中;加入4 mL 去离子水,0.5 mL 1 mol/L 盐酸溶液和100 μL 衍生化试剂工作液,充分振荡;在37 ℃过夜孵育(约16 h)或60 ℃水浴孵育 1.5 h;分别加入 5 mL 0.1 mol/L K2HPO4溶液,0.4 mL 1 mol/L NaOH 溶液和6 mL 的乙酸乙酯,充分振荡5 min;室温26 ℃下4 000 r/min,离心10 min;取出3 mL 的上层液到另一5 mL 离心管中,50 ℃~60 ℃水浴氮气吹干;用 2 mL 正已烷溶解残留物,再加入1 mL 复溶工作液充分振荡混合 30 s;室温 26 ℃ 4 000 r/min,离心 5 min;去除上层正己烷相以及两相(正己烷相和水相)之间的泡沫或者胶状物,取下层水相50 μL 样品进行检测。
1.3.3 ELISA 方法的性能测定
1.3.3.1 标准曲线的建立
按照优化的条件,在线性范围内绘制标准曲线,计算回归方程和R2,计算IC50值;重复测定,确定标准曲线的稳定性。
1.3.3.2 检测限测定
根据欧盟《动物源性食品中兽药残留检测方法》的规定,分别测定20 份鱼肉组织的空白样品,根据以上所述的方法对样品进行处理。用回归方程计算样品残留浓度,用SPSS 得出样品浓度的平均值(X)和标准差(SD),以X 加3 倍SD 值作为各样本的最低检测限。
1.3.3.3 准确度试验
采用样品添加回收试验检测该方法的准确度,在空白鱼肉样品中添加不同浓度的待测物,用间接竞争ELISA 方法检测。回收率计算如下:
回收率/%=实测浓度(μg/L)/添加浓度(μg/L)×100
1.3.3.4 精密度试验
精密度试验用变异系数来表示。
某日经过一家普通餐厅,便有心进去进餐。当他走进洗手间时,发现一张老旧却别致的桌子上放着一瓶鲜艳盛开的花,洗手间内干净整洁,一尘不染。他发现很多人洗手后会主动把台子擦干净。老板刚好进来,他便对老板说:“这花真漂亮!”老板得意地说:“知道吗?我在此摆鲜花已十余年了,你绝对想不到它为我省去多少清洁工作。”

式中:SD 表示标准偏差;X 表示平均值。
取5 个批次的组装试剂盒,测定鱼肉组织中添加不同浓度的待测物的变异系数。
1.3.3.5 ELISA 法与仪器方法的比较
选取鱼肉样本,用本试验确定的间接竞争ELISA法和农业部783 号公告-1-2006 中液相色谱-串联质谱法(LC-MS/MS)同时对样品进行检测,比较两种方法的符合性。
2 结果分析
2.1 抗原抗体最佳工作浓度的确定
对抗原抗体的最佳工作浓度的进行测定,结果如图1。

图1 SEM 不同抗原抗体浓度检测结果Fig.1 Different antigen antibody concentration detection results of SEM
随着包被浓度的降低,抑制曲线在上移,IC50值在上升,可能是抗原抗体的结合能力较差,需要比较高的作用浓度。综合考虑,选择线性较好的抗原浓度1 μg/mL、抗体稀释倍数 1 ∶1 万作为 SEM 的 ELISA 法最佳抗原抗体使用浓度。
2.2 包被时间及温度的确定
包被条件结果见图2。
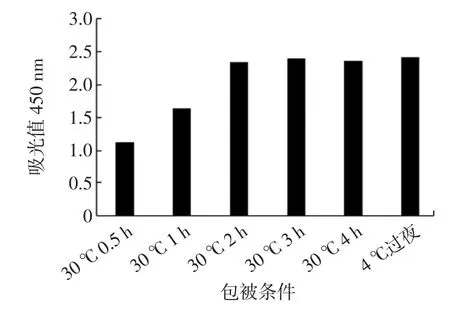
图2 最佳包被时间和温度的确定Fig.2 Determination of optimal packet time and temperature
结果表明,37 ℃ 0.5 h 所得 OD 值明显较低,到37 ℃2 h 后OD 值趋于稳定,且与4 ℃过夜的OD 值无明显差别,故确定37 ℃2 h 或4 ℃过夜为最佳包被条件。
2.3 一抗作用时间的优化
随着抗体和抗原作用时间的增加,抑制曲线呈上移趋势,综合反应时间和线性关系因素,选择30 min作为SEM 间接竞争ELISA 的一抗作用时间。
2.4 羊抗小鼠二抗作用时间的确定
对二抗作用的时间进行测定,结果如图4。

图3 SEM 不同的一抗作用时间结果Fig.3 Results of different action time of primary antibody
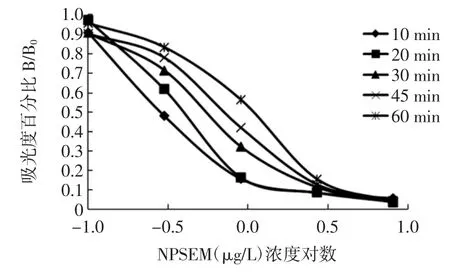
图4 SEM 不同的二抗作用时间结果Fig.4 Results of different action time of secondary antibody
随着作用时间的延长抑制曲线呈现上移,且线性范围在扩大,综合反应时间和线性关系,选择30 min作为SEM 间接竞争ELISA 的二抗作用时间。
2.5 标准曲线
将 6 个浓度的 SEM 标准溶液(0、0.03、0.09、0.27、0.81、2.43 μg/L),每个浓度重复 5 孔,按照间接竞争ELISA 法测定获得相应的吸光度值,计算抑制率B/B0(B0为标准品 0 μg/L 的吸光度值,B 为标准品不同浓度的吸光度值)。以B/B0为纵坐标,以标准品浓度的对数值为横坐标,绘制SEM 的抑制曲线。结果如图5。

图5 SEM ELISA 试剂盒标准曲线Fig.5 ELISA kit standard curve of SEM
SEM 的 ELISA 检测方法在 0.03 μg/L~2.43 μg/L范围内呈线性,线性方程为y=-0.335 1x+0.384 2(R2=0.992 7)。以线性最低点0.03 μg/L 作为该检测方法灵敏度。
2.6 检测限测定
对鱼肉组织、虾肉组织样本进行检测,结果如表1和表2 所示。

表1 鱼肉组织样本测定结果Table 1 Determination of fish tissue samples μg/kg

表2 虾肉组织样本测定结果Table 2 Determination of tissue samples from shrimp meat μg/kg
检测限分别为 0.236 μg/kg 和 0.229 μg/kg,根据实际检测情况将样本的最低检测限定为0.25 μg/kg。
2.7 试剂盒准确度及精密度测定
SEM 的ELISA 试剂盒测定鱼肉组织中添加回收试验,结果如表3 所示,样品回收率均在75%~120%之间,批内、批间变异系数均在15%以下,符合我国动物源食品中兽药残留检测方法的规定。
2.8 与仪器方法的对比试验
本试验用标准方法LC-MS/MS 和ELISA 方法同时测定样品中SEM 的含量见图6。两种方法用于鱼肉样本的检测,均呈现较好的相关性,R2为0.994 4。

表3 样品的变异系数及回收率Table 3 Coefficient of variation and recovery of samples

图6 LC-MS/MS 和ELISA 方法检测鱼肉样本中SEM 的相关性比较Fig.6 Correlation comparison between LC-MS/MS and SEM in fish samples
3 结论
本研究建立的检测方法在 0.03 μg/L~2.43 μg/L 范围内呈线性,线性方程为y=-0.335 1x+0.384 2(R2=0.9927),检测灵敏度为 0.03 μg/kg,鱼肉组织样本、虾肉组织样本的检测限分别为0.236、0.229 μg/kg,回收率均在75%~120%之间,批内、批间变异系数均在15 %以下,通过与标准方法LC-MS/MS 对比验证,两种方法用于鱼肉样本的检测均呈现较好的相关性,相关系数R2为0.994 4。本研究建立的呋喃西林代谢物酶联免疫吸附测定方法的灵敏度、准确度和精密度等参数均符合我国动物源性食品中兽药残留检测方法的规定,具有灵敏准确、方便快捷、分析容量大、检测成本低等优点,适合动物源性食品中呋喃西林代谢物的检测。
