电针干预豚鼠膜迷路积水的参数优选及其对耳蜗AQP2表达的影响
2020-03-31史莹莺叶恬恬杨俊文江鲁红蒋丽元
史莹莺 朱 敏 叶恬恬 杨俊文 江鲁红 蒋丽元
1.杭州市丁桥医院 杭州 310022 2.杭州市中医院 3.浙江中医药大学第一临床医学院4.新疆维吾尔族自治区阿克苏市人民医院
梅尼埃病 (Meniere’s disease,MD)以发作性眩晕、听力下降、耳鸣、耳闷胀感为典型临床表现,是耳源性眩晕最常见的原因[1]。研究已经证实,MD的病理基础是内耳膜迷路积水[2]。膜迷路积水的改善是缓解MD临床症状的关键。临床实践表明,用电针治疗MD具有较好疗效,能改善前庭及内耳功能,缓解眩晕、耳鸣症状[3]。笔者在前期研究中经动物实验证实,电针能显著减轻耳源性眩晕豚鼠膜迷路积水,并且改善耳蜗听功能[4],与电针治疗MD的临床效果一致。
电针刺激频率是影响电针疗效的重要参数之一。目前关于电针治疗MD刺激参数的研究较少,电针频率的选择尚缺乏统一标准。文献报道,电针在镇痛方面具有频率依赖性[5]。研究已经证实电针可减轻膜迷路积水,但关于电针对膜迷路积水的调节作用是否也存在频率选择性的问题,至今尚未见于报道,而且电针减轻膜迷路积水的机制目前也不明确。本研究在血管加压素诱导的膜迷路积水模型上,以听性脑干反射(auditory brainstem response,ABR)反应阈值、耳蜗病理形态学为主要指标,观察不同频率电针刺激“百会”“听宫”穴对豚鼠膜迷路积水的改善作用,筛选出最佳电针频率参数,并通过检测耳蜗水通道蛋白2(aquaporin 2,AQP2)的表达变化,初步探讨电针治疗MD的可能机制。
1 材料和方法
1.1实验动物及分组 清洁级健康雄性白色红目豚鼠48只,体质量350~400g,耳廓Preyer反射灵敏,无眼震、无前庭功能异常表现,由浙江中医药大学动物实验研究中心提供并饲养 [实验动物使用许可证号:SYXK(浙)2013-0184]。实验中对动物的所有处置均符合2006年国家科技部颁布的《关于善待实验动物的指导性意见》中相关规定。将豚鼠以完全随机法分为空白组、模型组、假电针组、2Hz电针组、15Hz电针组和100Hz电针组,每组8只。
1.2试剂与仪器 醋酸去氨加压素购于海南中和制药股份有限公司(批号:20170701);AQP2多克隆抗体购于Santa Cruz公司(批号:Y-B1-07C17B);DAB显色试剂盒购于武汉谷歌生物科技有限公司 (批号:20180419)。华佗牌无菌针灸针购于苏州医疗用品有限公司(规格:0.30mm×13mm);HANS-100A型韩式镇痛电针仪为南京医疗仪器厂产品。
1.3豚鼠膜迷路积水模型的建立与评价 除了空白组,其余各组参照文献[6]采用腹腔注射醋酸去氨加压素的方法建立膜迷路积水模型,先按4μg/(kg·d)剂量连续给药7d,第8天将注射剂量加大为6μg/(kg·d),连续3d,共给药10d。第11天起开始实施干预措施。豚鼠膜迷路积水模型的评价以耳蜗病理切片HE染色观察结果为标准[7]。
1.4干预方法 空白组常规饲养,不予治疗,10d后观察各项指标。模型组造模完成后每日与各治疗组动物采取相同固定方法及时间,不予其它治疗,10d后观察各项指标。各电针组造模后开始行电针治疗,以一次性不锈钢毫针于“百会”穴向前平刺2mm,左侧“听宫”穴直刺3mm,接HANS-100A型韩式镇痛电针仪,输出电流1mA,留针20min,1次∕d,连续治疗10d。2Hz电针组、15Hz电针组、100Hz电针组刺激频率分别为2、15、100Hz。穴位选择参照《实验针灸学》[8],于动物颅顶骨正中处选取“百会”穴,于侧面部耳屏正前方凹陷处选取“听宫”穴。假电针组予针刺“百会”穴和左侧“听宫”穴,但不通电,其余处理同电针组。各组每日于相同时间点进行干预,取材当日不行干预措施。
1.5检测指标
1.5.1ABR反应阈值检测 干预结束次日,以10%水合氯醛按300mg/kg的剂量腹腔注射麻醉豚鼠,采用听觉脑干诱发电位仪对各组豚鼠进行ABR反应阈值检测,评估实验侧耳听力水平。
1.5.2组织学指标 各组豚鼠麻醉状态下快速开胸,充分暴露心脏,以4%多聚甲醛(pH=7.2)灌注,打开左侧听泡,分离颞骨,以4%多聚甲醛固定液固定过夜后,置于10%乙二胺四乙酸(pH=7.4)中,室温下脱钙约3周,梯度乙醇脱水,二甲苯透明,石蜡包埋。沿耳蜗蜗轴中央平面行4.5μm切片,再分别进行HE染色和免疫组化检测。
1.5.2.1HE染色 切片常规脱蜡入水、烤片、梯度乙醇脱水,行HE染色、封片后,光镜下观察耳蜗形态,运用Image Pro Plus 6.0图像采集分析系统分别测量耳蜗中轴左右两侧第二转蜗管横截面积及前庭阶横截面积,并计算出比值(R值),R值=蜗管横截面积/(蜗管横截面积+前庭阶横截面积),耳蜗中轴两侧取平均值。
1.5.2.2免疫组化DAB染色 切片经脱蜡、水化、抗原修复后滴加一抗,洗涤后再加入二步法免疫组化试剂,行DAB显色、苏木精复染、脱水、透明后封片。光镜下观察AQP2表达情况,运用Image Pro Plus 6.0图像采集分析系统对结果进行分析,检测耳蜗中轴左右两侧第二转外侧壁AQP2的表达,对AQP2积分光密度(integrate optical density,IOD)值进行测量,两侧取平均值。
1.6统计学分析 应用SPSS 17.0统计软件进行统计学分析,计量资料以±s表示。多组间比较采用单因素方差分析,两两比较采用LSD-t法。以P<0.05为差异有统计学意义。
2 结果
2.1各组豚鼠ABR反应阈值比较 各组豚鼠ABR反应阈值比较,差异无统计学意义(F=0.646,P>0.05)。见表1。
表1 各组豚鼠ABR反应阈值比较(±s,dB nHL)Tab.1 Comparison of ABR threshold in each group(±s,dB nHL)

表1 各组豚鼠ABR反应阈值比较(±s,dB nHL)Tab.1 Comparison of ABR threshold in each group(±s,dB nHL)
组别 豚鼠耳数(只) ABR反应阈值空白组 8 8.75±3.54模型组 8 10.63±4.17假电针组 8 12.50±2.67 2Hz电针组 8 9.38±6.78 15Hz电针组 8 8.75±5.82 100Hz电针组 8 9.38±6.23
2.2各组豚鼠耳蜗R值及形态比较 各组R值比较差异具有统计学意义(F=6.770,P<0.01)。与空白组比较,模型组豚鼠耳蜗R值增加(P<0.01);与模型组比较,各治疗组豚鼠耳蜗R值均降低(P<0.01,P<0.05);与假电针组比较,100Hz电针组R值降低,差异有统计学意义(P<0.01),2Hz电针组、15Hz电针组R值均较假电针组降低,但差异均无统计学意义(P>0.05)。各电针治疗组组间比较,100Hz电针组R值低于2Hz电针组、15Hz电针组,差异有统计学意义 (均P<0.05);而2Hz电针组、15Hz电针组比较差异无统计学意义 (P>0.05)。见表2。
空白组均未出现膜迷路积水,前庭阶、鼓阶、蜗管结构无异常;模型组出现膜迷路积水,表现为前庭膜向前庭阶方向不同程度的隆起扩张;各电针组前庭膜隆起程度均较模型组不同程度减轻;100Hz电针组前庭膜隆起程度轻于2Hz电针组和15Hz电针组,2Hz电针组、15Hz电针组前庭膜隆起程度无明显差异。见图1。
表2 各组豚鼠耳蜗R值比较(±s)Tab.2 Comparison of R values of the cochlea in each group(±s)

表2 各组豚鼠耳蜗R值比较(±s)Tab.2 Comparison of R values of the cochlea in each group(±s)
注:与空白组比较,**P<0.01;与模型组比较,▲P<0.05,▲▲P<0.01;与假电针组比较,##P<0.01;与 2Hz电针组比较,▼P<0.05;与 15Hz电针组比较,ΔP<0.05Note:Compared with blank group,**P<0.01;compared with model group,▲P<0.05,▲▲P<0.01;compared with sham EA group,##P<0.01;compared with 2Hz EA group,▼P<0.05;compared with 15Hz EA group,ΔP<0.05
组别 豚鼠耳数(只) R值空白组 8 0.29±0.04模型组 8 0.49±0.06**假电针组 8 0.42±0.06▲2Hz电针组 8 0.40±0.10▲15Hz电针组 8 0.39±0.07▲▲100Hz电针组 8 0.32±0.06▲▲##▼Δ
2.3各组豚鼠耳蜗AQP2表达比较 各组AQP2 IOD值比较差异具有统计学意义 (F=5.239,P<0.05)。与空白组比较,模型组豚鼠耳蜗AQP2 IOD值增加(P<0.01);与模型组比较,各治疗组豚鼠耳蜗AQP2 IOD值均降低(P<0.01,P<0.05);各治疗组间比较,100Hz电针组AQP2 IOD值低于假电针组、2Hz电针组和15Hz电针组,但差异均无统计学意义(P>0.05)。见表3、图2。
3 讨论
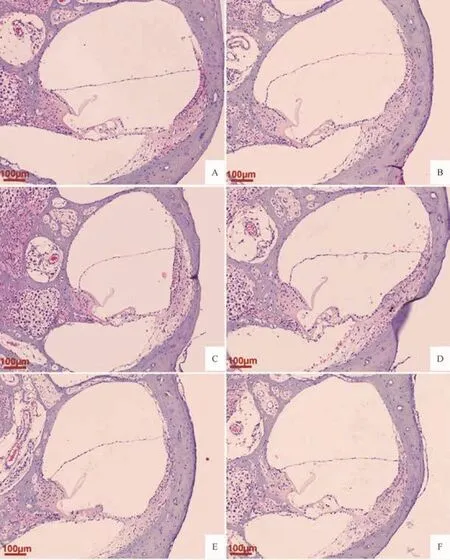
图1 各组豚鼠耳蜗形态变化(HE染色,50×)Fig.1 Morphologic changes of the cochlea in each group(HE staining,50×)
表3 各组豚鼠耳蜗AQP2表达比较(±s)Tab.3 Comparison of AQP2 expression of the cochlea in each group(±s)

表3 各组豚鼠耳蜗AQP2表达比较(±s)Tab.3 Comparison of AQP2 expression of the cochlea in each group(±s)
注:与空白组比较,**P<0.01;与模型组比较,▲P<0.05,▲▲P<0.01Note:Compared with blank group,**P<0.01;compared with model group,▲P<0.05,▲▲P<0.01
组别 豚鼠耳数(只) IOD值空白组 8 6.70±1.23模型组 8 13.50±4.69**假电针组 8 7.19±1.92▲▲2Hz电针组 8 8.11±2.92▲▲15Hz电针组 8 9.54±4.74▲100Hz电针组 8 6.64±2.29▲▲
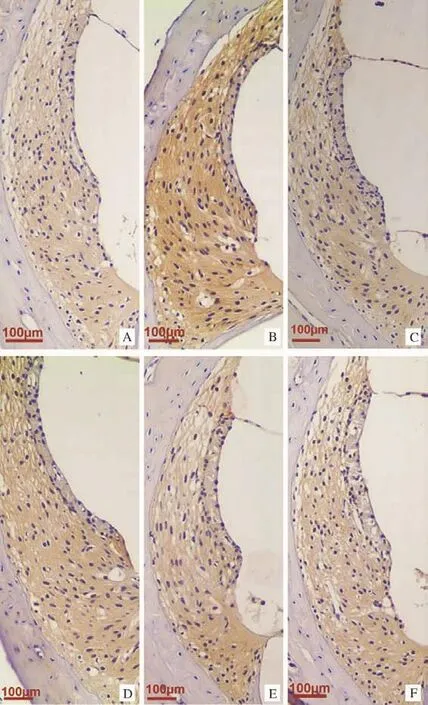
图2 各组豚鼠耳蜗组织AQP2表达情况(DAB染色,100×)Fig.2 AQP2 expression of the cochlea in each group(DAB staining,100×)
中医学并无“MD”病名,现多将MD引起的眩晕归入“耳源性眩晕”。本虚标实为MD眩晕的基本病机,因此临床对该病的治疗多以补益为主。《灵枢·海论》有“髓海不足,则脑转耳鸣”的记载,故临床治疗眩晕首选与脑髓有关的穴位。百会归属督脉,别名“三阳五会”,为手足三阳、督脉之会,具有补益脑髓、平肝息风、开窍止眩的功效,为治眩晕要穴。MD病位在耳,听宫为手太阳小肠经穴,位于耳廓前,手太阳小肠经“却入耳中”;听宫又为手足少阳、手太阳之交会穴,内通心、脑及肝胆之气,针刺听宫可疏利肝胆之气,宣通耳窍,多用于内耳疾病的治疗。临床上常以百会配伍听宫,针灸治疗内耳眩晕症[9]。本研究结果显示,针刺“百会”“听宫”穴能显著减轻豚鼠膜迷路积水程度,与课题组前期研究结果相符[4,10]。
膜迷路积水导致的听力变化多与前庭膜破裂后内外淋巴液混合引发的耳蜗电生理改变有关。耳蜗电位是实现听力功能的基础。膜迷路积水时由于内淋巴液容量急剧增加,引起前庭膜过度膨胀直至破裂,高K+、低Na+的内淋巴液与高Na+、低K+的外淋巴液混合,内耳内环境紊乱,引起耳蜗电位下降,电活动受抑制,导致听力下降。同时,外淋巴液K+浓度迅速升高,使毛细胞发生持续去极化,电压依赖性钙通道持续开放,内淋巴液及毛细胞发生钙超载,同样导致耳蜗电位下降,内耳听功能受损,最终出现听力下降[11]。本研究中HE染色病理切片观察证实,通过血管加压素腹腔注射诱导的膜迷路积水动物模型并无前庭膜的破裂,可能是ABR反应阈值未发生变化的原因之一。长时间血管加压素处理后的膜迷路积水动物模型的ABR反应阈值变化情况,尚未见于文献报道,仍有待进一步系统深入研究。
研究证实,与耳部疾病相关的大脑区域存在着神经元代谢异常的现象。李小圳等[12]研究发现,MD发作期与间歇期患者均存在静息态双侧海马区域功能连接差异,针刺穴位可激活有功能连接的多个脑区,从而发挥治疗作用。动物实验表明,电针刺激听觉相关腧穴对经络有特异性激发作用,使听皮层局部神经细胞葡萄糖代谢水平增加,增强其生理活动[13]。电针的不同频率是影响针刺效应的关键因素。本次研究中,采用不同频率电针干预膜迷路积水豚鼠,结果显示假电针、2、15、100Hz电针均有良好的治疗作用。各治疗组间比较,100Hz电针疗效最佳,提示高频电针对豚鼠膜迷路积水的改善更为显著。近年来研究发现,高频电针能够治疗神经系统、循环系统、内分泌系统等多系统疾病,因而在临床上广泛应用[14]。高频电针治疗急性心肌梗死并发心力衰竭,能够升高血压,降低患者死亡率[15];还可以调节缺血再灌注大鼠血管活性物质含量[16]。研究还证实,高频电针可以调节中枢和外周血清中神经递质和神经肽类物质如γ-氨基丁酸、内源性胆囊收缩素、星形胶质细胞脑源性神经营养因子(brain-derived neurotrophic factor,BDNF)等的合成和分泌,从而起到镇痛和神经系统保护作用[17-18]。而关于何种频率的电针治疗MD效果最佳,其具体机制如何,还鲜见于文献报道。
目前认为,膜迷路积水发生与内耳水通道蛋白的表达及功能失调有关[19]。现已发现的13个水通道蛋白亚型中,AQP2在内耳中的作用研究较为深入。AQP2是血管加压素调节的靶蛋白,引起内耳AQP2表达改变的调节方式与肾脏集合管相同,血管加压素与内耳血管加压素受体2结合后,通过环磷酸腺苷介导的磷酸化作用引起AQP2表达增加及立体结构改变,使水通道开放增加,内淋巴液增多[20]。课题组前期研究结果表明,AQP2主要表达于耳蜗血管纹,注射血管加压素可引起血管纹AQP2表达增加,针刺可下调血管纹处AQP2表达[21]。本研究结果表明,电针及假电针干预均可使模型组豚鼠耳蜗外侧壁AQP2表达下调。电针刺激可能通过调控血管加压素-AQP2系统,使耳蜗AQP2表达下调,水通道开放减少,抑制外淋巴液向内淋巴液流动,从而减轻膜迷路积水。
综上所述,本研究发现不同频率的电针针刺“百会”“听宫”穴均能减轻豚鼠膜迷路积水,其中100Hz电针效果最佳。电针治疗减轻膜迷路积水的机制可能与下调耳蜗AQP2的表达有关。
