甲状腺微小乳头状癌常规超声特征及剪切波弹性成像定量参数与中央区淋巴结转移的关系
2020-03-30樊秀齐薛继平李慧展李婷婷康春松
樊秀齐 薛继平 李慧展 李婷婷 康春松
甲状腺微小乳头状癌(papillarythyroidmicrocarcinoma,PTMC)是指原发癌灶最大径≤10 mm 的甲状腺乳头状癌(papillary thyroid carcinoma,PTC),其恶性程度低、预后好,但其中30%~65%的患者会发生颈部淋巴结转移[1-2]。因此,术前准确预测是否有中央区淋巴结转移至关重要。对于PTMC 患者是否需预防性行中央区淋巴结清扫仍存在争议。PTMC 常规超声特征与颈部淋巴结转移之间的关系已有较多研究[3-5]报道,关于剪切波弹性成像(shear wave elastography,SWE)预测PTMC 颈部淋巴结转移尚处初步研究阶段。本研究探讨PTMC 常规超声特征及SWE 定量参数对中央区淋巴结转移的预测价值,旨在为临床手术方式的精准选择提供理论依据。
资料与方法
一、研究对象
选取2018 年2 月至2019 年3 月经我院手术病理证实的102 例PTMC 患者,术中均行中央区淋巴结清扫,术前均行常规超声及SWE 检查,且影像资料保存完整。男36 例,女66 例,年龄24~58 岁,平均(45.0±10.3)岁;单发灶60 例,多发灶42 例,共116 个病灶;病灶直径0.2~1.0 cm,平均(0.634±0.179)cm;其中淋巴结转移者36 例(转移组),46 个结节;无中央区淋巴结转移者66例(未转移组),70个结节。排除无病理结果、图像质量差及不能确定是否为PTMC 转移淋巴结的病灶。本研究经我院医学伦理委员会批准,所有患者均签署知情同意书。
二、仪器与方法
1.仪器:使用法国声科Supersonic Imagine Aixplorer彩色多普勒超声诊断仪,SL15-4 线阵探头,频率4~15 MHz,配备SWE功能;百胜MyLab Twice彩色多普勒超声诊断仪,LA435线阵探头,频率8~15 MHz。
2.常规超声检查:患者取仰卧位,充分暴露颈部,平静呼吸,常规多方位、多角度扫查甲状腺及颈部淋巴结,存储各结节纵横切面二维及彩色多普勒图像。由两名高年资超声医师对存储图像进行分析并记录:结节数量(是否为多发灶)、位置、大小、结节最大径、纵横比(<1、≥1)、形态(规则、不规则)、边缘(光整、不光整)、是否侵犯被膜、回声(低回声、等高回声)、钙化(无钙化、微钙化、粗大钙化)[6]及血流状态(Alder 分级[7]0级、Ⅰ级、Ⅱ级、Ⅲ级)等。意见不一致时请第三名高年资医师介入诊断。
3.SWE 检查:启用SWE 模式,调节取样框大小,使其覆盖甲状腺结节及其周围部分甲状腺组织,探头轻放不加压,嘱患者屏气,待图像稳定后,冻结图像,采用Q-BOX测量感兴趣区内病灶的杨氏模量值,尽量避免钙化灶;覆盖病灶中硬度较高的部分。系统自动显示病灶的杨氏模量最大值(Emax)、最小值(Emin)及平均值(Emean)。
三、统计学处理
结 果
一、两组杨氏模量值比较
两组Emax、Emean 比较差异均有统计学意义(均P=0.000),Emin 比较差异无统计学意义(P=0.053)。见表1和图1,2。
表1 转移组与未转移组杨氏模量值比较(±s) kPa
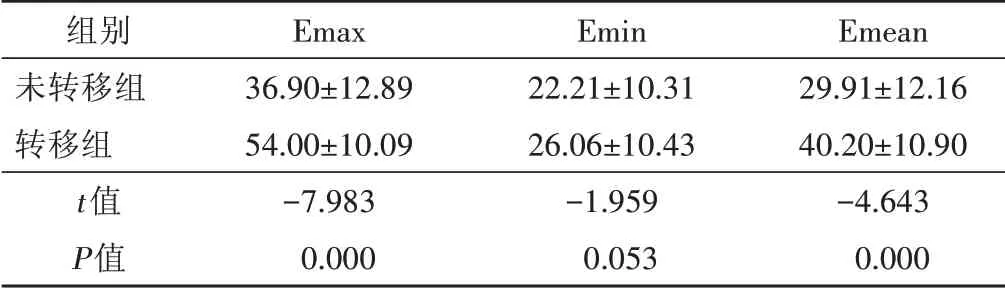
表1 转移组与未转移组杨氏模量值比较(±s) kPa
Emax、Emin、Emean:杨氏模量最大值、最小值及平均值
组别未转移组转移组t值P值Emax 36.90±12.89 54.00±10.09-7.983 0.000 Emin 22.21±10.31 26.06±10.43-1.959 0.053 Emean 29.91±12.16 40.20±10.90-4.643 0.000
二、ROC 曲线评估杨氏模量值对PTMC 有无中央区淋巴结转移的价值
Emax 判断PTMC 有无中央区淋巴结转移的曲线下面积为0.851,以43.35 kPa 为截断值,诊断敏感性、特异性分别为87.0%、72.9%;Emean 的曲线下面积为0.752,以30.15 kPa 为截断值,诊断敏感性、特异性分别为78.3%、61.4%。见图3。故单因素分析时,选取曲线下面积大的Emax。
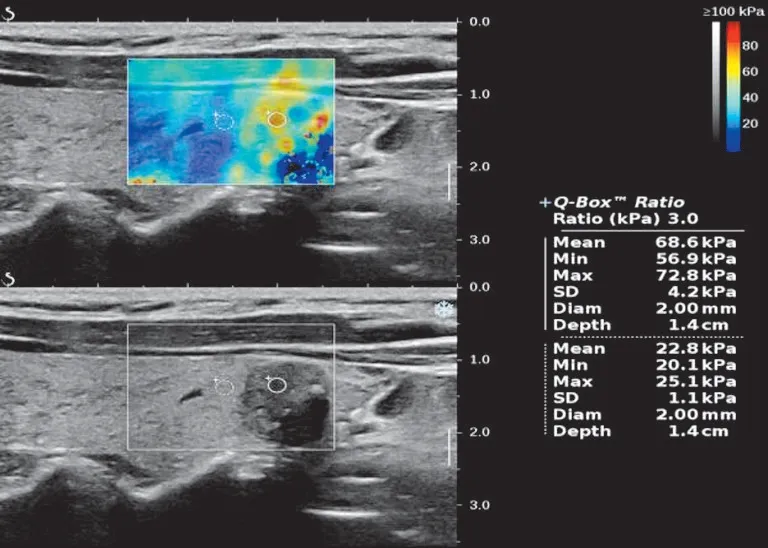
图1 转移组SWE 图,甲状腺左叶下极可见一大小0.9 cm×0.9 cm实性结节,Emax为72.8 kPa

图2 未转移组SWE 图,甲状腺右叶下极可见一大小0.7 cm×0.5 cm 实性结节,边界不清,形态不规则,Emax为26.7 kPa
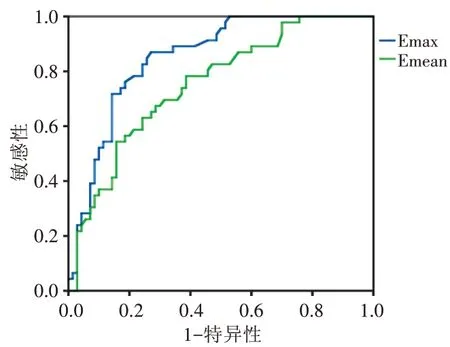
图3 杨氏模量值预测PTMC中央区淋巴结转移的ROC曲线图
三、PTMC超声特征的单因素分析
转移组与非转移组是否多发灶、边缘、形态、钙化类型、是否侵犯被膜,以及Emax>43.35 kPa 者比较差异均有统计学意义(均P<0.05)。两组PTMC 位置、回声、纵横比、血流信号分级情况比较差异均无统计学意义。见表2和图4。
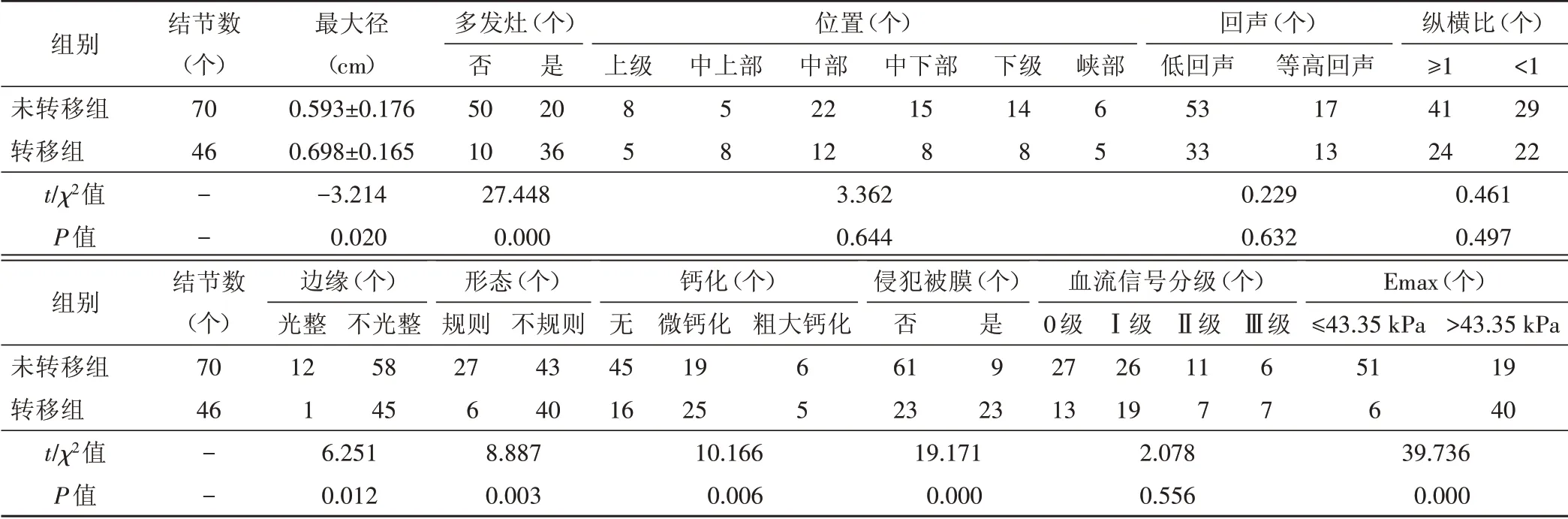
表2 PTMC超声特征与中央区淋巴结转移的单因素分析结果

图4 转移组二维超声图像,甲状腺左叶可见多发实性结节,均边界不清,形态不规则,下极者侵犯被膜
四、PTMC超声特征的Logistic回归分析
对以上六项差异有统计学意义的特征进行Logistic 回归分析,结果显示多发灶、侵犯被膜及Emax>43.35 kPa 是PTMC 患者发生中央区淋巴结转移的独立危险因素(均P<0.05),其中Emax>43.35 kPa 的OR值最大,为16.684。见表3。

表3 PTMC超声特征与中央区淋巴结转移的Logistic分析结果
讨 论
近年来,随着超声影像学与穿刺细胞学技术的不断发展,PTMC的检出率逐年增加。虽然PTMC恶性程度低,但部分PTMC 表现为高侵袭性特征。因此探讨PTMC 中央区淋巴结转移的相关因素对临床具有重要指导意义。SWE 技术是一种新型弹性成像技术,可定量评价组织硬度,被广泛应用于甲状腺良恶性结节的诊断及鉴别诊断中。
本研究结果显示,PTMC 中央区淋巴结转移组与未转移组杨氏模量值Emax、Emean 比较,差异均有统计学意义(均P<0.05),Emin 组间比较差异不明显。Park 等[8-9]应用SWE 预测363 例PTC 患者颈部淋巴结转移,结果显示Emax、Emean 与中央区淋巴结转移相关,其结果与本研究一致。本研究将PTMC 病灶杨氏模量值与中央区淋巴结转移情况绘制成ROC 曲线,得出Emax、Emean 曲线下面积分别为0.851、0.752,诊断截断值分别为43.35 kPa、30.15 kPa,其敏感性、特异性分别为87.0%、72.9%和78.3%、61.4%;表明杨氏模量值预测PTMC 患者中央区淋巴结转移有一定意义,故Emax 的曲线下面积、敏感性及特异性均较Emean 高,Emax 预测PTMC 中央区淋巴结转移的价值更大。当术前SWE 检查提示PTMC 病灶Emax>43.34 kPa 时,发生中央区淋巴结转移的可能性增大。目前,对于甲状腺癌病灶硬度与淋巴结转移之间关系的原理尚未阐明,有研究[10-11]报道细胞外基质交联是癌细胞生物学的重要组成部分,其与组织纤维化中的组织硬化有关。组织纤维化通过调节诱导炎症和血管生成并刺激细胞生长和侵袭的可溶性因子来影响肿瘤进展[12],肿瘤细胞增殖和组织纤维化可能影响肿瘤硬度和侵袭性,包括淋巴结转移。
本研究转移组多发灶PTMC 比例为78.3%,未转移组多发灶PTMC 比例为28.6%。单因素和多因素分析均显示多发灶PTMC 与中央区淋巴结转移显著相关。Baudin 等[13]研究显示,病灶数目是PTMC 预后不良的相关因素,主要表现为颈部淋巴结转移;Park等[14]研究表明多发灶是PTMC 颈部淋巴结转移的独立危险因素(P=0.020),本研究均与其结果一致。多灶癌的发生可能是癌灶在腺体内播散导致的,这可能与其更易发生中央区淋巴结转移有关[15]。
PTMC 恶性程度虽然低,但也可呈侵袭性生长,当肿瘤侵犯被膜时,容易发生淋巴结转移。本研究单因素分析和多因素Logistic回归分析均表明,被膜侵犯是预测中央区淋巴结转移的独立危险因素。美国甲状腺协会发布的指南[16]建议,术前检查发现侵犯甲状腺被膜的PTMC 应预防性行中央区淋巴结清扫。Chow等[17]研究也发现甲状腺被膜侵犯是亚临床中央区淋巴结转移的独立危险因素。本研究经Logistic 回归分析结果表明,多发灶、侵犯被膜、Emax>43.35 kPa 为独立危险因素,这三个征象在PTMC 中出现越多,越有可能出现中央区淋巴结转移。其中,诊断价值最高的是Emax,其OR 值高于二维超声征象,表明SWE 预测PTMC 中央区淋巴结转移中较常规超声更为可靠。将常规超声与Emax 结合预测PTMC 中央区淋巴结转移的准确性可提高。
综上所述,SWE 可预测PTMC 患者中央区淋巴结转移。PTMC 多发灶、侵犯被膜及Emax>43.43 kPa 时,患者发生中央区淋巴结转移风险增高,建议临床预防性行中央区淋巴结清扫。但本研究样本量较少且缺乏术后长期随访,故最终结论需扩大样本量及术后长时间随访予以明确。
