人参豆豉的发酵工艺及人参皂苷生物转化研究
2020-03-28陈丽艳崔贝贝孙银玲陈继亮郑宏宇王伟明
陈丽艳,崔贝贝,孙银玲,陈继亮,曹 阳,郑宏宇,王 萍,王伟明
(黑龙江省中医药科学院,黑龙江 哈尔滨 150036)
豆豉为我国传统大豆发酵食品,具有较高的营养价值和食疗作用,通常是在自然条件下由多菌种混合发酵制得,因生产环境、辅料及制备工艺等不同,制得的豆豉风味和生理活性物质含量也不尽相同[1-3]。中药淡豆豉是大豆与青蒿、桑叶或紫苏、麻黄等经发酵加工制成,因发酵时加入不同药材而产生不同的药性[4-5]。豆豉和中药淡豆豉中均含有豆豉纤溶酶,能有效溶解血栓并抑制血栓形成,且安全无毒副作用[6-7]。
心脑血管疾病患者常伴有气虚血瘀,因此溶栓的同时需兼顾补气,而人参(Panax ginsengC.A.Mey.)为首选的补气中药,常用于气血两虚证,既能补气以行血,又有一定的活血之功,可用治血脉瘀滞诸证[8]。另外,卫生部2012年第17号公告已批准人参(人工种植)为新资源食品,并规定了人参的食用量,为人参在食疗产品的应用提供依据。另据报道,一些人参皂苷成分口服生物利用度低,需经肠道微生物转化为次级苷或苷元而发挥更强的药理作用[9-10],已有学者在体外利用微生物发酵实现人参皂苷的生物转化[11-12]。
目前,尚鲜见在豆豉的制备中加入人参的相关报道,本研究以人参和黄豆为发酵基质,利用从淡豆豉中分离筛选的优势菌种纯种发酵制备人参豆豉(参豉),以期增加豆豉的益气活血作用,并实现人参皂苷的体外生物转化,提高生物利用度。以纤溶酶活性为评价指标,通过发酵菌株、人参与黄豆的质量比、人参的加入方式、发酵温度及发酵时间的考察以确定参豉的最佳发酵工艺,并利用薄层色谱(thin layer chromatography,TLC)及高效液相色谱(high performance liquid chromatography,HPLC)分析发酵前后人参皂苷的变化,为参豉作为食疗产品的应用及质量标准的建立提供依据。
1 材料与方法
1.1 材料与试剂
1.1.1 材料
黄豆:由黑龙江省农业科学院提供,2017年种植采收,为豆科植物大豆[Glycine max(Linn.)Merr]的干燥成熟种子。人参:由吉林省百济堂参业有限公司提供,种植5年,2017年采收,为五加科植物人参的干燥根。
1.1.2 菌种
枯草芽孢杆菌(Bacillus subtilis)DC-1、伞枝梨头霉(Absidia corymbifera)DC-11:分离自淡豆豉饮片(黑龙江产地和山东产地),保存至黑龙江省中医药科学院中药所生物工程研究室;枯草芽孢杆菌(Bacillus subtilis)GB-1、GB-2、GB-3、GB-4(标准菌株):中国工业微生物菌种保藏中心。
1.1.3 试剂
人参皂苷对照品Rb1、Rc、Re、Rf、Rg1、Rh1、Rck(纯度均≥98%):成都瑞芬思生物科技有限公司;马铃薯葡萄糖琼脂(potato dextrose agar,PDA)培养基、琼脂粉(生化试剂):北京奥博星生物技术有限责任公司;尿激酶标准品、纤维蛋白原、凝血酶原:中国食品药品检定研究院;薄层硅胶G:青岛海洋化工有限公司;甲醇、乙腈(均为色谱级):美国TTEDIA试剂有限公司;其他试剂均为分析纯。
1.2 仪器与设备
DL-CJ-2N净化工作台:北京东联哈尔仪器制造有限公司;BSA224S电子天平:赛多利斯科学仪器(北京)有限公司;MF3多功能一体机:杭州迅数科技有限公司;DHP-9272恒温培养箱:上海一恒科学仪器有限公司;e2695-2489高效液相色谱(high performance liquid chromatography,HPLC)仪:美国Waters公司。
1.3 方法
1.3.1 参豉发酵工艺
将黄豆按照1∶1.2(g∶g)的比例加蒸馏水(或人参提取液)浸泡,待溶液吸尽,装袋,于121 ℃高压灭菌40 min,室温放置,作为发酵基质。按照2%(V/V)的接种量接种各发酵菌液(106~108CFU/mL),摇匀,培养,即得参豉发酵产品。
1.3.2 参豉发酵工艺优选
以纤溶酶活性为评价指标,考察不同菌株、黄豆与人参比例、人参加入方式、发酵温度及发酵时间对纤溶酶活性的影响,确定最优发酵工艺。
发酵菌株的筛选:黄豆与人参比例为10∶1(g∶g),人参加水提取,将菌株DC-1、GB-1、GB-2、GB-3、GB-4、DC-11和DC-1+DC-11复合菌分别作为发酵菌,其中菌株DC-1、GB-1、GB-2、GB-3、GB-4于37 ℃条件下恒温培养48 h;菌株DC-11和DC1+DC11复合菌于28 ℃条件下恒温培养120 h。
黄豆与人参比例的考察:调整黄豆与人参质量比分别为50∶0、40∶1、30∶1、20∶1、10∶1、5∶1作为发酵基质,人参加水提取,以菌株DC-1为发酵菌,于37 ℃条件下恒温培养48 h。
人参加入方式的考察:黄豆与人参的比例10∶1,人参以3种方式加入:(1)将黄豆加水浸泡后沥干加入人参粉末拌匀;(2)将人参加蒸馏水煎煮2次,每次1 h,滤液浸泡黄豆;(3)先将人参用体积分数70%乙醇回流提取1 h,滤液回收乙醇,滤渣再加蒸馏水煎煮1 h,合并两次滤液浸泡黄豆。以菌株DC-1为发酵菌,于37 ℃条件下恒温培养,分别在24 h、48 h、72 h、96 h、120 h、144 h、168 h取样,测定纤溶酶活性。
发酵温度的考察:黄豆与人参质量比10∶1,人参加水提取,以菌株DC-1为发酵菌,分别于25 ℃、28 ℃、33 ℃、37 ℃、40 ℃条件下恒温培养96 h,测定纤溶酶活性。
1.3.3 纤溶酶活性的测定
参照王萍等[13]纤溶酶活性的测定方法制备纤维蛋白原平板和配制酶活力分别为80 IU/mL、60 IU/mL、40 IU/mL、20 IU/mL、10 IU/mL的尿激酶标准溶液。取2 g样品加0.9%氯化钠溶液10 mL,研磨、过滤,分别取各样品滤液及尿激酶标准溶液各10 μL,点于纤维蛋白平板上,于37 ℃温育18 h,测定溶圈面积。以尿激酶溶圈面积(y)为纵坐标,酶活力(x)为横坐标,绘制尿激酶标准曲线(y=1.722 1x+9.255 9,R2=0.9906),根据标准曲线回归方程计算样品的纤溶酶活性。
1.3.4 薄层色谱分析
供试品溶液的制备:参照《中国药典》并稍作修改[4]。取最优发酵工艺制备的参豉样品干燥、粉碎,过3号筛,取10 g粉末(10 g参豉样品相当于含1 g人参),以同法处理的未接种发酵基质为对照,分别加入三氯甲烷40 mL,加热回流3 h,过滤,药渣挥干溶剂,加水饱和的正丁醇50 mL,超声处理30 min,过滤。滤液加3倍体积的氨试液,摇匀,放置分层,收集上层溶液并蒸干,加入1 mL甲醇溶解,作为供试品溶液。
对照品溶液的制备:精密称取人参皂苷对照品Rb1、Rc、Re、Rf、Rg1、Rh1、Rck,加甲醇,分别制成质量浓度为2 g/L的对照品混合溶液。
采用薄层色谱法[4],吸取上述人参皂苷对照品溶液和供试品溶液各2 μL,分别点于同一薄层硅胶G板。以10 ℃以下放置的三氯甲烷-甲醇-水(65∶35∶10,V/V)下层溶液为展开剂,于4 ℃展开,晾干,喷以10%硫酸乙醇溶液,于105 ℃加热至斑点显色清晰,置于紫外光灯(365 nm)下观察。
1.3.5 高效液相色谱分析
参照《中国药典》对参豉中人参皂苷进行定量分析[4]。采用甲醇将1.3.4中的对照品混合溶液稀释10倍,得到质量浓度为0.2 g/L的对照品溶液。以未接种发酵基质为对照,取最优发酵工艺制备的参豉样品粉末10 g进行HPLC分析。HPLC条件:C18色谱柱(4.6 mm×250 mm,5 μm),流动相为乙腈(A)和水(B),洗脱梯度为0~35 min,A为19%;35~55 min,A为19%~29%;55~70 min,A为29%;70~110 min,A为29%~40%。流速1 mL/min,检测波长203 nm。
1.3.6 数据分析
采用Graphpad Prism 6.0软件进行统计学分析。
2 结果与分析
2.1 参豉发酵工艺的确定
2.1.1 发酵菌株的筛选
不同发酵菌株对参豉纤溶酶活力的影响见图1。
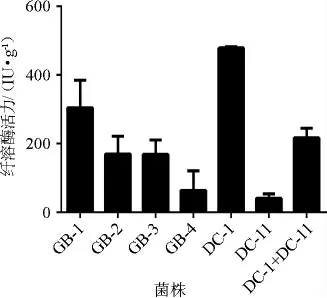
图1 不同菌株对参豉纤溶酶活性的影响Fig.1 Effect of different strains on fibrinolytic activities of ginseng-Douchi
由图1可知,不同菌株发酵参豉的纤溶酶活性大小排序为菌株DC-1>GB-1>DC-11+DC-11>GB-3>GB-2>GB-4>DC-11,其中枯草芽孢杆菌DC-1发酵参豉的纤溶酶活性最高,为(478.95±3.50)IU/g。已有研究表明,枯草芽孢杆菌为豆豉的主发酵菌,也是产豆豉纤溶酶的主要菌[14]。菌株DC-1和GB-1、GB-2、GB-3、GB-4虽均为枯草芽孢杆菌,但纤溶酶活性明显存在差异(P<0.05),说明同一菌种不同菌株产纤溶酶能力存在差异。菌株DC-11为伞枝梨头霉,在酒曲中普遍存在,可改善酒的风味和口感[15],该菌已用于人参皂苷、黄芪皂苷的微生物转化[16-17]。由于淡豆豉传统自然发酵为多菌种混合发酵而成,菌株DC-1和DC-11均分离自淡豆豉饮片,因此本研究中也利用这两种菌复合菌发酵制备参豉进行对比研究。结果表明,最佳发酵菌株为DC-1。
2.1.2 黄豆与人参比例的确定
黄豆与人参比例对参豉纤溶酶活力的影响见图2。
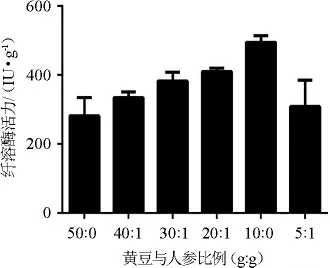
图2 黄豆与人参比例对参豉纤溶酶活性的影响Fig.2 Effect of soybean to ginseng ratio on fibrinolytic activities of ginseng-Douchi
由图2可知,随着人参加入量的升高,参豉纤溶酶活性呈现先升高后降低的趋势,当黄豆与人参比例为10∶1(g∶g)时,纤溶酶活性最高,为(495.02±19.24)IU/g。分析原因可能是人参在低质量浓度时促进而高质量浓度时抑制菌株DC-1的生长,进而影响纤溶酶活性。因此,确定黄豆与人参最佳比例为10∶1(g∶g)。
2.1.3 人参添加方式及发酵时间的确定
人参添加方式及发酵时间对参豉纤溶酶活力的影响见图3。
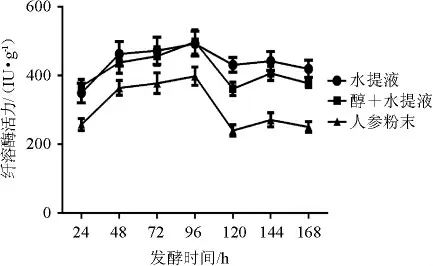
图3 人参添加方式及发酵时间对参豉纤溶酶活性的影响Fig.3 Effect of ginseng addition mode and fermentation time on fibrinolytic activities of ginseng-Douchi
由图3可知,人参以水提液和先醇提再水提的方式加入后发酵96 h时,纤溶酶活性均达到最高,分别为(492.95±36.25)IU/g和(498.07±35.12)IU/g,且优于以粉末形式加入,从工艺过程考虑,人参采用水提液方式加入,发酵时间96 h。
2.1.4 发酵温度的确定
发酵温度对参豉纤溶酶活力的影响见图4。
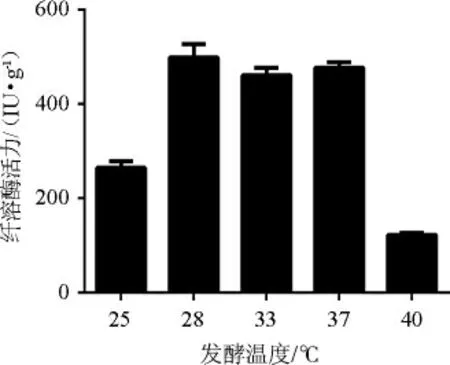
图4 发酵温度对参豉纤溶酶活性的影响Fig.4 Effect of fermentation temperature on fibrinolytic activities of ginseng-Douchi
由图4可知,发酵温度为25 ℃时,纤溶酶活力较低,分析原因可能是该菌生长比较缓慢所致;发酵温度为28 ℃时,参豉纤溶酶活性最高,为(498.90±28.33)IU/g;发酵温度高于28 ℃之后,纤溶酶活性呈下降趋势,40 ℃时下降明显,表明DC-1菌的生长受温度的影响较大,进而影响酶的生物量。
综上所述,以纤溶酶活性为考察指标,确定参豉最佳发酵工艺:优势发酵菌株为枯草芽孢杆菌DC-1,黄豆与人参比例为10∶1(g∶g),人参以水提液的方式加入,于28 ℃发酵96 h。
2.2 薄层色谱分析结果
《中国药典》中仅以Rg1、Rf、Re、Rb1为对照进行人参的鉴别[4],本研究增加了稀有人参皂苷Rck、Rh1和Rc为对照品,为分析人参皂苷多种成分的转化提供依据。7种人参皂苷的薄层色谱分析结果见图5。

图5 参豉中人参皂苷薄层色谱分析结果Fig.5 Result of ginsenoside in ginseng-Douchi analyzed by thin layer chromatogram
由图5可知,7种人参皂苷对照品薄层色谱斑点分离度较好,表明该方法适用于这7种人参皂苷的分离。参豉发酵前后均含有7种人参皂苷,但发酵后人参皂苷Rh1和Rf斑点颜色变淡,可能是由于这两种成分发生了生物转化。参豉发酵前后样品的在Rc和Rb1斑点较密集,没有明显分开,可能是由于大豆中的成分干扰所致,需结合高效液相色谱结果进一步分析。
2.3 高效液相色谱结果
发酵前后参豉的HPLC见图6,7种人参皂苷含量的变化见表1。
由图6可知,除人参皂苷Rck在此色谱条件下未显示单一的色谱峰外,其他6种人参皂苷对照品分离度均较好。由表1可知,未接种基质中人参皂苷Rg1、Re、Rf、Rb1、Rh1和Rc的含量分别为0.185 2 mg/g、0.355 8 mg/g、0119 8 mg/g、0.116 0 mg/g、0.071 6 mg/g和0.585 7 mg/g,发酵后分别为0.050 0 mg/g、0.095 5 mg/g、0.043 3 mg/g、0.039 0 mg/g、0.024 0 mg/g和0.156 0 mg/g,发酵后6种人参皂苷成分均下降60%以上,表明这6种成分在微生物酶作用下发生了生物转化。未接种基质在38.29 min出现一个色谱峰,但发酵后消失,且在36.98 min出现了一个新化合物,可能是此种成分转化而得。除6种人参皂苷外,在80 min后也有几种物质峰面积下降,可能是其他人参皂苷成分发生了降解。目前已经从人参属植物中分离得到150多种人参皂苷[18],《中国药典》仅以人参皂苷Rg1、Re、Rb1三种对照品测定其含量,本研究又增加了Rf、Rh1和Rc对照品,但仍存在一定局限性,因为不同人参皂苷的结构不同,不能采用同一种方法把所有人参皂苷都提取分离并检测出来。
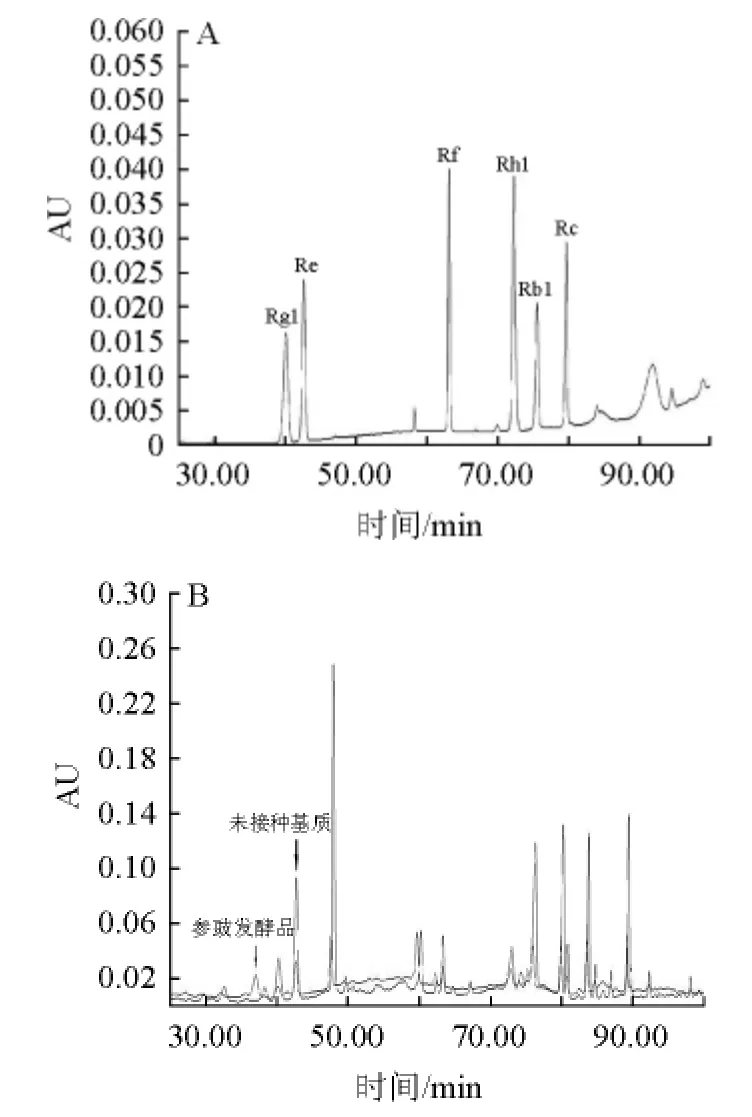
图6 人参皂苷对照品(A)及发酵前后参豉样品(B)的高效液相色谱图Fig.6 HPLC of ginsenoside reference substance (A) and ginseng-Douchi (B) before and after fermentation
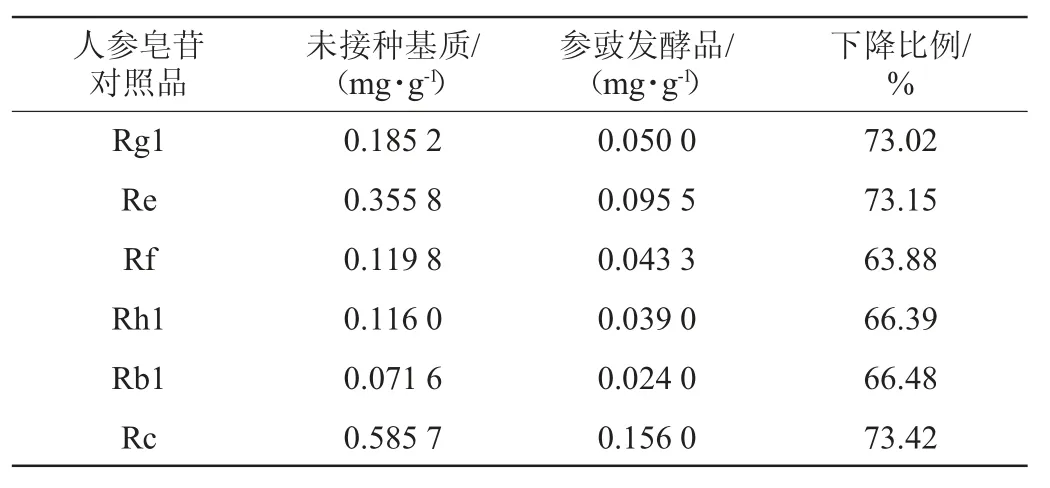
表1 参豉发酵前后6种人参皂苷含量的变化Table 1 Changes of 6 kinds of ginsenoside in ginseng-Douchi before and after fermentation
在已有报道中,人参皂苷的生物转化多以一种或几种人参皂苷单体成分进行转化[19-20],不受其他基质成分的干扰,更易于转化成分的分析。参豉中人参的加入量仅为黄豆质量的1/10,在样品制备及检测过程中可能受黄豆中的一些成分干扰,且人参以水提液的方式加入,使人参皂苷成分不能完全提取出来,分析转化产物的成分相对也比较复杂。人参水提液中除含有人参皂苷外,人参多糖在降糖、增强免疫、抗氧化等方面也发挥了重要作用[21-22]。经典名方“独参汤”是以水煎液口服入药,ZHOU S S等[23]研究表明,独参汤可通过人参多糖对肠道菌群的调节作用促进人参皂苷的转化;李瑞刚等[24]研究也证实人参多糖能促进人参皂苷Re转化为人参皂苷Rg1。本研究仅基于6种人参皂苷成分对参豉发酵前后人参皂苷的含量变化进行分析,对于其他人参皂苷的转化情况尚需通过大量的实验进一步研究。
3 结论
本研究利用淡豆豉的发酵原理,将黄豆辅以人参发酵制备一种具有高纤溶活性的参豉。通过发酵菌株的筛选、人参的加入量和加入方式、发酵温度及发酵时间的考察确定了参豉的最佳发酵工艺:优势发酵菌株为枯草芽孢杆菌DC-1,黄豆与人参比例为10∶1(g∶g),人参以水提液的方式加入,于28 ℃发酵96 h。此优化条件下参豉的纤溶酶活力达到(498.90±28.33)IU/g。同时,通过微生物发酵实现了多种人参皂苷的体外生物转化,转化率达60%以上。本研究为参豉后续益气活血作用研究及质量标准建立提供依据,也为开发具有保健作用的食疗产品奠定基础。
