泡辣椒发酵过程中质构劣化规律及其影响因素研究
2020-03-28葛黎红赖海梅王雅利黄玉立林长彬朱永清
赵 楠,葛黎红,郭 壮,邓 风,赖海梅,王雅利,,黄玉立,,林长彬,李 娟,朱永清
(1.四川省农业科学院 农产品加工研究所,四川 成都 610066;2.四川师范大学 生命科学学院,四川 成都 610101;3.湖北文理学院 食品科学技术学院 鄂西北传统发酵食品研究所,湖北 襄阳 441053)
泡辣椒是我国传统特色发酵食品的代表之一,以其鲜香爽脆、酸辣适口的感官特色,作为佐餐佳品深受南方消费者的喜爱[1]。发酵过程中微生物的代谢活动是决定泡辣椒品质好坏的关键[2],如乳酸菌活跃的产酸代谢活动主要赋予了泡辣椒的酸香滋味[3];真菌具有丰富的蛋白、脂质和糖类等降解酶系,可将大分子降解产生小分子增加产品滋味和风味[4]。但是在泡辣椒发酵过程中,微生物丰富的代谢酶系在产生滋味和风味物质的同时[2],也能够降解辣椒组织细胞壁中的果胶类物质[5-7],造成组织细胞结构的坍塌,引起产品质构软烂,主要表现为泡辣椒产品硬度、脆度和咀嚼性的下降。
泡辣椒的质构由辣椒组织细胞壁的机械结构完整度及细胞水分存在状态共同决定,辣椒组织细胞壁的机械结构完整度主要与环境pH、离子强度、果胶解酶活性等诸多因素有一定关系[1,8-10]。我国传统泡辣椒的发酵周期在10~20 d,发酵进程伴随着泡辣椒的质构和理化特性的形成过程[2]。一方面,发酵过程中微生物的代谢过程通过改变环境(pH、离子强度)而间接影响泡辣椒组织结构状态[11-12];另一方面,微生物代谢产生的果胶降解酶系可通过降解植物细胞壁成分而直接影响辣椒组织结构完整度,进而影响泡辣椒质构变化过程[5]。尽管已有研究关注泡辣椒发酵过程中质构劣化的现象,但其变化规律尚不清楚,且产品劣化过程与微生物发酵以及理化指标的变化之间的关系还不明确。
本研究在考察泡辣椒发酵过程中质构、微生物数量及理化性质变化规律的基础上,采用相关性分析方法对质构与微生物数量及理化指标之间的相关性进行分析,以明确泡辣椒在发酵过程中的质构劣化规律及其与微生物指标、理化指标之间的相关性。
1 材料与方法
1.1 材料与试剂
新鲜红辣椒:襄阳市农贸市场;食盐(食用级):四川省盐业总公司;氢氧化钠(分析纯):国药集团化学试剂有限公司;果胶酶活性检测试剂盒:北京索莱宝科技有限公司;MRS培养基和孟加拉红培养基:青岛海博生物技术有限公司。
1.2 仪器与设备
BS224S型分析天平:北京赛多利斯仪器系统有限公司;FiveEasy PlusTMFE20K型pH计、MB27型水分活度仪、HE53型快速水分蒸发仪:梅特勒-托利多仪器(上海)有限公司;NMI20-025V-I核磁共振分析仪:上海纽迈电子科技有限公司;TA.XTPlus型物性分析仪:英国Stable Micro System有限公司。
1.3 方法
1.3.1 发酵辣椒制备
向泡菜坛中加入1 800 mL 4%氯化钠溶液、400 g鲜辣椒,将泡菜坛水封后放入25 ℃培养箱进行发酵,分别在第0、2、4、6、8、10、12、14、16天取辣椒样品进行质构(硬度、脆性、咀嚼性)、微生物指标(乳酸菌、真菌数量)及理化指标(pH值、水分含量、水分活度、水分分布、果胶酶活力)的测定,平行试验3次。
1.3.2 质构剖面分析
选取泡辣椒样品,将辣椒切成3段,选取中间一段作为测试对象。测试条件[1]:探头型号P2,测前速度1 mm/s,测试速度1 mm/s,测后速度2 mm/s,穿刺距离15 mm。每个样品重复测定8次,结果取平均值。
1.3.3 微生物指标
于无菌条件下取泡辣椒样品5 g,加入45 mL无菌水,均质,梯度稀释后选取适宜梯度样品液,分别涂布于MRS培养基和孟加拉红培养基,MRS培养基平板置于厌氧条件下37 ℃培养72 h,计数为乳酸菌数量,孟加拉红培养基平板于30 ℃培养72 h,计数为真菌数量[13]。
1.3.4 理化指标
pH值[13]:取卤水10 mL,采用pH计进行测定。
水分含量[14]:将泡辣椒剪成小片,称取3 g样品装入样品盒中,采用快速水分蒸发仪测定;水分活度(water activity,Aw)[14]:采用水分活度仪进行测定;水分存在形式[14]:准确称取2 g泡辣椒样品于试管中,采用低场核磁共振分析仪检测,用PQ001分析软件及Q-CPMG序列采集泡辣椒T2信号。测定参数:等待时间3 000 ms,回波时间0.8 ms,前置放大倍数1,回波个数10 000,累加次数8。
果胶酶活力[15]:取1 g泡辣椒样品,采用果胶酶活性检测试剂盒测定。
1.3.5 多元统计学分析
采用SPSS 17.0软件进行皮尔逊相关性分析。
2 结果与分析
2.1 泡辣椒发酵过程中质构变化
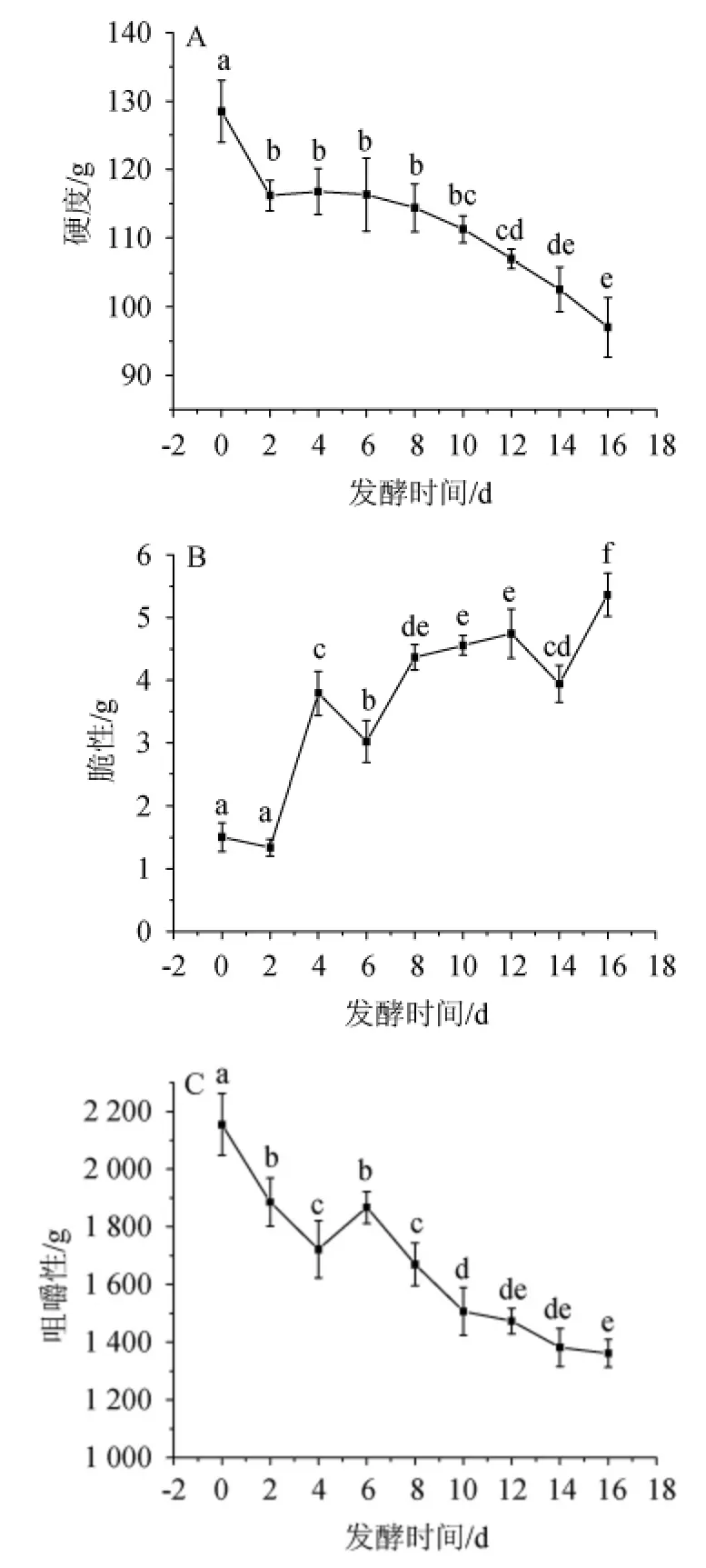
图1 泡辣椒发酵过程中硬度(A)、脆度(B)和咀嚼性(C)的变化Fig.1 Changes in hardness (A),crispness (B) and chewiness (C) of pickled pepper during the fermentation process
泡辣椒的质构是影响消费者接受度的重要指标之一,在质构剖面分析中,硬度、脆度和咀嚼性是评价泡辣椒质构的主要指标。泡辣椒发酵过程中质构的变化结果见图1。由图1可知,鲜辣椒经发酵后硬度和咀嚼性均明显下降,当发酵时间为16 d时,泡辣椒的硬度和咀嚼性分别下降24.49%和36.81%,表明泡辣椒在发酵过程中组织逐渐软化。在脆度方面,发酵过程使得泡辣椒脆度显著上升(P<0.05),当发酵时间为8 d时,脆度为4.36 g,是鲜辣椒的1.90倍;当发酵时间>8 d之后,脆度上升趋势减缓;当发酵16 d时,脆度为5.36 g,是鲜辣椒的2.56倍。该结果与已有研究对辣椒发酵后脆度变化的报道结果不一致[1],这可能与食盐添加量的差异有关,已有研究的食盐添加量在5%~25%,本研究中较低的食盐添加量有助于脆度的保持。此外,BUESCHER R W等[16]研究发现,在酸黄瓜泡菜中,随发酵体系乳酸含量增加,蔬菜果皮中的果胶变性程度加剧,发酵蔬菜脆度也将上升,这与本研究结果相一致。
2.2 泡辣椒发酵过程中微生物变化
泡辣椒发酵是微生物代谢活动的结果,微生物不仅可通过代谢过程改变体系环境而影响组织细胞壁状态,还能够通过产生果胶降解酶系来直接影响泡辣椒质构。其中,乳酸菌是泡辣椒发酵过程中的主要产酸微生物[17],其在泡辣椒发酵过程中的变化见图2A。由图2A可知,在发酵0~2d,乳酸菌迅速增殖,当发酵2d时,乳酸菌数量增长至8.20lgCFU/g。当发酵2 d后逐渐趋向稳定。

图2 泡辣椒发酵过程中乳酸菌总数(A)和真菌总数(B)变化Fig.2 Changes in total lactic acid bacteria (A) and fungi (B) count in pickled pepper during the fermentation process
除乳酸菌外,发酵作用的另一类微生物是真菌[2],真菌在发酵系统所占比例较低,但是真菌可产生丰富的酶系,将泡辣椒组织细胞中的蛋白质、多糖等大分子降解,从而加速泡辣椒的质构软化[18],其在泡辣椒发酵过程中的变化见图2B。由图2B可知,在泡辣椒发酵过程中,在发酵0~2 d,真菌迅速增殖,当发酵2 d时,真菌数量增长至4.12 lgCFU/g;当发酵2 d后迅速下降至不可察。这表明真菌的作用时间主要发生在发酵前期。
2.3 泡辣椒发酵过程中理化性质的变化
2.3.1 泡辣椒发酵过程中pH值变化
泡辣椒发酵过程中pH值的变化见图3。由图3可知,在发酵0~2 d,泡辣椒的pH值迅速下降,分析原因可能是乳酸菌的迅速增殖通常伴随着酸性代谢物的大量积累,导致泡辣椒pH值在前2天内迅速下降;当发酵4 d时,pH值降至4.10。当发酵4 d后,pH值趋于稳定,分析原因可能是体系pH值下降后,体系中微生物的生长受到抑制,低pH值对产酸代谢具有抑制作用,产酸代谢减缓后,在体系中一些缓冲性代谢物的作用下,pH值趋于稳定[13]。

图3 泡辣椒发酵过程中pH值变化Fig.3 Changes in pH of pickled pepper during the fermentation process
2.3.2 泡辣椒发酵过程中水分含量、水分活度和水分存在状态变化
辣椒组织细胞中的水分含量以及细胞壁与周围水分的相互作用状态都可影响细胞壁结构的稳定性,进而影响组织机械结构以及泡辣椒产品的质构特性。泡辣椒发酵过程中水分含量、水分活度和水分分布变化见图4。
由图4A可知,在发酵过程中,泡辣椒的水分含量呈先逐渐下降后趋于稳定的趋势,当发酵8 d时,水分含量下降5.60%;当发酵8 d后,水分含量趋于稳定。这可能是由于在发酵0~8 d,4%食盐形成了高渗环境,导致组织细胞失水皱缩;在发酵8 d后,细胞内外渗透压逐渐平衡,泡辣椒水分含量趋于平稳。
由图4B可知,在发酵过程中,泡辣椒水分活度呈先下降后趋于稳定的趋势,当发酵2 d时,水分活度下降6.00%;当发酵2 d后,水分活度趋于稳定,这可能是由于体系pH稳定后,食盐渗透作用减弱,辣椒的失水作用逐渐停止[14]。
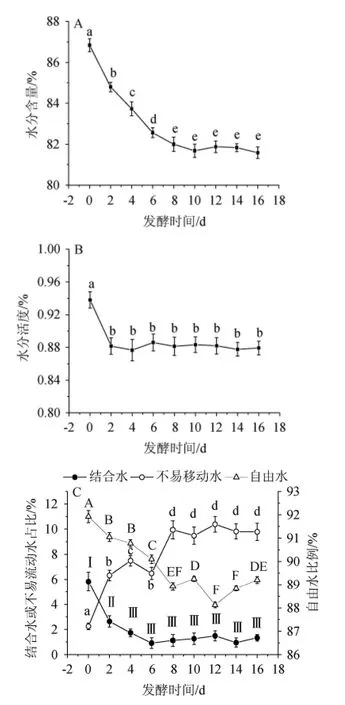
图4 泡辣椒发酵过程中水分含量(A)、水分活度(B)和水分分布(C)变化Fig.4 Changes in water content (A),water activity (B) and water distribution(C)of pickled pepper during the fermentation process
泡辣椒组织细胞中的结合水与组织细胞中的大分子通过相互作用结合,不易流动水主要位于组织细胞内部,流动受到阻滞。而自由水则处于游离状态,是植物组织细胞的水分中最容易失去的一种。低场核磁共振技术主要用于考察样品中结合水、不易流动水和自由水的含量和比例分布情况[19]。由图4C可知,结合水所占比例随发酵时间延长而下降,而不易流动水的比例明显增加,相对应的是自由水比例的略微下降。在样品水分含量变化幅度较小的情况下,发酵过程中样品水分活度的下降可能是由于发酵产酸过程使得环境pH值下降,组织细胞内外部的蛋白质、多糖等大分子带电量增加,与水分子结合的能力增强。另一方面,食盐所形成的高渗环境造成细胞失去自由水,且在泡辣椒腌制过程中食盐也将通过渗透作用进入辣椒组织细胞中,可进一步通过改变大分子的带电量而影响其与水分子的结合状态[20]。这些因素共同作用将引起泡辣椒发酵过程中自由水和结合水的比例下降,相应的,不易流动水的比例上升,这一现象与水分活度结果相对应。
2.3.3 泡辣椒发酵过程中总果胶酶活力变化
在发酵过程中,辣椒组织细胞中的内源性果胶降解酶系[21]以及微生物代谢产生的外源性果胶降解酶系[7]均可能通过降解果胶成分,直接导致泡辣椒软化。泡辣椒发酵过程中总果胶酶活力变化见图5。由图5可知,在发酵过程中,泡辣椒的总果胶酶活力呈先升高后下降后趋于稳定的趋势。在发酵2 d时,总果胶酶活力迅速上升68.32%。分析原因可能是微生物的旺盛代谢产生了大量果胶酶,内源性果胶酶因食盐高渗环境的存在而被释放出来,导致酶量增加。此外,发酵前期的微酸性环境也对果胶酶具有激活作用,这两方面因素均可能在一定程度上促进酶活力上升。而发酵2 d后,总果胶酶活力逐渐下降,发酵10 d时,总果胶酶活力下降至初始值的42.31%。分析原因可能是在发酵形成的低酸(pH值4.10)和高渗(4%食盐)条件的共同作用下,果胶酶活性受到明显抑制[22],这一现象与pH值变化结果相对应。在发酵10 d后,总果胶酶活力趋于稳定。
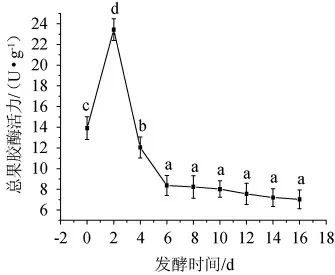
图5 泡辣椒发酵过程中总果胶酶活力变化Fig.5 Changes in total pectinase activity of pickled pepper during the fermentation process
2.4 泡辣椒发酵过程中质构形成与微生物指标及理化特性之间的相关性
采用皮尔逊相关性分析法对泡辣椒理化性质和微生物数量指标与质构之间的关系进行研究,结果见表1。由表1可知,泡辣椒样品的硬度、脆度和咀嚼性与总果胶酶活力、水分含量、结合水占比、不易移动水占比以及自由水比例之间均具有显著相关性。pH值主要与泡辣椒的硬度和咀嚼性具有显著相关性(P<0.05),但其与产品脆度相关性不大(P>0.05)。对于微生物指标,乳酸菌的数量与硬度和咀嚼性显著相关(P<0.05),但与脆度相关性不大(P>0.05)。而真菌的数量主要与脆度和咀嚼性显著相关,与样品硬度无明显相关(P>0.05)。由此可知,泡辣椒样品的质构主要与总果胶酶活力、水分含量及水分存在状态有关。在后续研究中,应着重开展总果胶酶活力、水分含量及水分存在状态与泡辣椒产品质构品质形成机制方面的研究。

表1 泡辣椒发酵过程中质构与理化性质及微生物指标之间的皮尔逊相关性系数Table 1 Pearson's correlation coefficients between texture and physicochemical properties,microbial indicator of pickled pepper during fermentation
3 结论
在发酵过程中,泡辣椒的硬度、咀嚼性下降,脆度上升。在发酵前2天,乳酸菌及真菌迅速增殖,总果胶酶活力升高,pH值迅速下降;发酵2 d后,乳酸菌数量、pH值趋于稳定,真菌下降并逐渐消失,总果胶酶活力迅速下降后趋于稳定。由于环境中酸和盐的共同作用,泡辣椒释放自由水,水分含量下降,且部分自由水转化为不易移动水,水分活度下降。相关性分析结果表明,泡辣椒硬度、脆度和咀嚼性质构指标主要与总果胶酶活力、水分含量及水分存在状态显著相关(P<0.05)。
