纤维素降解芽孢菌的筛选及产酶条件优化
2020-03-28朱瑞清牛永艳杜津昊王治业
毛 婷,朱瑞清,牛永艳,杜津昊,郑 群,王治业
(甘肃省科学院生物研究所 甘肃省微生物资源开发利用重点实验室,甘肃 兰州 730000)
纤维素是由D-葡萄糖苷以β-葡萄糖苷键结合成的高分子化合物,是地球上含量最丰富、分布最广泛、永不枯竭的可再生资源。利用现代生物技术,采用纤维素酶将纤维素转化为小分子有机物,可以有效解决世界能源、粮食短缺,环境污染等问题[1]。纤维素酶是一类复合酶系的总称,自1906年首次被研发,其降解纤维素机理主要有原初反应假说、碎片理论、顺序作用假说和协同理论等。目前,协同理论被普遍公认,其作用机制为纤维素内切酶作用于纤维素非结晶区水解β-1,4葡萄糖苷键,将纤维素长链切割为不同聚合度的短链纤维素;纤维素外切酶作用于短链纤维素非还原端依次裂解β-1,4葡萄糖苷键释放纤维二糖分子;β-葡萄苷酶将纤维二糖及其他低分子纤维糊精水解为葡萄糖[2],纤维素的降解需要至少这三种酶的协同作用。
我国作为一个农业大国,农作物秸秆的年产量高达6亿t,秸秆作为农作物提取出果实后的剩余物,是一类极重要的可再生资源,但目前秸秆被直接焚烧,填埋并没有得到有效的利用。利用纤维素酶对秸秆中纤维素类物质进行降解是最快速、经济、环保、有效的途径。产纤维素酶菌株主要有细菌和真菌[3]。目前工业使用的酸性纤维素酶生产菌主要来自里氏木霉(Trichoderma reesel)、黑曲霉(Aspergillus niger)等,中性及碱性纤维素酶生产菌主要来自芽孢杆菌等,中性及偏碱性纤维素酶,在纺织、造纸行业应用广泛[4]。真菌产纤维素酶酶系协调,酶活性高,但多数真菌好氧的特性,对环境要求严格,导致在一些纤维类废物的处理及饲料发酵工艺应用受限。
芽孢杆菌产生纤维素酶系中内切纤维素酶活性相对其他菌株较高,可以在不利的条件下形成芽孢,适应高温、酸碱性较强的环境,培养周期短、代谢产物丰厚,在发酵工业具有重大的应用前景[5]。目前,许多学者尝试从自然界中的土壤、水体、腐殖质及生物体内等环境中分离筛选产纤维素酶芽孢菌,并取得了一定的成绩[6]。梁倩等[7]从黑龙江玉米地土壤中筛选出高产纤维素酶枯草芽孢杆菌(Bacillus subtilis),该菌株产纤维素酶具有耐热、耐盐、耐酸并可被Cu2+激活。AHMAD R等[8]利用刚果红平板染色法从牛瘤胃中分离出一株芽孢杆菌BD92,该菌株羧甲基纤维素酶活为240 U/L。MUHAMAD A等[9]从白蚁肠道分离出一株产纤维素酶菌株,经鉴定为地衣芽孢杆菌(Bacillus licheniformis),该菌株羧甲基纤维素酶活最高可达到1 156 U/L。SUN L H等[10]从鹅盲肠中分离得到一株具有纤维素酶分泌和益生菌特性的液化淀粉芽孢杆菌,滤纸纤维素酶活达到1.25 U/mL。目前报道的所选育出的芽孢杆菌菌株酶活性低,高效产酶的菌种较少,因此,仍然需要寻找新的高产纤维素酶芽孢杆菌菌株。
纤维素酶菌株来源主要通过自然选育、诱变育种、抗降解物阻碍突变株筛选、原生质融合、基因工程育种等方法。其中自然选育是最简单也是最基本的纤维素酶产生菌获得方式[11]。本试验通过自然选育从原始森林公园兴隆山腐木中筛选产纤维素酶菌株,并对其进行种属鉴定及产酶条件优化,丰富产纤维素酶菌株的微生物来源,为纤维素酶制剂的研制或基因工程菌株的构建提供基础。
1 材料与方法
1.1 材料与试剂
1.1.1 样品来源
本试验采用原始森林公园兴隆山中腐木样品。采集时去除表面杂质,装入自封袋中并编号,取样时在超净工作台中将腐木样用灭菌的刀片剖开,于中心位置取样品,块状、余样4 ℃保存。
1.1.2 试剂
羧甲基纤维素钠(carboxymethylcellulose-Na,CMC-Na):天津市大茂化学试剂厂;新华定量滤纸:杭州沃华滤纸有限公司;3,5-二硝基水杨酸(3,5-dinitrosalicylic acid,DNS):上海中泰化学试剂有限公司;麸皮:济南鸿恩化工有限公司。
1.1.3 培养基
富集培养基[12]:CMC-Na 1 g,酵母粉1 g,KH2PO40.1 g,NaCl 1 g,MgSO4·7H2O 0.02 g,H2O 100 mL,pH自然,121 ℃灭菌20 min。
刚果红纤维素分离培养基:CMC-Na 2 g,(NH4)2SO42 g,MgSO4·7H2O 0.5 g,KH2PO41 g,NaCl 0.5 g,刚果红0.4 g,琼脂2 g,H2O 100 mL,pH 7.0,121 ℃灭菌20 min。
种子培养基:蛋白胨0.5 g,牛肉膏1 g,酵母粉0.5 g,葡萄糖0.5 g,NaCl 0.5 g,H2O 100 mL,pH 7.0,121 ℃灭菌20 min。
发酵培养基[13]:麸皮5 g,蛋白胨0.3 g,(NH4)2SO40.3 g,KH2PO40.1 g,MgSO4·7H2O 0.03 g,NaCl 0.5 g,H2O 100 mL,pH自然,121 ℃灭菌20 min。
滤纸条崩解培养基[14]:KH2PO40.1g,MgSO4·7H2O0.04g,(NH4)2SO40.3g,酵母粉0.01g,H2O100mL,121℃灭菌20min。
营养琼脂肉汤培养基:蛋白胨5 g、酵母粉5 g、葡萄糖5 g、NaCl 5 g,牛肉膏10 g、蒸馏水1 000 mL,pH 7.0,121 ℃灭菌20 min。
1.2 仪器与设备
AS型干燥箱:北京科伟永兴仪器有限公司;LBH-300T多功能粉碎机:永康科徠尔有限公司;SKY-100C恒温摇床:上海苏坤实业有限公司;UV-120-02紫外可见分光光度计:日本岛津公司;MJ-150Ⅱ培养箱:上海一恒科技有限公司;ZRN-PH-D型台式pH计:北京中瑞能仪表技术有限公司。
1.3 实验方法
1.3.1 纤维素降解菌的筛选
将腐木样品5 g装入装有玻璃珠的45 mL无菌水中,振荡30 min混匀。取1 mL菌悬液接入20 mL富集培养基中,在35 ℃、200 r/min恒温振荡器中富集培养48 h。将富集培养后的腐木混合菌液进行10倍稀释,各吸取稀释度为10-3、10-4、10-5、10-6的菌液100 μL涂于刚果红筛选培养基上,每个稀释度做3个平行,倒置放入35 ℃培养箱中培养24 h,观察是否产生透明圈。挑取刚果红平板上有明显透明圈的菌株。根据测量培养基中菌落的透明圈直径(D,cm)与菌落直径(d,cm),计算二者的比值(D/d),选取比值较大的菌株划线纯化4~5代后测定纤维素酶活力并保存[15]。
将初筛得到的菌株接种至20 mL种子培养基中,30 ℃、200 r/min培养18 h,制成种子液。将种子液以3%接种量接入200 mL发酵培养基中,在30 ℃、200 r/min培养24 h,于4 ℃、5 000 r/min条件下离心10 min,取上清液测定酶活。纤维素酶活的测定采用DNS法,酶活性单位定义为在50 ℃、pH 6.0条件下,每分钟从底物溶液中分解产生1 μg还原糖所需要的酶量为1个酶活性单位(U)。
滤纸酶活测定方法[16]:在25 mL刻度具塞试管中加入磷酸缓冲液(pH 6.0)1 mL、1 cm×6 cm的新华滤纸条1条,准确加入稀释好的待测酶液0.5 mL,50 ℃水浴30 min,加入2.0 mL DNS试剂,具塞沸水浴5 min,立即冷却,终止反应后定容至25 mL,摇匀后在波长550 nm处测定吸光度值,每管重复3次取平均值,通过葡萄糖标准曲线回归方程求出还原糖的含量。
葡萄糖标准曲线的制定:无水葡萄糖(105 ℃烘干至质量恒定)配制成质量浓度1 mg/mL的葡萄糖标准溶液,分别取此标准溶液0、0.2 mL、0.4 mL、0.6 mL、0.8 mL、1.0 mL、1.2 mL于比色管中,补水至2 mL,加入2.0 mL DNS试剂,具塞沸水浴5 min,立即冷却,终止反应后定容至25 mL,摇匀后在波长550 nm处测定吸光度值。以吸光度值作为纵坐标,葡萄糖含量为横坐标制作葡萄糖标准曲线并建立回归方程。
滤纸崩解试验:将测定纤维素酶活后筛选得到的菌株接种到种子培养基中制成菌悬液,取5 mL加入100 mL滤纸条崩解培养基中,每个三角瓶中放1/4Φ12.5 cm的扇形滤纸,30 ℃、100 r/min条件下摇瓶培养,以未加菌株的试验为对照,观察滤纸条崩解情况。
1.3.2 菌株的鉴定
将复筛出的产纤维素酶菌株涂布于营养肉汤琼脂平板上,观察单菌落的隆起形状、形态、透明度、质地、颜色、边缘等。菌株的生理生化特描述参照及《常见细菌系统鉴定手册》进行[17]。
利用微生物16S rDNA通用引物27F(5'-AGAGTTTGATCATGGCTCAG-3')、1492R(5'-TAGGGTTACCTTGTTACGACTT-3')对菌株16S rDNA序列进行扩增。菌落聚合酶链式反应(polymerase chain reaction,PCR)条件:95 ℃预变性5 min;95 ℃变性45 s,57 ℃退火50 s,72 ℃延伸1 min,30个循环;72℃延伸10 min。PCR产物纯化回收后送至上海生物技术有限公司测序,利用BLAST软件将测序结果与GenBank中已有序列进行比对,使用MEGA7.0构建系统发育树,确定菌株的种属。
1.3.3 产酶条件优化
分析菌株在液态发酵条件下产纤维素酶的影响因素。在发酵培养基基础上,考察培养时间(1 d、2 d、3 d、4 d、5 d)、培养温度(28 ℃、30 ℃、32 ℃、34 ℃、37 ℃、40 ℃)、初始pH值(4.0、5.0、6.0、7.0、8.0)、接种量(2%、4%、6%、8%、10%)、装液量(10%、20%、30%、40%、50%)这5个单因素对菌株产纤维素酶的影响。
在单因素优化的基础上,以滤纸酶活(Y)为评价指标,分别选取培养温度(A)、初始pH值(B)、接种量(C)及装液量(D)为考察因素设计正交试验,采取L9(34)正交试验设计,优化菌株产酶条件。正交试验因素与水平见表1。
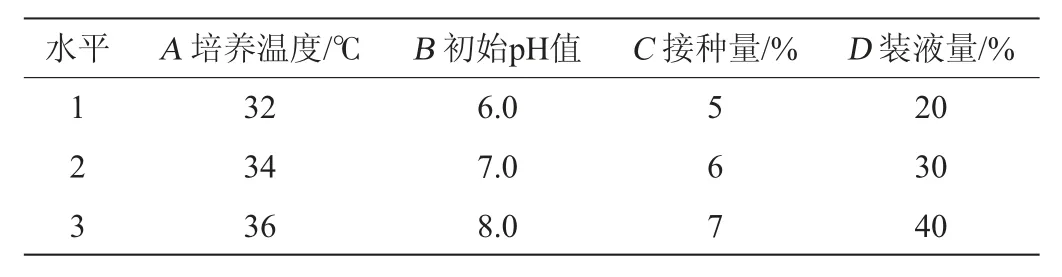
表1 纤维素酶生产条件优化正交试验因素与水平Table 1 Factors and levels of orthogonal experiments for cellulase production conditions optimization
2 结果与分析
2.1 纤维素降解菌的筛选
2.1.1 菌株初筛
通过样品的富集及刚果红平板染色法初筛,在平板中筛选有明显透明圈的菌株分离纯化,得到2株D/d较高菌株,分别命名为K1、K2。D/d比值大小,可以反映出纤维素酶活力高低,比值越大,说明纤维素降解能力越强。将菌株K1、K2点种于刚果红平板上培养,菌落周围有很大的透明圈,说明该菌株具有分解羧甲基纤维素能力,如图1所示。

图1 菌株K1、K2在刚果红平板上的透明圈Fig.1 Transparent circle of strains K1 and K2 on Congo red plate
2.1.2 菌株复筛
将菌株K1、K2接种于发酵培养基中,收集粗酶液,适当稀释后检测羧甲基纤维素酶大小进一步筛选。以吸光度值(Y)作为纵坐标,葡萄糖含量(X)为横坐标制作标准曲线,回归方程为Y=0.533 4X-0.008 9,相关系数R2为0.998 2,表明标准曲线线性关系良好。菌株K1、K2 D/d值和滤纸纤维素酶活测定结果见表2。由表2可知,菌株K1、K2的D/d比值分别为2.5、2.4,滤纸酶活分别为45.3U/mL、43.6U/mL,两菌株酶活数据相差不明显,可通过滤纸崩解试验进一步分析判断。

表2 菌株复筛结果Table 2 Secondary screening results of strains
将菌株K1、K2接入滤纸条崩解培养基中,每天观察培养基中滤纸形态。第1天,菌株K1、K2的滤纸边缘出现不同程度的分解;第2天,培养基出现浑浊,滤纸分解程度明显高于第1天;第3天,菌株K1中滤纸被分解为纸屑且培养基颜色浑浊更明显,菌株K2中仍能看见未被分解完全的滤纸,而不添加菌株的空白组滤纸仍存在,呈扇形状。说明分离筛选出的菌株K1、K2具有明显的纤维素降解能力,且从滤纸分解情况初步可以判断,菌株K1滤纸分解能力高于菌株K2。
2.2 菌株的形态学观察及生理生化特征
菌株K1、K2的革兰氏染色及形态学观察见图2。由图2可知,菌株K1呈乳黄色,边缘整齐、无皱褶;菌株K2呈灰白色,菌落较大,表面粗糙不规则,隆起、皱褶。菌株K1、K2均为革兰氏阳性菌。
菌株K1、K2生理生化特征如表3所示。由表3可知,菌株K1好氧,芽孢染色、接触酶、氧化酶、V-P试验均为阳性,甲基红、吲哚、硫化氢试验为阴性,菌株可利用葡萄糖、果糖、淀粉及羧甲基纤维素钠;菌株K2生理生化特征同菌株K1,因此初步判定两株菌均为芽孢杆菌或其变种。
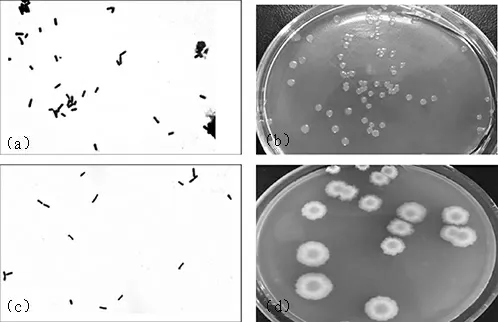
图2 菌株K1、K2的革兰氏染色及形态学观察结果Fig.2 Results of Gram staining and morphological observation of strains K1 and K2
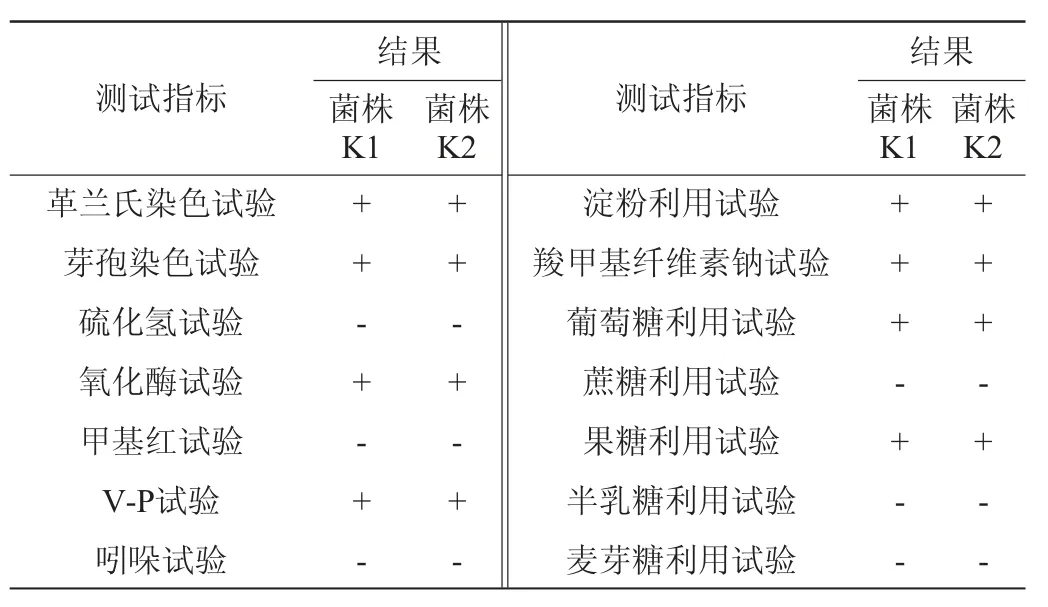
表3 菌株K1、K2的生理生化试验结果Table 3 Physiological and biochemical characteristic of strains K1 and K2
2.3 16S rDNA测序与分析
筛选到的两株菌使用细菌16SrDNA通用引物做PCR,所得产物经琼脂糖凝胶电泳检测在1 500 bp左右,如图3所示。
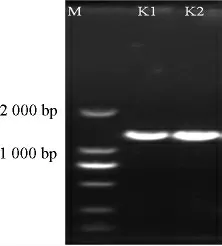
图3 菌株K1、K2琼脂凝胶电泳图Fig.3 Agar gel electrophoresis of strains K1 and K2
将PCR产物送至生工(上海)生物工程有限公司进行测序,测序结果在美国生物技术信息中心(national center for biotechnology information,NCBI)Blast上比对,结果表明菌株K1与贝莱斯芽孢杆菌(Bacillus velezensis)相似度99%以上,菌株K2与枯草芽孢杆菌(Bacillus subtillis)相似度在99%以上。根据K1、K2在NCBI Blast上比对的结果,在芽孢杆菌属选取13株菌株使用MEGA7.0构建系统发育树,如图4所示。因此,菌株K1被鉴定为贝莱斯芽孢杆菌(Bacillus velezensis),菌株K2被鉴定为枯草芽孢杆菌(Bacillussubtilis)。
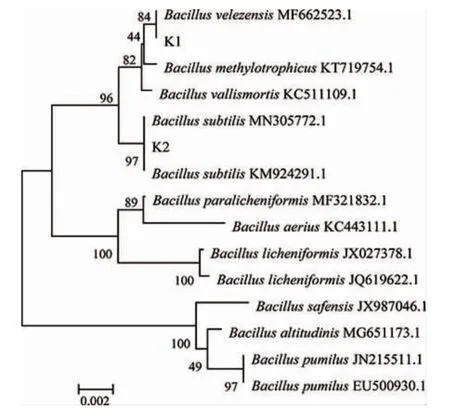
图4 基于16S rDNA基因序列菌株K1、K2的系统发育树Fig.4 Phylogentic tree of strains K1 and K2 based on 16S rDNA gene sequences
2.4 发酵产酶条件优化[18-19]
2.4.1 单因素优化
(1)培养时间对菌株产酶的影响
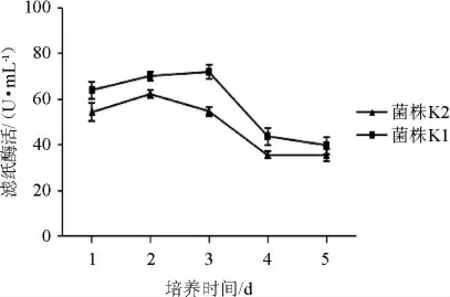
图5 培养时间对菌株K1和K2产酶的影响Fig.5 Effect of culture time on enzyme production by strains K1 and K2
从图5可以看出,在发酵前期,随着发酵时间的延长,滤纸酶活逐渐升高;之后随着发酵时间的延长,滤纸酶活基本稳定不再升高;发酵后期随着时间的延长,滤纸酶活有所降低。菌株K1在3 d时滤纸酶活达到72.2 U/mL,而菌株K2在2 d时滤纸酶活达到62.3 U/mL,菌株K2相对于菌株K1较早达到酶活高峰时间。因此,选择菌株K1的培养时间为3 d,菌株K2的培养时间为2 d。
(2)培养温度对菌株产酶的影响
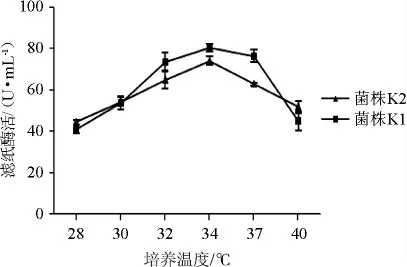
图6 培养温度对菌株K1和K2产酶的影响Fig.6 Effect of culture temperature on enzyme production by strains K1 and K2
从图6可以看出,当培养温度低于32 ℃时,随着温度的升高滤纸酶活升高;在34 ℃时菌株K1、K2滤纸酶活分别为80.3 U/mL、74.0 U/mL;温度超过37 ℃之后,随着温度的升高滤纸酶活明显减低。芽孢杆菌的最适生长温度为30~37 ℃,在体外不适应的环境下可以形成芽孢,抵抗力及环境适应性强,而不同温度条件下,微生物代谢途径不同,温度对菌株的生长和代谢产物的积累存在一定的影响。因此选择菌株K1、K2的培养温度为34 ℃。
(3)初始pH值对菌株产酶的影响

图7 初始pH对菌株K1和K2产酶的影响Fig.7 Effect of initial pH on enzyme production by strains K1 and K2
从图7可以看出,初始pH值为7.0时,菌株K1、K2滤纸酶活最高,在pH<6.0的酸性条件及pH>7.0的碱性条件下,滤纸酶活较低。pH值是菌株生长的重要环境因子,影响菌种营养物质的吸收和代谢过程中酶的活性[20]。大部分的细菌适合中性环境中生长,而霉菌和酵母菌适宜在pH<5.0的酸性环境中生长。因此,选择菌株K1、K2最适初始pH为7.0。
(4)接种量对菌株产酶的影响
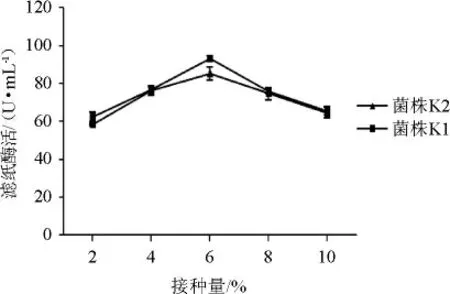
图8 接种量对菌株K1和K2产酶的影响Fig.8 Effect of inoculum on enzyme production by strains K1 and K2
从图8可以看出,接种量>6%之后,发酵液中溶解氧含量偏低,对于好氧菌的生长定会产生抑制作用;接种量<6%之后,会延长菌体达到高峰时间,影响产物的合成。不同微生物生长最适接种量不同,细菌的接种量一般控制在1%~5%。因此,选择菌株K1、K2最适接种量为6%。
(5)装液量对菌株产酶的影响
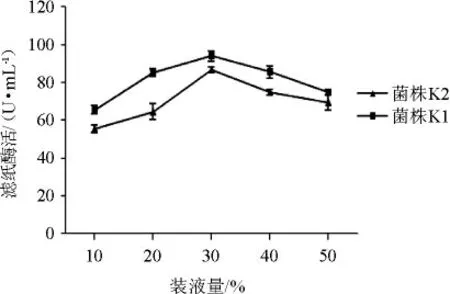
图9 装液量对菌株K1和K2产酶的影响Fig.9 Effect of loading liquid on enzyme production by strains K1 and K2
从图9可以看出,装液量在10%~30%时,随着装液量的增加,菌株酶活性逐步提高。在装液量为30%时,菌株K1、K2酶活性达到最高分别为94.0 U/mL、86.7 U/mL。因次,选择菌株K1、K2最适装液量为30%。
2.4.2 正交试验优化菌株K1产酶条件
根据单因素优化结果,菌株K1、K2滤纸酶活在目前报道的关于芽孢杆菌产纤维素酶菌株中酶活处于较高水平,菌株K1滤纸酶活高于菌株K2。因此,以菌株K1为目标菌株,以滤纸酶活为评价指标,选取培养温度(A)、初始pH值(B)、接种量(C)、装液量(D)为考察因素,正交试验结果如表4所示。由表4可知,4个因素对滤纸酶活的影响依次为培养温度>初始pH值>接种量>装液量。根据极差获得的最优产酶组合条件为A2B2C1D3。
通过极差分析获得的最优组合条件A2B2C1D3未出现在正交表中,需要与正交表中最高组合A2B2C3D1比较。在最优组合条件即培养温度34 ℃、pH 7.0、接种量5%、装液量40%,K1滤纸酶活为98.4 U/mL。通过极差分析得到的组合A2B2C1D3产生的滤纸酶活略高于正交试验得到的最优组合A2B2C3D1。因此确定菌株K1最佳产酶条件为培养温度34 ℃、pH 7.0、接种量5%、装液量40%。此优化条件下滤纸酶活为98.4 U/mL,是优化前的2.1倍。

表4 菌株K1产酶条件优化正交试验结果与分析Table 4 Results and analysis of orthogonal experiments for enzyme production conditions optimization
3 结论
本试验从兰州市榆中县原始森林公园腐木中筛选得到分解纤维素菌株K1、K2;通过形态学观察、生理生化特征及16S rDNA同源性比较,鉴定菌株K1、K2为贝莱斯芽孢杆菌、枯草芽孢杆菌,滤纸酶活分别为45.3 U/mL、43.6 U/mL。
选取培养时间、培养温度、初始pH值、接种量、装液量进行单因素优化,初步确定菌株K1发酵产纤维酶最佳工艺条件为培养时间3 d,培养温度34 ℃、初始pH值7.0、接种量6%、装液量30%,滤纸酶活为94.0 U/mL,是优化前的2.0倍;菌株K2发酵产纤维酶最佳工艺条件为培养时间2 d,培养温度34 ℃、初始pH值7.0、接种量6%、装液量30%,滤纸酶活为86.7 U/mL,是优化前的1.8倍。
以菌株K1为目标菌,在单因素优化基础上采用正交试验优化,初步确定影响菌株K1发酵产纤维酶的因素从大到小顺序为培养温度、初始pH值、接种量、装液量;最优组合条件为培养温度34 ℃、初始pH值7.0、接种量5%、装液量40%,在此优化条件下菌株K1滤纸酶活为98.4 U/mL,是优化前的2.1倍。
