人冻融卵巢组织异种异位移植血管生成的研究
2020-03-28龙惠东周灿权邓伟芬李宇彬
龙惠东,周灿权,邓伟芬,李宇彬
(1.中山大学附属第一医院,广东 广州 510080;2.深圳爱维艾夫妇科医院,广东 深圳 518116)
女性生育力保存的途径包括胚胎冷冻、卵子冷冻及卵巢组织冷冻,前两者目前已是发展比较成熟的技术,卵巢组织冷冻保存与移植技术尚处于临床积累经验阶段,该技术能冻存大量的原始卵泡,用于保存女性生殖功能有着不可比拟的优势,目前利用冻融卵巢组织进行自体移植技术出生的婴儿已超过90名[1-2]。卵巢组织的移植是非血管吻合移植,目前卵巢移植中常出现的问题是在血管建立前,因无法及时对卵巢组织进行供血,从而对该组织造成不可逆的损伤,而卵巢移植后组织血供的建立对卵巢功能的恢复及维持有着至关重要的作用,因此若能在卵巢移植和冻融过程中避免供血不足对其造成的损伤,这将在卵巢组织移植技术的发展中具有极其重大的意义。本研究探讨了人冻融卵巢组织异种异位移植血管生成的过程,旨在为冻融卵巢组织移植后功能再建提供理论基础。
1材料与方法
1.1材料的收集
1.1.1人卵巢组织的收集
经中山大学附属第一医院伦理委员会批准同意后,收集2005至2007年在该院行卵巢切除手术的6例肿瘤患者部分外观正常的卵巢组织,患者年龄为24~38岁,平均年龄为(31.8±5.7)岁,无化放疗史。人卵巢组织经慢速程序化冻融后,将其移植在雄性NOD-SCID小鼠背部皮下。
1.1.2实验动物的收集及处理
购于中山大学动物实验中心SPF级饲养的非肥胖糖尿病/重症联合免疫缺陷(NOD/SCID)小鼠,雄性,年龄为6~8周,重20~25g,实验前于常规条件进行适应性饲养。
1.1.3标本采集及处理
患者行全身麻醉下开腹手术,无菌条件下手术剪活检取得外观正常的人卵巢组织,在30min内于冰上运送回实验室处理。在L-15培养液中冲洗2~3次后,置于含L-15培养液的培养皿,用手术器械摘除卵巢组织上的卵泡、黄体及髓质,然后将卵巢皮质切成大小约(5×2×1)mm3的组织块进行慢速程序化冷冻,保存于液氮中。
1.2方法
1.2.1人卵巢组织的冷冻
参照Donnez等[3]的配方自行配制冷冻、解冻液。室温条件下将人卵巢组织依次在基础冷冻液和冷冻液Ⅰ中分别平衡5min,然后移至冷冻管(含冷冻液Ⅱ,4℃,30min),将其装入程序冷冻仪(英国,Planer KRYO10 Series Ⅱ),从4℃开始以-2℃/min进行降温,直至温度降到-7℃,平衡10min后,在冷冻管中植冰,继续平衡10min,然后先以-0.3℃/min降温至-40℃,再以-10℃/min的速度将温度快速降至-150℃,取出冷冻管迅速置于液氮中保存。
1.2.2人卵巢组织的解冻
将冷冻管从液氮取出后于室温轻轻晃动1min,放入37℃恒温水浴箱轻轻振动至完全融解,然后将人卵巢组织片移至解冻液中,依次于室温条件下置于解冻液Ⅰ、解冻液Ⅱ中分别平衡5min,然后移入解冻液Ⅲ中,放在37℃的6%的CO2培养箱中30min。
1.2.3人卵巢组织的异种异位移植
将小鼠麻醉后背部朝上固定在手术板上,消毒背部皮肤并铺上无菌孔巾;用手术剪剪开背部两侧皮肤,创口长度约2~3mm,提起皮肤,然后将人卵巢组织片置于背部皮下,缝合后消毒,人卵巢组织移植量为每只小鼠6块。术后注射庆大霉素防止感染。
1.2.4移植物的回收
分别于移植后第1、3、7、14、28、56和85天时间点随机选择小鼠,处死后剪开其背部皮肤回收卵巢组织片移植物。
1.3相关检测
1.3.1卵巢组织移植物中人血管的切片制作
根据石蜡切片常规制作流程包埋移植物并进行切片及二甲苯脱蜡和依次经高浓度到底浓度乙醇复水操作后,加入柠檬酸盐抗原修复液(pH=6.0,10min);然后加3%的H2O2灭活10min;蒸馏水冲洗3次,在PBS中浸泡5min;加入CD34抗体(一抗,鼠抗人,即用型,DAKO;阴性对照中用PBS代替)30~50μL,置于37℃水浴箱中孵育30min,PBS浸泡5min,共3次;加入二抗(DAKO invision试剂盒);置于37℃水浴箱中孵育30min,PBS浸泡5min,共3次;加DAB显色,苏木素染液复染,无水乙醇冲洗浮色,二甲苯透明,中性树胶封片。
1.3.2卵巢组织移植物中小鼠新生血管的切片制作
将卵巢组织移植物用冰冻胶包埋,冰冻切片机进行切片,厚度为6μm,将贴附卵巢组织移植物切片的玻片在丙酮中固定15min,加入CD31抗体(一抗,rat-anti-mouse CD31,1∶20,BD;阴性对照中用PBS代替)30~50μL,置于37℃水浴箱中孵育30min;PBS中浸洗5min,加入二抗(goat-anti-rat IgG:HRP,1∶50,Serotec)30~50μL,置于37℃水浴箱中孵育30min;PBS中浸洗5min,加DAB显色,苏木素染液复染,无水乙醇冲洗浮色,二甲苯透明,中性树胶封片。
1.3.3卵巢组织移植物中血管内皮生长因子的切片制作
根据石蜡切片常规制作流程包埋移植物并进行切片及二甲苯脱蜡和依次经高浓度到底浓度乙醇复水操作后,加入柠檬酸盐抗原修复液(pH=6.0,10min);然后加3%的H2O2灭活10min;蒸馏水冲洗3次,在PBS中浸泡5min;加入血管内皮生长因子(vascular endothelial growth factor,VEGF)抗体(一抗,鼠抗人,即用型,上海长岛;阴性对照中用PBS代替)30~50μL,置于37℃水浴箱中孵育30min,PBS浸泡5min,共3次;加入二抗(Supervision HRP试剂盒,上海长岛);置于37℃水浴箱中孵育30min,PBS浸泡5min,共3次;加DAB显色,苏木素染液复染,无水乙醇冲洗浮色,二甲苯透明,中性树胶封片。
1.4免疫组化的相关计算
微血管密度(MVD)的计算:通过观察免疫组化检测中CD34和CD31抗体对血管的标记结果图对MVD进行计算,在100×倍镜下选取图像中血管密集的部分,然后转换为400×倍镜,观察间质中染成棕褐色的单个细胞或一圈内皮细胞,计数MVD值。每切片在边缘和中央部分各选取5个密度较高的视野进行计数。
VEGF的阳性染色评分计算:参考Kutlu等[4]的计算方法,用Histochemical Score(HS)作半定量评价,计算公式为HS=[阳性面积%×(i+1)]/100,其中i为VEGF表达强度的分级,强阳性记为3、中等阳性记为2、弱阳性记为1。每个切片随机选取3个视野进行评分。
1.5统计学方法

2结果
2.1卵巢组织移植物中人血管的检测情况
移植前,人卵巢组织中微血管分布较为密集,主要分布位置在间质和卵泡周围;而移植后第3天,卵巢组织移植物中人微血管密集程度显著下降,移植后第85天卵巢组织移植物中人微血管仅剩小部分残留,见图1~图3。免疫组化图中MVD计算结果表明:各移植时间点的抗人CD34标记的MVD比较差异有统计学意义(F=2.871,P=0.024),说明随着移植时间的延长,卵巢组织移植物中人MVD显著降低,见表1。
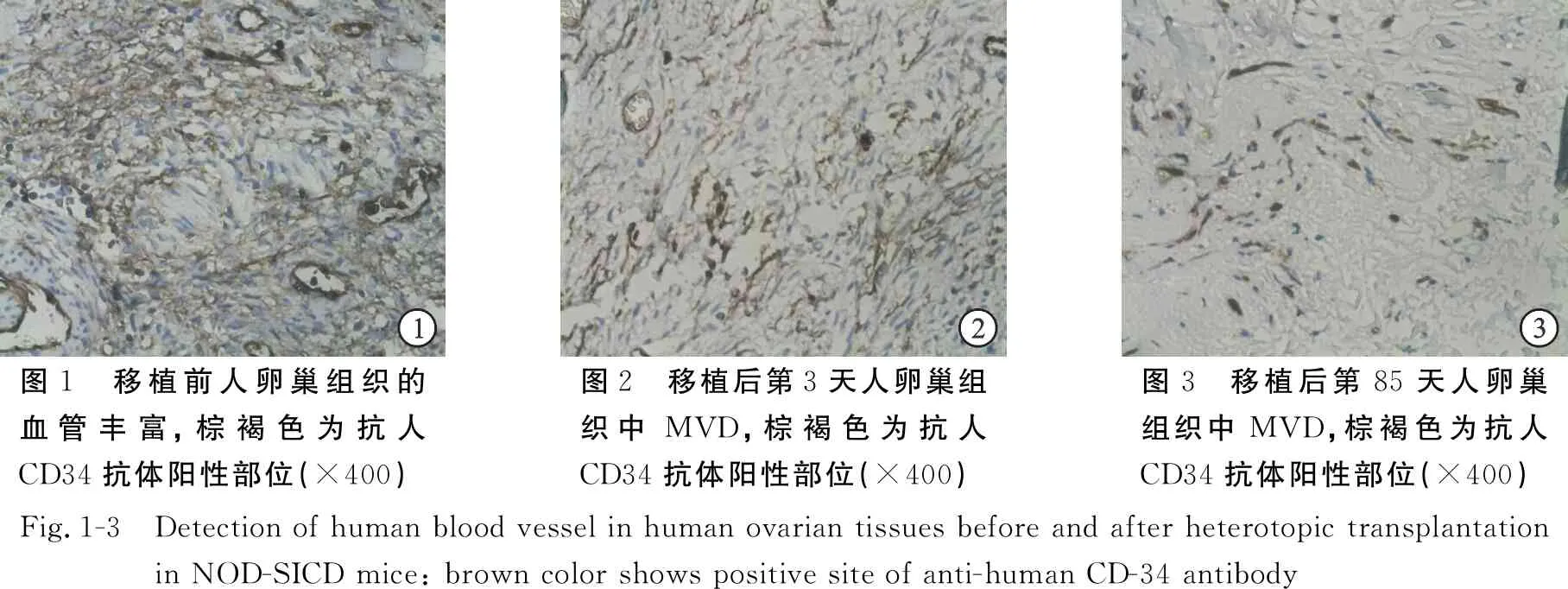
图1 移植前人卵巢组织的血管丰富,棕褐色为抗人CD34抗体阳性部位(×400)图2 移植后第3天人卵巢组织中MVD,棕褐色为抗人CD34抗体阳性部位(×400)图3 移植后第85天人卵巢组织中MVD,棕褐色为抗人CD34抗体阳性部位(×400)Fig.1-3 Detection of human blood vessel in human ovarian tissues before and after heterotopic transplantation in NOD-SICD mice: brown color shows positive site of anti-human CD-34 antibody

Table 1 Comparison of changes in human MVD in the grafts
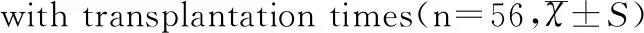

移植时间MVD移植前137.20±38.60第1天142.80±22.00第3天91.00±30.00第7天58.70±15.80第14天76.50±18.50第28天68.00±14.80第56天71.50±27.60第85天55.50±13.80*F2.871P0.024
注:*移植第85天与第7天比较,F=5.582,P=0.020;n=56代表检测移植物的数量。
2.2卵巢组织移植物中小鼠新生血管的检测情况
解冻的人卵巢组织移植后,卵巢组织移植物的新生血管早期主要分布在外周,即与小鼠组织相接部分,移植中后期在移植物内部也可观察到血管的生成,见图4~图7。免疫组化图中MVD计算结果表明:各移植时间点的抗小鼠CD31标记的MVD比较差异有统计学意义(F=155.710,P<0.001),说明随着移植时间的延长,卵巢组织移植物中小鼠MVD显著增加,且从第3天开始增加显著(F=75.543,P<0.001),见表2。
表2 小鼠MVD随移植时间变化的比较结果Table 2 Comparison of changes in murine MVD with transplantation times
注:*移植第3天与第1天比较,F=75.543,P<0.001;n=40代表检测移植物的数量。

图4 移植后第1天卵巢组织中小鼠血管生成,棕褐色为抗鼠CD31抗体阳性部位 (×400);图5 移植后第3天卵巢组织中血管生成,棕褐色为抗鼠CD31抗体阳性部位(×400)图6 移植后第7天人卵巢组织中血管生成,棕褐色为抗鼠CD31抗体阳性部位(×400)图7 移植后第14天人卵巢组织中血管生成,棕褐色为抗鼠CD31抗体阳性部位,可见有肌层的大血管生成(×400)Fig.4-7 Revascularization in frozen-thawed human ovarian tissues after heterotopic transplantation intoNOD-SICD mice: brown color indicates the positive site of anti-mouse CD-31 antibody
2.3卵巢组织移植物中血管内皮生长因子的检测情况
人卵巢组织移植物中VEGF的表达主要集中分布在外周,即与小鼠组织相接部分,主要在血管内皮细胞及其周围的间质细胞表达,见图8~图10。VEGF表达的HS值计算结果表明:移植后人卵巢组织中VEGF表达变化趋势为先上升后下降,其中在移植后第3天VEGF的表达显著上升(F=11.072,P=0.001),第14天后开始明显下降(F=18.564,P=0.001),各时间点VEGF的表达比较差异有统计学意义(F=45.981,P<0.05),见表3。

图8 移植前卵巢组织中VEGF的表达较少,棕褐色为VEGF抗体阳性部位(×200)图9 移植后第1天卵巢组织中VEGF的表达,棕褐色为VEGF抗体阳性部位(×200)图10 移植后第3天卵巢组织中VEGF表达,棕褐色为VEGF抗体阳性部位(×200)Fig.8-10 VEGF expression in human ovarian tissue before and after heterotopic transplantation in NOD-SICD mice:brown color indicates the positive site of VEGF antibody

表3 VEGF随移植时间变化的比较结果Table 3 Comparison of changes in VEGF expression with transplantation times
注:*移植第3天与第1天比较,F=11.072,P=0.001;**移植第14天与第3天比较,F=18.564,P=0.001;n=56代表检测移植物的数量。
3讨论
3.1卵巢组织异位移植的血管重建
在卵巢移植技术中,移植成功的关键因素在于卵巢微血管的重建。血管重建是一个较为复杂的过程,其中需多种生长因子的参与。本研究使用血管内皮特异性标记抗体CD34和CD31对其进行标记,以卵巢组织移植后通过两种抗体在不同时间点的表达情况对人卵巢微血管和小鼠新生血管的变化情况进行观察和计算。MVD通常是反映血管新生标志的指标,其应用较为广泛。本研究中以其作为评价血管重建和退化的标志。目前对卵巢组织异位移植后血管生成的研究中,通常认为移植后48~72h内出现新生血管重建现象,但出现该现象的具体时间点因所用动物种属及检测方法不同而异。国外文献报道,大鼠卵巢组织颈部皮下自体移植相关研究结果表明,大鼠卵巢组织移植后48h内,移植物中VEGF表达量显著增加,并观察到血管重建现象;小鼠卵巢组织自体移植结果表明移植后3天观察到有新血管生成;而将大鼠卵巢组织移植到裸鼠的肌肉部位,移植后7天才发生血管重建现象[5-7]。以上结果说明:自体移植发生血管重建所需时长小于异体移植。对于人卵巢组织异体移植血管的相关研究结果表明:人卵巢组织异体移植通常在第2~3天开始有小鼠血管重建和侵入现象发生[8-11]。本研究结果中,各时间点卵巢组织移植物中小鼠血管MVD值和VEGF表达量比较,差异均具有统计学意义,且从第3天开始增加量显著(均P<0.05),与上述相关研究结果较为接近。
血管重建通常是从周边部分向内部延伸。因此卵巢移植物中间位置较边缘部位供血滞后,易发生缺血缺氧损伤。本研究显示,在移植后第3天小鼠血管开始新生和重建,说明其是移植后血供逐步建立时间点,通常认为这种现象的出现说明该时间是发生缺血再灌注损伤的关键时期[8-9];本研究显示,在移植后第14天观察到肌层大血管形成,说明移植后该时间点移植物内的血供体系已基本建立,并达到稳定状态。在血管新生过程中伴随着卵巢组织内人源性血管的逐渐减少,并没有迅速消失,提示在移植早期人源性血管还是可能会对移植物产生一定的影响[10-11],但移植物的后期存活仍有赖于新生血供的快速建立。有学者认为在胰岛组织移植的动物模型中,移植物内小鼠新生血管可能会迁移到退化的人血管在间质中的位置[12],提示不同来源血管的相互取代作用。
3.2血管内皮生长因子在新生血管重建中的表达
血管的新生涉及血管内皮细胞的增殖和迁移和血管的重构,以上过程均受到血管生成因子的调节。VEGF是血管生成强有力的促进剂,由血管平滑肌细胞等产生,通过旁分泌机制特异性作用于存在VEGF受体的血管内皮细胞,具有促进血管内皮细胞分裂增殖和趋化作用,进而诱导血管生成[13-14]。VEGF促进内皮细胞增殖主要由内皮细胞表面的VEGF受体介导,VEGF受体与VEGF结合后引起自身及相关蛋白磷酸化,介导细胞间信息传递和细胞内信号传递,促进内皮细胞分裂增殖[15]。本研究结果表明,卵巢组织移植后处于缺血缺氧状态,该状态可诱导血管组织中VEGF表达量的显著增加,而在移植后第1~3天组织处于缺血缺氧和血管重建状态,因此VEGF的表达较刚移植时显著增加,其原因可能在于促进血管的新生。移植14天后VEGF的表达量开始下降,表明卵巢组织移植物的缺血缺氧状态得到了改善。以上说明VEGF在移植早期表达增加以促进血管生成,在移植后期较多血管建立后,VEGF表达逐渐减低。
3.3结论
本实验是利用种属特异性血管标志物对人冻融卵巢组织异位移植血管生成时程进行研究,首次报道了移植后24h观察到小鼠新生血管的生成,有利于更好地针对卵巢移植缺血期进行保护治疗。
