Thermobifida fusca麦芽三糖淀粉酶的重组表达及其在麦芽三糖制备中的应用
2020-03-28胡凡宿玲恰吴敬
胡凡,宿玲恰,吴敬*
1(食品科学与技术国家重点实验室(江南大学),江苏 无锡,214122) 2(工业生物技术教育部重点实验室(江南大学),江苏 无锡,214122)
麦芽三糖淀粉酶(maltotriose-forming α-amylase,EC 3.2.1.11 6,AmyA)由基因tfa编码,是一种GH13家族的糖苷水解酶。该酶以淀粉或糊精为底物,水解糖链中的α-(1→4)糖苷键,通过内切或外切作用产生麦芽三糖及少量副产物。麦芽三糖是由3个葡萄糖单元经α-(1→4)糖苷键连接而成的麦芽低聚糖,耐热耐酸性能比蔗糖、葡萄糖好,不易发生美拉德反应,用于食品能很好地保护颜色[1]。此外,麦芽三糖渗透压低,持水性和抗结晶性好。它还能促进人体对钙的吸收以及人体有益菌的繁殖,防止蛋白质变性,抑制淀粉老化,是一种理想的保健食品原料[2-4]。
1978年,日本KATSUO首先发现链霉菌(Streptomycesgriseus)NA-468能产生一种淀粉酶水解可溶性淀粉产生大约55%的麦芽三糖[5]。随后,国内外相继研究了BacillussubtilisG3[6]、Microbacteriumimperiale[7]、ChloroflexusaurantiacusJ-10-F1[8]、Natronococcussp. Strain Ah-36[9]、Streptococcusbovis148[10]、ThermobifidafuscaNTU22[11]、Brachybacteriumsp. Strain LB25[12]、Sclerotiniasclerotiorum[13]、Endomycopsisfibuligera[14]、AspergillusnigerCBS513.88[15]等来源的麦芽三糖淀粉酶,其中部分麦芽三糖淀粉酶性质参见表1。
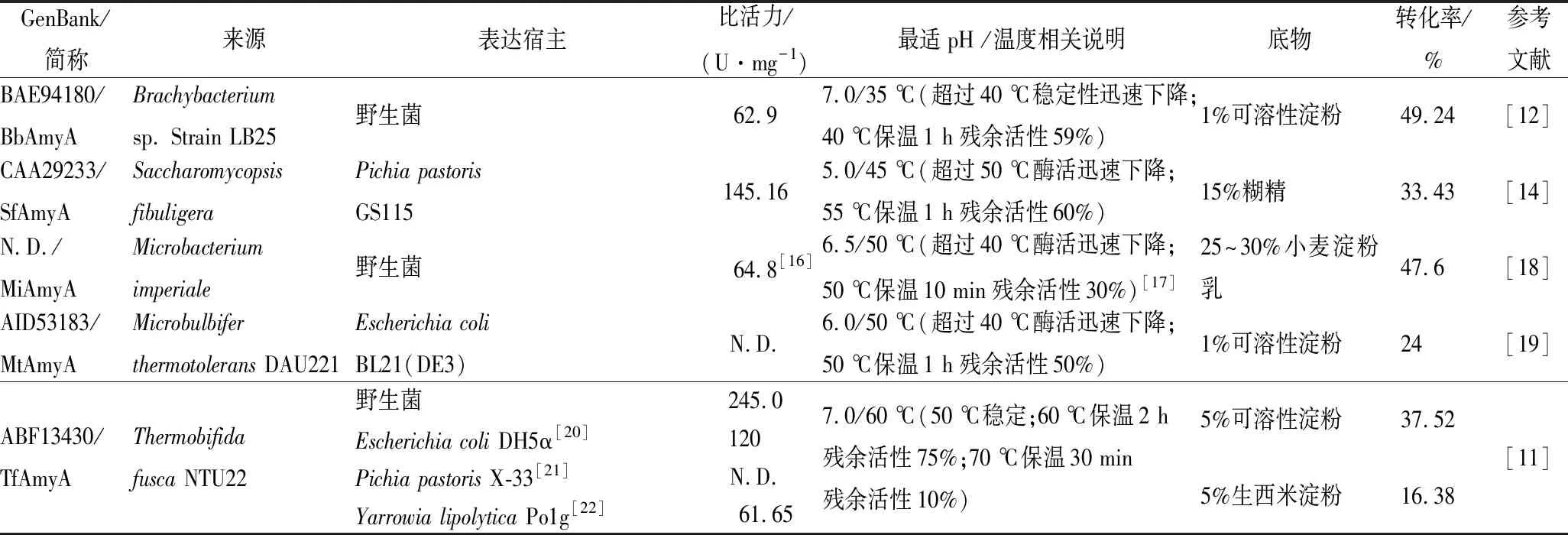
表1 不同物种来源麦芽三糖淀粉酶性质对照
注:“N.D.”表示未被检测或鉴定;GenBank/简称一列中,“/”前代表GenBank accession number,“/”后表示酶的简称;除特殊文献标注外,表格内容参看参考文献一栏
在上述麦芽三糖淀粉酶中,MiAmyA(商品名为AMT 1.2L)目前只由日本Amano公司生产,该酶先后被日本TAKASAKI等[7]、中国吴春森等[16, 23]、徐贵华等[18]报道,其水解小麦淀粉制备麦芽三糖终产率为47.6%[18],中国团队对该酶的研究都是从Amano购买,这极大限制了国内麦芽三糖相关产业的发展。2008年,NORIYUKI等[12]将来源于Brachybacteriumsp. strain LB25的麦芽三糖淀粉酶作用于可溶性淀粉,麦芽三糖终产率为49.24%,但是该酶在40 ℃以上极不稳定,不利于工业应用。
本研究首次将ThermobifidafuscaNTU22来源的麦芽三糖淀粉酶(TfAmyA,编码基因为Tftfa,NCBI登录号ABF13430[20])在食品安全菌株[24]BacillussubtilisWS11中进行了分泌表达,并对重组酶进行了酶学定性,在此基础上探究了制备麦芽三糖的工艺,为麦芽三糖淀粉酶的工业生产中打下基础。
1 材料与方法
1.1 材料
1.1.1 菌株与质粒
BacillussubtilisWS11[25]、EscherichiacoliJM109、pET-20b-Tftfa(本实验室前期构建)、本实验室改造的高效表达载体pHY300PLK(含有g4基因)[25]。
1.1.2 酶及主要试剂
限制性内切酶Q.cutXbaⅠ、Q.cutNotⅠ,宝生物工程(大连)有限公司;DNA聚合酶2×Phanta Max Master Mix、一步克隆试剂盒ClonExpress Ⅱ One Step Cloning Kit,南京诺唯赞生物科技有限公司;SDS-PAGE凝胶快速配制试剂盒,碧云天生物技术;琼脂糖凝胶DNA回收试剂盒TIANgel Midi Purification Kit,天根生化科技(北京)有限公司;蛋白胨、酵母粉,英国Oxiod;其他试剂均为国产分析纯,购自国药集团。普鲁兰酶粗酶液,实验室制备并保存,酶活力为4 000 U/mL。
1.1.3 主要仪器
LS-B50L型立式圆形压力蒸气灭菌器,上海医用核子仪器厂;SHA-1102C空气恒温摇床,上海精密仪器仪表有限公司;Agilent 1200高效液相色谱系统,美国Agilent公司;DYY-6C型核酸电泳仪,北京六一电泳仪厂:FE28-Standard pH计,瑞士Mettler-Toledo公司;超声波细胞粉碎机,宁波新芝生物科技股份有限公司;电热恒温培养箱,上海医疗器械研究所;DKB-600A型电热恒温水槽,上海森信实验仪器有限公司;凝胶成像系统,Bio-Rad 公司;UV-1700紫外可见分光光度计,日本Shimadzu公司;HZ-9212SB恒温水浴摇床,太仓市华利达实验设备有限公司。
1.1.4 培养基
LB液体培养基(g/L):酵母粉5,蛋白胨10,NaCl 10;氨苄青霉素(Amp 100 μg/mL)或者四环素20 μg/mL,固体培养基还应加上琼脂粉15~20。
TB发酵培养基(g/L):酵母粉24,蛋白胨12,KH2PO42.31,K2HPO412.54,甘油5;四环素终质量浓度为20 μg/mL。
1.2 实验方法
1.2.1 引物设计
依据载体pHY300PLK和Tftfa基因序列,设计以下引物(由5’→3’端,下划线部分代表同源臂序列):
pHY300PLK F1:AAGCTTGGTAATAAAAAAACACCTCCA
pHY300PLK R1:CATGGCTTCAGCACTCGCAG

1.2.2 PCR获得载体和基因片段
分别以pHY300PLK-g4和pET-20b-Tftfa为模板,F1/R1、F2/R2为引物扩增pHY300PLK获得载体片段(5856bp)和基因片段Tftfa(1812bp)。PCR体系如下:2×Phanta Max Master Mix 25 μL,上下游引物各2 μL,模板1 μL,ddH2O补足至50 μL。PCR参数:94 ℃ 预变性 4 min;进入PCR循环:98 ℃变性10 s,55 ℃退火30 s,72 ℃延伸6 min或2 min,30个循环;最后72 ℃ 10 min,4 ℃保温[26]。琼脂糖凝胶电泳后切割目的条带进行胶回收,获得纯片段。
1.2.3 目的基因的连接及转化
按照琼脂糖凝胶DNA回收试剂盒回收PCR产物,并一步克隆试剂盒将基因和载体片段进行连接。连接产物转化E.coliJM109,涂布Amp抗性LB固体培养基并于37 ℃培养10 h,挑取单菌落至Amp抗性LB液体培养基于37 ℃ 培养8~10 h后,收集菌体抽提质粒进行双酶切,并送测序公司测序。测序正确的质粒电转化表达宿主B.subtilisWS11,涂布四环素抗性LB固体培养基,于37 ℃培养12 h,挑取单菌落至四环素抗性LB液体培养基于37 ℃培养8~10 h后保存甘油菌B.subtilisWS11/pHY300PLK-Tftfa。
1.2.4 重组菌的摇瓶发酵及SDS-PAGE分析
取20 μL甘油管菌B.subtilisWS11/pHY300PLK-Tftfa接种至10 mL LB液体培养基(含10 μg/mL四环素)中,放置于37℃,200 r/min的恒温摇床中培养8~10 h,取2.5 mL菌液转接至50 mL TB液体培养基(含20 μg/mL四环素)中,先放置于37 ℃,200 r/min的恒温摇床中培养2 h,然后将摇瓶转移至33 ℃,200 r/min的恒温摇床中培养48 h。发酵结束后,以8 000 r/min离心20 min收集上清液,即为粗酶液。取粗酶液进行SDS-PAGE分析。取甘油管菌B.subtilisWS11不添加四环素按上述方法进行摇瓶发酵,最终收集发酵上清液进行SDS-PAGE分析,条带作为阴性对照。
1.2.5 重组酶TfAmyA的纯化及蛋白浓度测定
由于蛋白末端已带上His-Tag,故用镍柱HisTrapTMHP 5 mL纯化TfAmyA。结合缓冲液(A液)成分为:25 mmol/L Tris-HCl,500 mmol/L NaCl,pH 7.4,洗脱缓冲液(B液)成分含300 mmol/L咪唑的A液。用5%的B液洗去杂蛋白后,直接用100% B液洗脱,得到纯化的TfAmyA,经SDS-PAGE验证后,得到电泳纯的单一条带。本实验采用Bradford法测定蛋白浓度[27]。
1.2.6 重组酶TfAmyA最适温度及温度稳定性测定
用50 mmol/L pH 5.5的PBS配制1%可溶性淀粉,将酶稀释至适当倍数后,在40、45、50、55、60、65、70、75 ℃不同温度下,按照DNS法[28]测算酶活力。将最高酶活力定义为100%,其余条件下酶活力折算为相对酶活力,绘制不同温度下相对酶活力折线图。在55 ℃下,将酶温育不同时长,取样进行酶活力测定,将初始酶活力定义为100%,其余时长酶活力折算为相对酶活力,按照时长-相对酶活力绘制折线图。
1.2.7 重组酶TfAmyA最适pH及pH稳定性测定
用pH分别为4.0、4.5、5.0、5.5的50 mmol/L柠檬酸-柠檬酸三钠缓冲液和pH分别为5.5、6.0、6.5、7.0、7.5的50 mmol/L PBS配制1%可溶性淀粉,将酶稀释至适当倍数后,在55 ℃下,按照DNS法[28]测算酶活力。在pH 6.0下,将酶温育不同时长,取样进行酶活力测定,将初始酶活定义为100%,其余时长酶活折算为相对酶活,按照时长-相对酶活力绘制折线图。
1.2.8 重组酶TfAmyA活力测定
用50 mmol/L pH 6.0的PBS配制质量浓度1%的可溶性淀粉,将酶稀释至适当倍数后,按照DNS法[28]测还原糖的量(以葡萄糖作为标准曲线),计算出酶活力。酶活力定义为:每分钟释放1 μmol还原糖所需的酶量计为1个酶活力单位。
1.2.9 制备麦芽三糖的反应条件优化
以15%的麦芽糊精(DE 5-7)为底物,用不同pH(4.5、5.0、5.5、6.0、6.5、7.0、7.5)的50 mmol/L的PBS溶解底物溶解底物,分别以不同麦芽三糖淀粉酶加酶量(0、15、30、45、60、75 U/g底物)添加至底物中,普鲁兰酶以不同加酶量(0、4、8、12、16、20、24、28、32、36、40 U/g底物)添加至反应体系中置于转速为150 r/min、不同温度(40、45、50、55、60 ℃)的水浴摇床中,转化不同时间。用HPLC检测麦芽三糖生成量,每次控制单一变量,逐步优化。
2 结果与分析
2.1 重组菌B. subtilis WS11/pHY300PLK-Tftfa的构建
提取连接产物转化E.coliJM109的质粒进行双酶切,随后进行琼脂糖凝胶电泳,发现除了未被切完的重组质粒外(7 638 bp),还有2条明显的分别对应载体和基因的5 190和2 448 bp(图1),表明重组质粒构建成功。将重组质粒转化入表达宿主B.subtilisWS11,构建重组菌B.subtilisWS11/pHY300PLK-Tftfa。
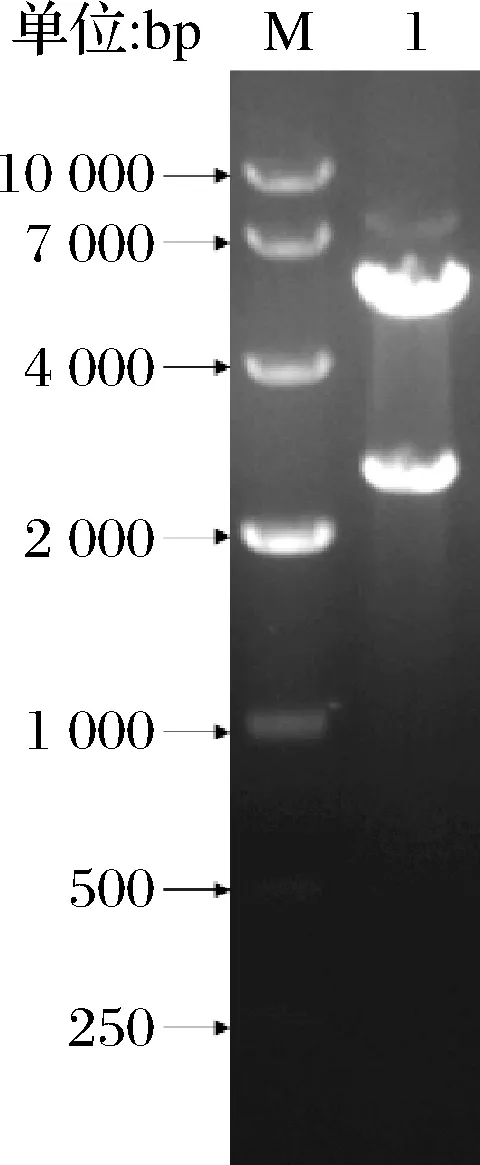
M-DL10000 DNA Marker;1-重组质粒酶切条带
2.2 TfAmyA的表达、纯化及酶学性质分析
2.2.1 TfAmyA的表达
B.subtilisWS11及重组菌B.subtilisWS11/pHY300PLK-Tftfa经TB发酵48 h后,胞外上清SDS-PAGE结果见图2。泳道2为阴性对照,泳道1的63.2 kDa处出现1条蛋白条带,与TfAmyA理论相对分子质量吻合,测得胞外粗酶液的酶活为56.81 U/mL,说明TfAmyA在B.subtilisWS11中成功表达。
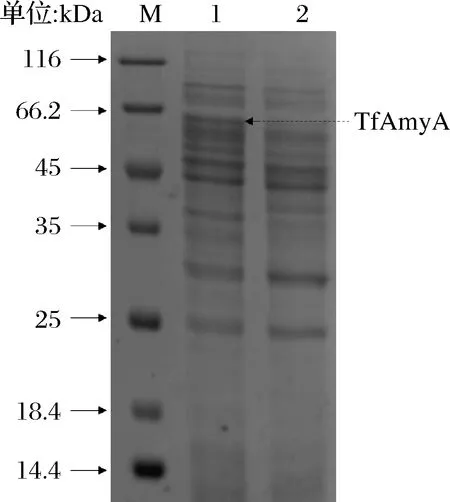
M-中分子量蛋白Marker;1-重组菌胞外上清液;2- B. subtilis WS11胞外上清液
2.2.2 TfAmyA的纯化
采用镍离子螯合层析的方法,得到纯化的TfAmyA,经SDS-PAGE验证后,得到电泳纯的单一条带(图3)。
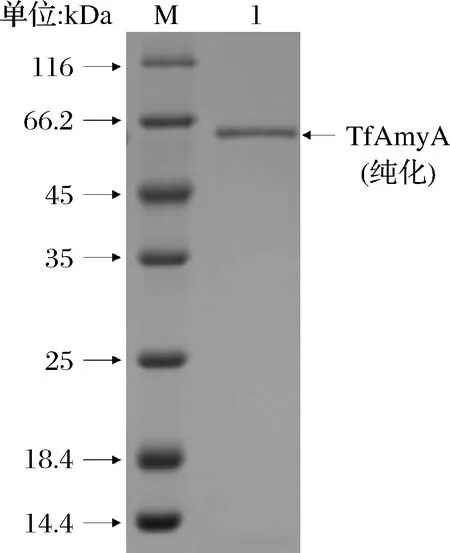
M-中分子量蛋白Marker;1-纯化TfAmyA
纯化过程参数见表2,纯化倍数达到19.8倍,纯酶的比活为412.2 U/mg。同一来源的TfAmyA在不同宿主里的比活力有差异,本研究在B.subtilisWS11中表达获得的TfAmyA均高于文献报道的以大肠杆菌、毕赤酵母及耶氏解脂酵母为宿主菌的TfAmyA比活力(表1)。
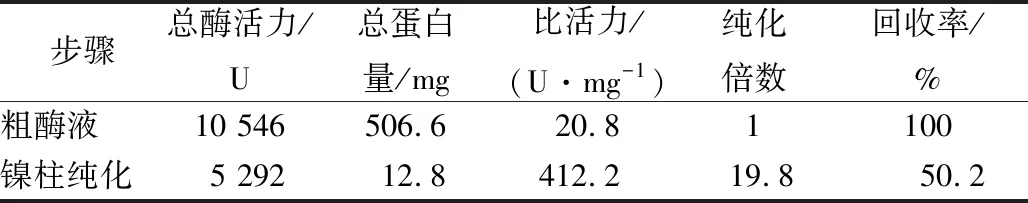
表2 重组TfAmyA纯化过程参数
注:粗酶液的纯化倍数与回收率分别按照1和100%表示
2.2.3 TfAmyA的酶学性质分析
2.2.3.1 TfAmyA的最适温度及温度稳定性
温度影响酶的三维结构、分子热运动[29-31],进而能影响酶促反应的催化速率。从图4可以看出,TfAmyA的最适温度为55 ℃。在40~55 ℃之间,酶活力有40%以上,且随温度提高而提高;在55~65 ℃之间,TfAmyA能维持90%以上的酶活力,在温度>65 ℃时,酶活力迅速降低。这说明,温度对酶活的影响很大。此外,由图5可以看出,在55 ℃温育时,TfAmyA在初始时酶活力最高,随后基本呈现降低趋势。到达195 h,酶活力才降至50%以下,稳定性相比于报道的S.fibuligera[14]、B.subtilisG3[6]、Brachybacteriumsp. Strain LB25[32]、S.griseusNBRC13350[33]、S.avermitilisNBRC14893[33]、Kitasatosporasp. MK-1785[34]以及M.imperiale[7]麦芽三糖淀粉酶要好。
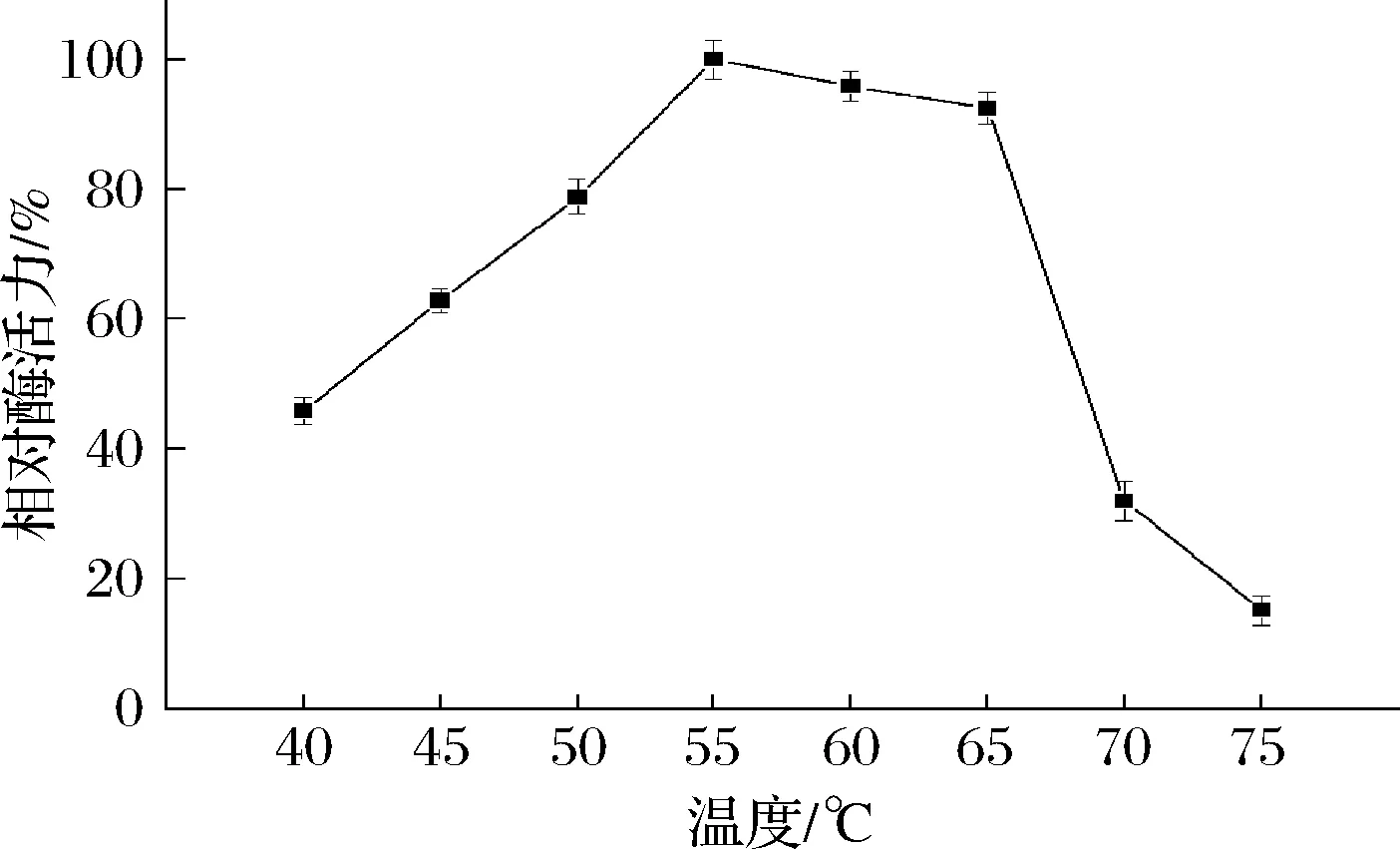
图4 重组TfAmyA的最适酶活力温度
2.2.3.2 TfAmyA的最适pH及pH稳定性
pH影响酶的解离状态,能影响酶促反应的催化速率[35]。从图6可以看出,TfAmyA的最适pH为6.0,与来自Kitasatosporasp. MK-1785[34]、M.thermotoleransDAU221[19]的麦芽三糖淀粉酶一致。当pH在5.5~6.5之间,能保持80%以上的酶活力,超出该范围,酶活力迅速降低。在pH 6.0下测量酶的pH稳定性。由图7可以看出,酶在初始时酶活最高,随后持续降低,超过150 h,酶活力才衰减至50%以下,说明在pH 6.0下该酶稳定性很好。
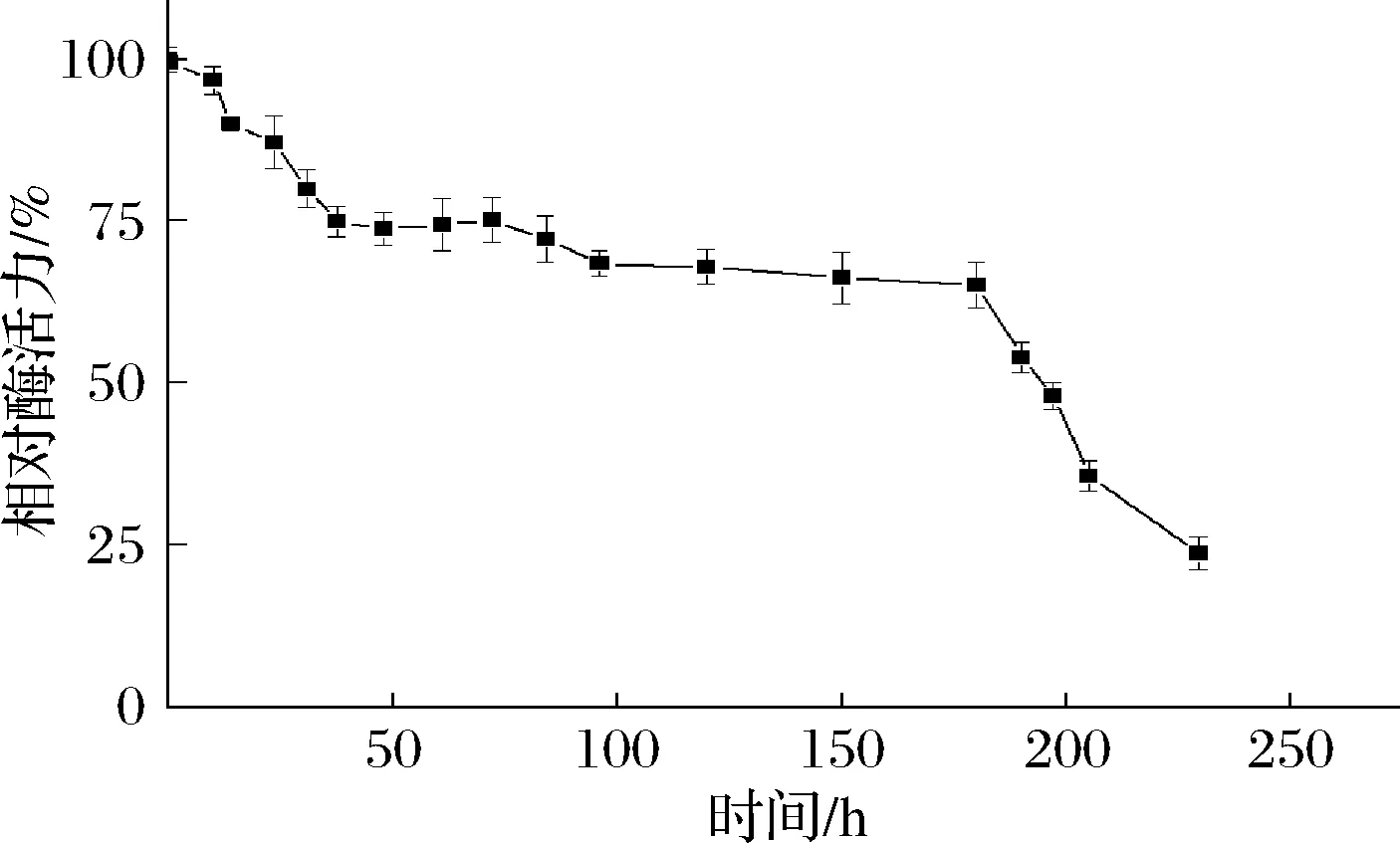
图5 重组TfAmyA的温度稳定性
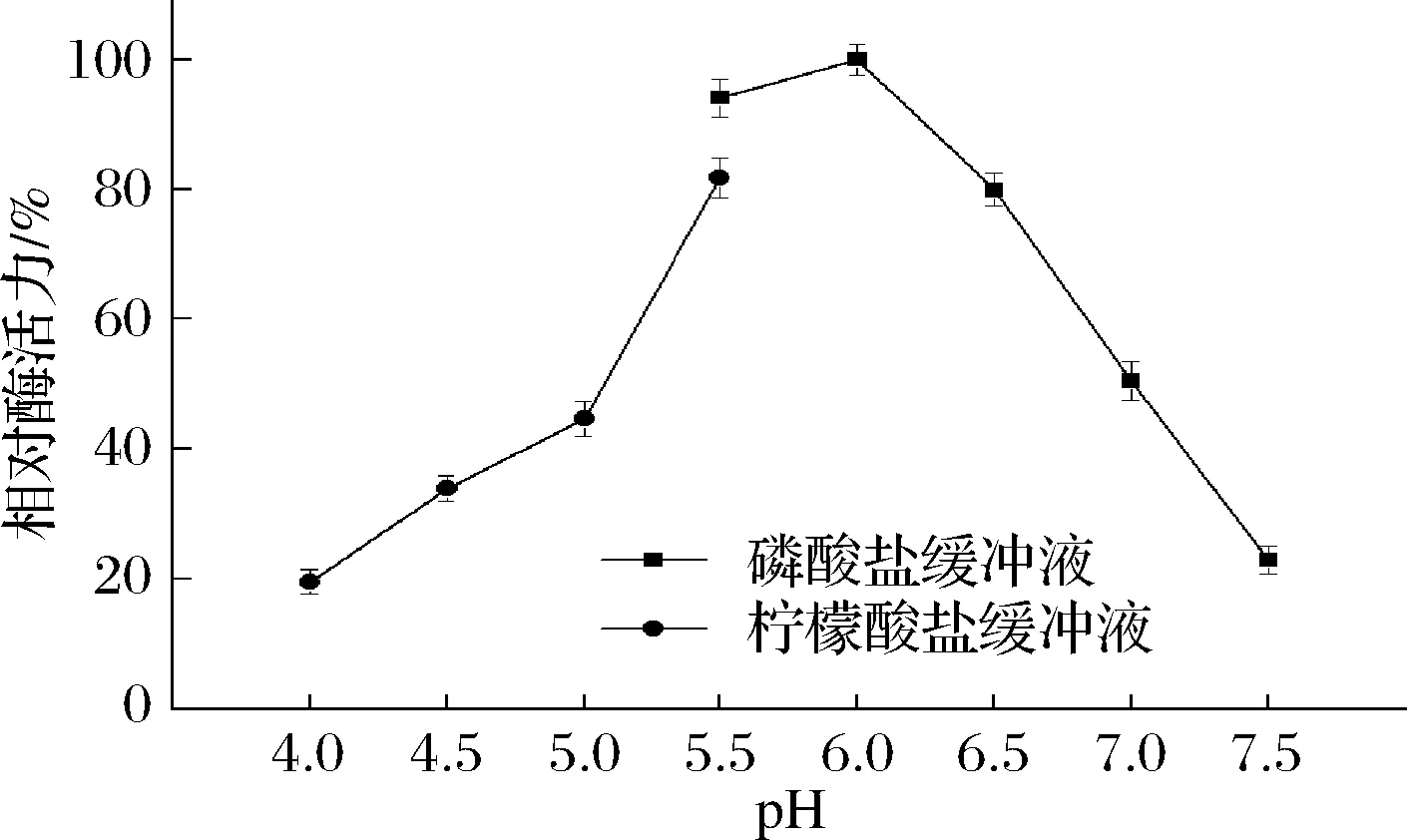
图6 重组TfAmyA的最适pH
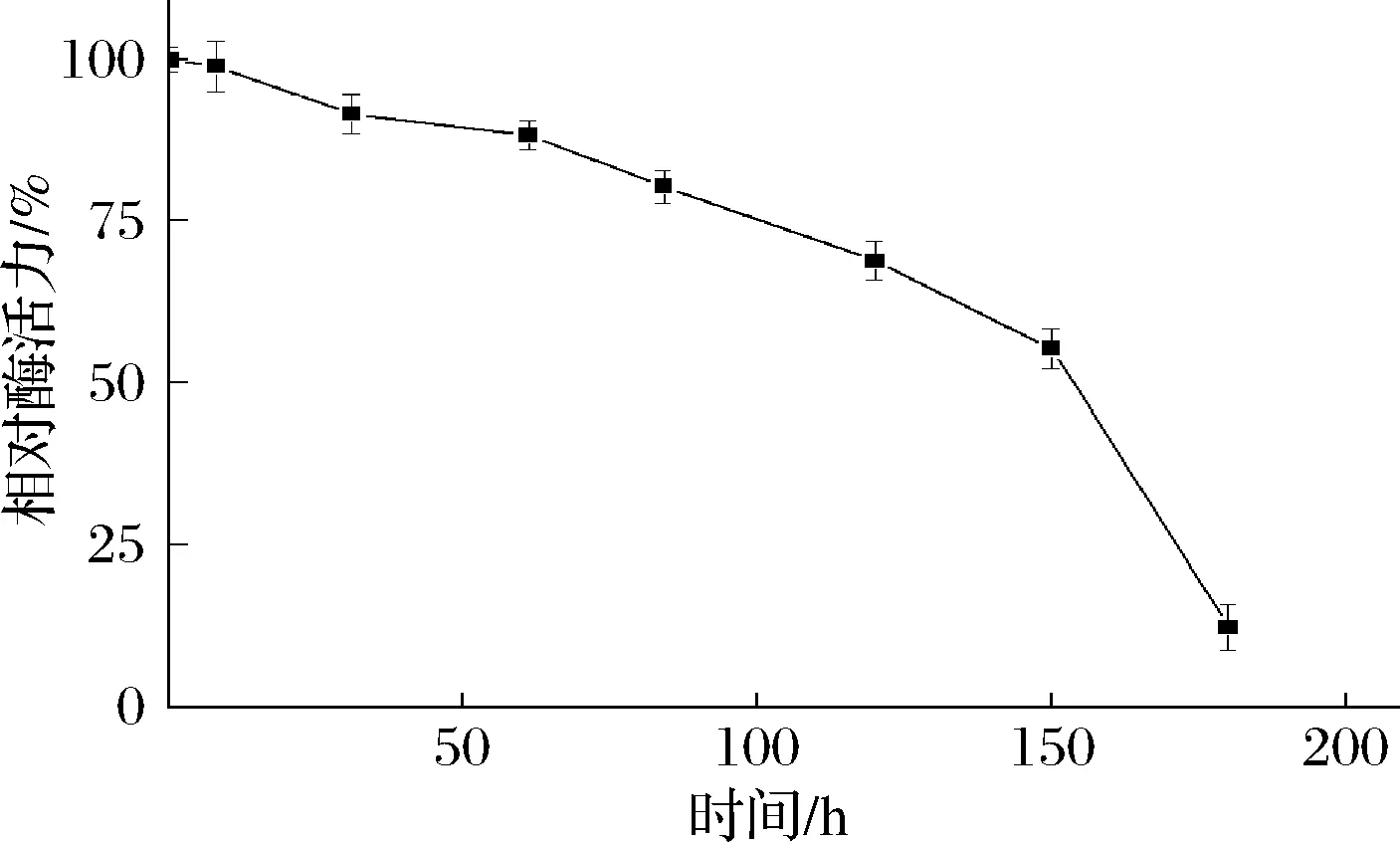
图7 重组TfAmyA的pH稳定性
2.3 重组麦芽三糖淀粉酶制备麦芽三糖工艺优化
2.3.1 麦芽三糖淀粉酶加酶量对麦芽三糖转化率的影响
TfAmyA是一种内切型α-淀粉酶,其作用于麦芽糊精(DE 5-7)能产生以麦芽三糖为主的低聚混合物[20-22]。在加酶量过少时,底物需要长时间反应。增大加酶量,当其达到一定值后,酶转化速率达到饱和,甚至还会水解麦芽三糖[14],降低转化率。从图8可以看出,当加酶量为60 U/g底物时,转化率达到最大,为38.8%。继续增大加酶量,则会降低转化率,与S.fibuligera[14]、S.griseus[36]来源的麦芽三糖淀粉酶相似,TfAmyA会微弱水解麦芽三糖。
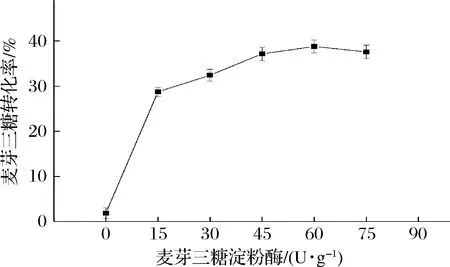
图8 催化制备麦芽三糖的TfAmyA加酶量优化
2.3.2 普鲁兰酶加酶量对麦芽三糖转化率的影响
淀粉或糊精分子的α-(1→6)糖苷键会影响麦芽三糖淀粉酶对其水解作用。因此添加普鲁兰酶,使其与麦芽三糖淀粉酶协同作用,具有提高转化率的实际意义[16, 25, 37]。从图9中可以发现,当加酶量逐步增大时,转化率也逐渐增大,但超过32 U/g底物时,转化率不再增大。因此,最优加酶量为32 U/g底物,此时转化率为41.1%。
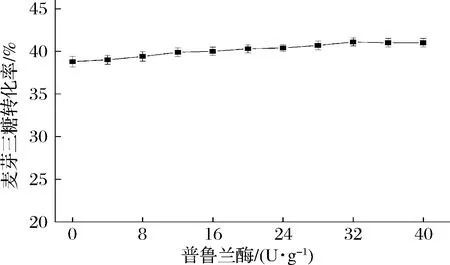
图9 催化制备麦芽三糖的普鲁兰酶加酶量优化
2.3.3 温度对麦芽三糖转化率的影响
温度不仅影响底物的物理状态,还会影响酶活力和半衰期。在上述最优条件基础上,对反应温度进行优化。从图10可知,温度对TfAmyA的催化作用影响较大,酶的最适温度也是酶转化最优温度。低于55 ℃时,酶催化转化率随着温度提高而提高,55 ℃达到最大,为41.1%。当反应温度继续增大时,酶的稳定性降低,转化率下降。
2.3.4 pH对麦芽三糖转化率的影响
pH影响酶的电解状态,进而会影响酶活力及稳定性,从而会影响到酶转化的效果[34-35, 38],因此实验探究了不同初始pH对转化率的影响。图11中值得关注的是,与酶活力最高的pH不同,酶转化的最适pH是5.5。在初始反应pH<5.5时,转化率随pH提高而提高,在pH 5.5时达到最大,此时转化率为42.3%,当pH继续提高时,转化率会逐渐下降。因此,后续反应采用pH 5.5的条件。
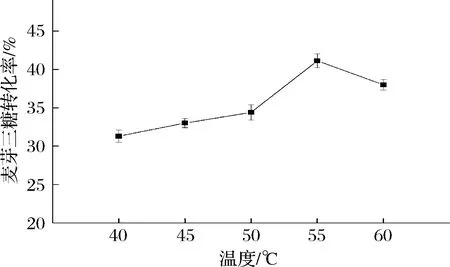
图10 催化制备麦芽三糖的温度优化
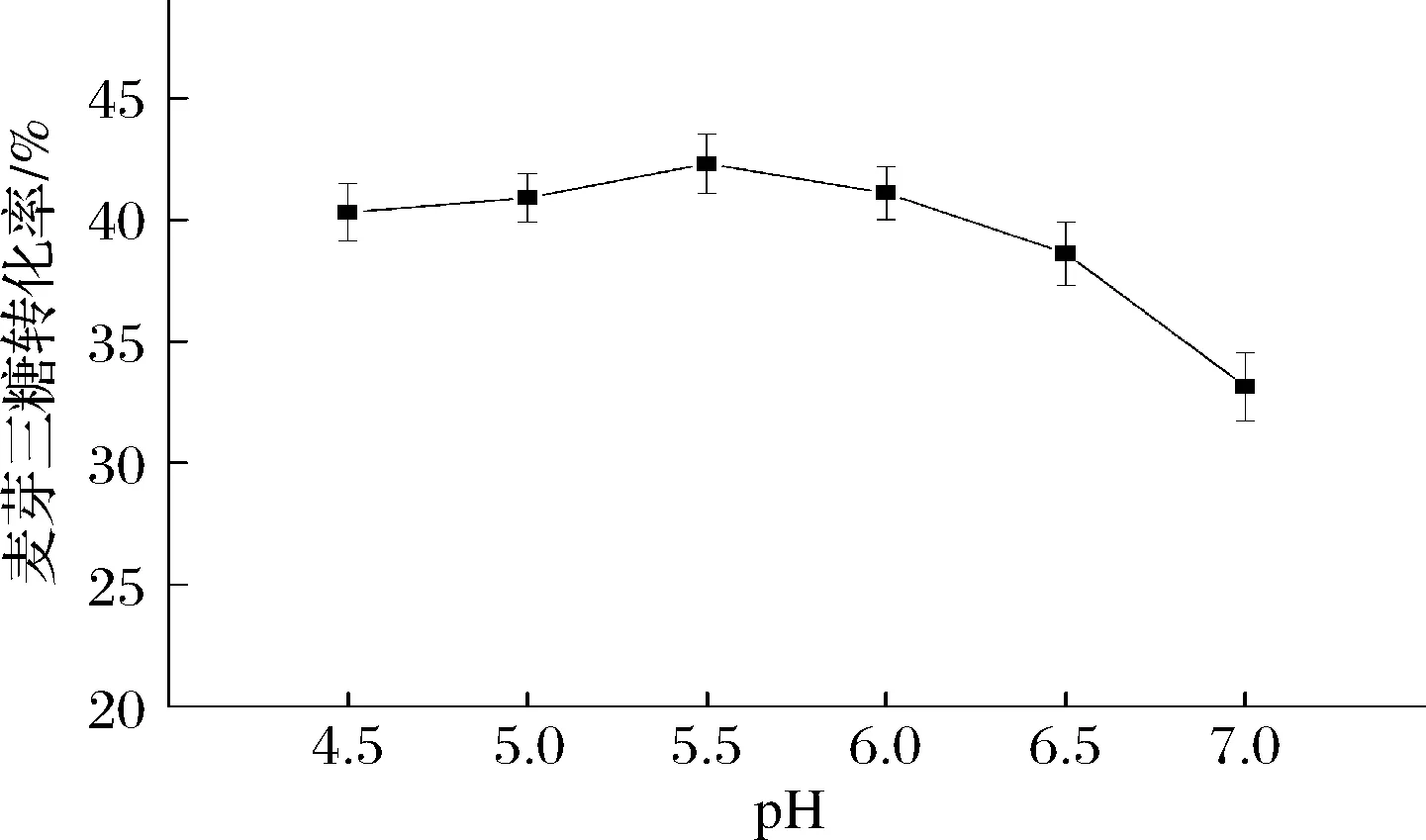
图11 催化制备麦芽三糖的初始pH优化
2.3.5 反应时间对麦芽三糖转化率的影响
反应时间增长时会导致酶活力略微下降,同时TfAmyA也会继续水解麦芽三糖,从而降低转化率[14, 36]。从图12可知,在反应时间达到11 h之前,转化率随反应时间增长而增大,11~14 h之间,转化率基本不变。综合考虑,选择11 h作为最优酶转化时长,此时转化率为44.4%。
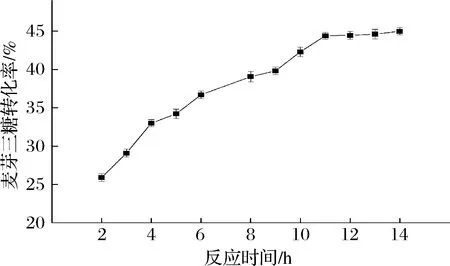
图12 催化制备麦芽三糖的反应时间优化
从表1可看出,相比于BbAmyA的转化率49.24%与MiAmyA的转化率47.6%,TfAmyA的转化率要偏低,但是BbAmyA最适温度低且温度稳定性差,底物浓度也偏低,而MiAmyA相关信息被商业垄断,这2种酶显然不适于现在的淀粉糖工业。目前报道的部分其他来源的AmyA的转化率、比活力都不如TfAmyA, 55 ℃下稳定的TfAmyA将更适于工业应用。
3 结语
目前制备麦芽三糖的方法主要分为2种,一种是利用普鲁兰酶水解普鲁兰多糖获得,以此法得到的麦芽三糖虽然纯度高,但限于普鲁兰多糖的生产成本,不适合用于食品原料的制备;另一种是通过AmyA水解淀粉原料而获得[2]。
本研究首次将ThermobifidafuscaNTU22来源的麦芽三糖淀粉酶在BacillussubtilisWS11中进行了重组表达。重组菌在TB培养基中发酵48 h,胞外酶活达到56.81 U/mL。纯化后,比活达到412.2 U/mg,比目前所知的其他来源AmyA及同源异种表达TfAmyA的比活力都要高。在此基础上探究了制备麦芽三糖的工艺。利用TfAmyA对麦芽糊精(DE 5-7)进行酶转化实验。结果表明,当麦芽糊精的质量浓度为15%,温度为55 ℃,pH 5.5,TfAmyA加酶量为60 U/g底物,普鲁兰酶加酶量为32 U/g底物,反应11 h时,转化率最高达到44.4%。TfAmyA在一定程度上避免了麦芽三糖淀粉酶的热不稳定及商业垄断性,后续实验可以从培养基的发酵优化、不同类型或不同质量浓度淀粉底物、分子改造提高酶催化产物专一性等方面优化麦芽三糖淀粉酶制备麦芽三糖的工艺,为其在食品行业的应用提供借鉴意义。
