尿毒症患者发生骨质疏松症的危险因素分析
2020-03-27戚爱清
戚爱清
(江苏省盐城市大丰区第二人民医院,江苏盐城 224100)
尿毒症是肾功能不可逆损害的终末期,除心血管、呼吸、肠道、血液等系统功能严重紊乱外,20%的患者会并发骨质疏松症(Osteo porosis,OP),甚至出现骨痛、行走不便、自发性骨折等[1]。Kieneker等[2]认为,OP的发生可能与血浆钙离子浓度过高有关,且随着肾小管对钙离子的重吸收和磷酸盐排泄障碍不断加剧,患者骨质流失会逐渐增加。但尿毒症作为一组临床综合征,继发骨质疏松症的病因尚未完全清楚,故本研究对207例尿毒症患者资料进行回顾性分析,为临床防治尿毒症患者骨质疏松症提供依据。
1 资料与方法
1.1 一般资料
纳入标准:(1)符合尿毒症诊断标准[3];(2)尿毒症前无骨质疏松症或骨折;(3)无脊椎转移肿瘤或先天畸形。排除标准:(1)合并传染性疾病、意识障碍、急性脑血栓等;(2)其他疾病引起的骨代谢异常或骨生成障碍;(3)临床或随访资料不全。回顾本院2015年2月~2017年1月收治的207例尿毒症患者资料,男114例,女93例;年龄34~81岁,平均(62.5±7.4)岁;病程3~14年,平均(6.7±1.2)年;原发病:慢性肾小球肾炎65例,糖尿病肾病52例,慢性肾盂肾炎34例,高血压肾小动脉硬化29例,慢性间质性肾炎18例,其他9例。
1.2 方法
患者确诊为尿毒症后,均接受血液透析、促红细胞生成素(erythropoietin,EPO)、维生素D、钙剂、抗生素等治疗,并合理膳食及锻炼,定期监测病情变化。从初次治疗后即开始随访2年,根据血钙、磷及碱性磷酸酶、骨更新标记物、胸腰椎部位的X线片和骨密度(bone mineral density,BMD)等进行判断,胸腰椎BMD降低2.5 SD即为OP。
根据是否发生OP分为研究组(有骨质疏松症者),对照组(无骨质疏松症者),比较两组的年龄、性别、透析次数、血红蛋白、总蛋白量、肾肌酐清除率、24h尿量、甲状旁腺素(Parathyroid hormone,PTH)、血磷、血钙、抗酒石酸酸性磷酸酶(Tartrate resistant acid phosphatase,TRAP)、骨碱性磷酸酶(Bone alkaline phosphatase,BALP)、骨钙素(Bone gla protein,BGP)。其中,血红蛋白、总蛋白量、PTH、血磷、血钙、TRAP、BALP、BGP是通过抽取患者5 ml空腹血,3000 r/min离心处理10 min后取上层清液,用对应的ELISA试剂盒及深圳雷杜生命科学股份有限公司的Chemray240全自动生化分析仪测定。
1.3 统计学分析
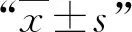
2 结果
207例患者共发生OP 50例,发生率24.15%。单因素分析显示,研究组的透析次数、血红蛋白、总蛋白量、肾肌酐清除率显著低于对照组,PTH、TRAP、BALP、BGP显著高于对照组,差异均有统计学意义(P<0.05),见表1。以是否发生骨质疏松症为因变量,单因素分析中具有统计学意义的项目为自变量,经多因素Logistic回归分析,血红蛋白(OR=3.719 )、总蛋白量(OR=4.151)、肾肌酐清除率(OR=3.628)、TRAP(OR=4.085)、BALP(OR=5.758)是尿毒症患者发生骨质疏松症的危险因素(P<0.05),见表2。
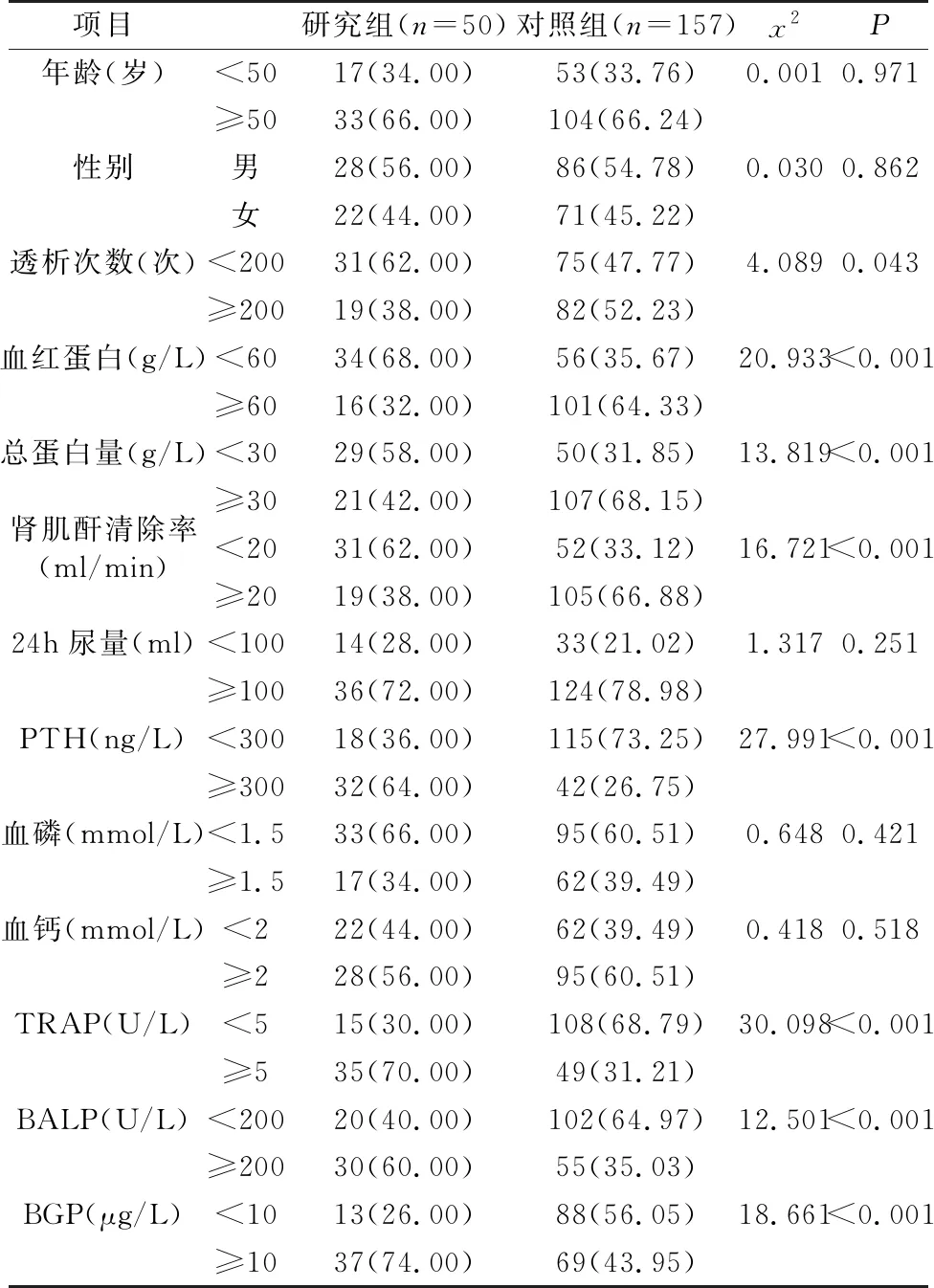
表1 尿毒症患者骨质疏松症发生率及单因素分析
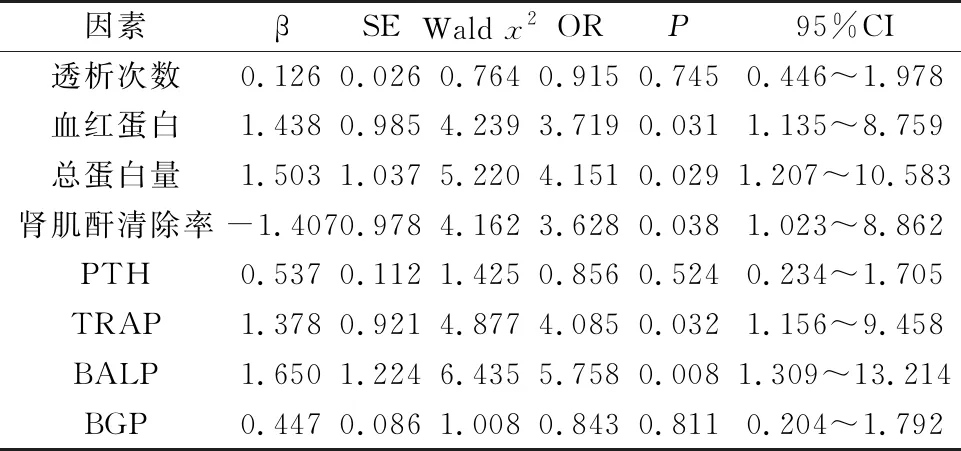
表2 尿毒症患者发生骨质疏松症的多因素Logistic回归分析
3 讨论
尿毒症的临床治疗是透析结合药物以延长患者生存期为主,据国内外报道,患者坚持每周2~3次的血液透析,生存期可达10~20年,并能有效清除体内尿素蓄积,减少高血磷对1,25二羟基维生素D3的抑制,从而加强机体对骨形成和骨吸收的代谢调节,降低骨质疏松的发生[4]。因此,研究组的透析次数明显低于对照组,但透析引起的严重贫血、心血管疾病、胃肠不适、感染等并发症亦不容忽视,加之高额的医疗费用,很少有患者能达到长期规律的透析。所以,通过规范透析治疗来减少尿毒症患者OP的发生,还有待进一步研究。
研究组的血红蛋白、总蛋白量显著低于对照组,这是因为血红蛋白与总蛋白含量的降低,会使总蛋白维持血液正常胶体渗透压、运输多种代谢物质、营养组织等作用减弱,从而影响成骨细胞或因子形成不足,局部骨组织钙盐与基质比例失衡,加速OP的发生[5]。其次,肾脏可分泌EPO,加速血红蛋白的生成,改善呼吸系统功能,肾功能衰竭程度越为严重,血红蛋白及总蛋白含量越低,进而形成骨质疏松的恶性循环,使各类临床症状持续进展[6]。此外,OP会引起的机体内难溶性小分子有机物和无机离子的含量升高,与肾肌酐清除功能相互作用,加重尿毒症的临床症状[7]。
肌酐是肌酸的代谢产物,一般以恒定的速度产生和释放到血液中,再经肾脏,从尿液排出体外,当肾肌酐清除率下降到一定程度,就会加速骨质溶解,推动骨质疏松的发生发展[8]。OP是尿毒症患者骨代谢紊乱的常见病,在患者的透析治疗中,既可因PTH过高而出现纤维囊性骨炎,易发骨盐溶化、肋骨骨折,又可因PTH浓度偏低及成骨因子不足,而难以维持骨的再生[9]。同时,若患者长期大量服用活性维生素D、钙剂等,或透析液含钙量过高,PTH的生成分泌也会相对降低,从而不利于骨的形成[10]。但刘莉等[11]认为,PTH在增强破骨细胞活性时,成骨细胞的活性也会随之增强,进而刺激BALP的升高,故而不能单纯的认为尿毒症患者OP的发生是由PTH所导致的。TRAP主要存在于破骨细胞、红细胞、巨噬细胞中,其过度表达的大鼠模型表现为骨质疏松[12]。而BALP是从骨质中分泌而来,当骨中的钙盐沉淀不足时,该分泌就会升高,并与TRAP构成了骨代谢与形成的稳态平衡[13]。BGP由成骨细胞合成及分泌,血清水平较为稳定,且不受骨吸收因素影响,但可因PTH的升高而升高[14]。因此,研究组的PTH、TRAP、BALP、BGP均显著高于对照组,但经多因素Logistic回归分析,PTH、BGP均为尿毒症患者发生骨质疏松症的混杂因素。
综上所述,血红蛋白、总蛋白量、肾肌酐清除率、TRAP、BALP是尿毒症患者发生OP的危险因素,但其他研究表明,尿毒症OP的发生有一定的特异性,如尿毒症患者同时又是围绝经期女性时,其OP发生率远高于同类人群。所以,临床在为尿毒症患者或肾功能衰竭早期患者进行治疗时,还需综合个体实际情况针对性进行骨质疏松的预防。
